Терминация трансляции.
Терминация представляет собой завершение синтеза полипептидной цепи и освобождение ее от рибосомы (рисунок 3.4).
  Рисунок 3.4 - Общая схема высвобождения белка из рибосомы в процессе биосинтеза
Рисунок 3.4 - Общая схема высвобождения белка из рибосомы в процессе биосинтеза
|
Сигналами окончание синтеза, являются стоп-кодоны (или терминирующие) на цепи мРНК (см. таблицу 3.1). У этих кодонов нет комплементарных антикодонов тРНК, поэтому при достижении их рибосомой синтез прекращается. В А-центр вместо аа-тРНК входят белковые факторы терминацииRRF, RF1 и RF2.
Под действием этих факторов в Р-центре гидролизуется связь тРНК-полипептид. Освобожденный полипептид диффундирует из рибосомы. Вслед за этим происходит диссоциация комиплекса мРНК-рибосома, а затем рибосома распадается на отдельные субъединицы (малую и большую). После связывания этих частиц с другой молекулой мРНК весь процесс биосинтеза вновь повторяется.
Схема всех стадий процесса трансляции (биосинтеза белка) приведена на рисунке 3.5. Показаны условия, необходимые для начала инициации, формирование инициирующего комплекса, протекание элонгации, транслокации, действие пептидилтрансферазы, и наконец терминации процесса.
Синтез белка — процесс, протекающий со значительной затратой энергии. На образование одной полипептидной связи порядка шести молекул макроэргов. Так, при активации аминокислот АТФ гидролизуется до
| перемещение
рибосомы вдоль мРНК
| |
| пептидилтрансфераза
(образование
пептидной связи)
| |
| 50S субчастица
30S субчастица
мРНК
тРНК
| |
| fMet
мРНК
30S субчастица
ГТФ
IF1
IF2
IF3
| |

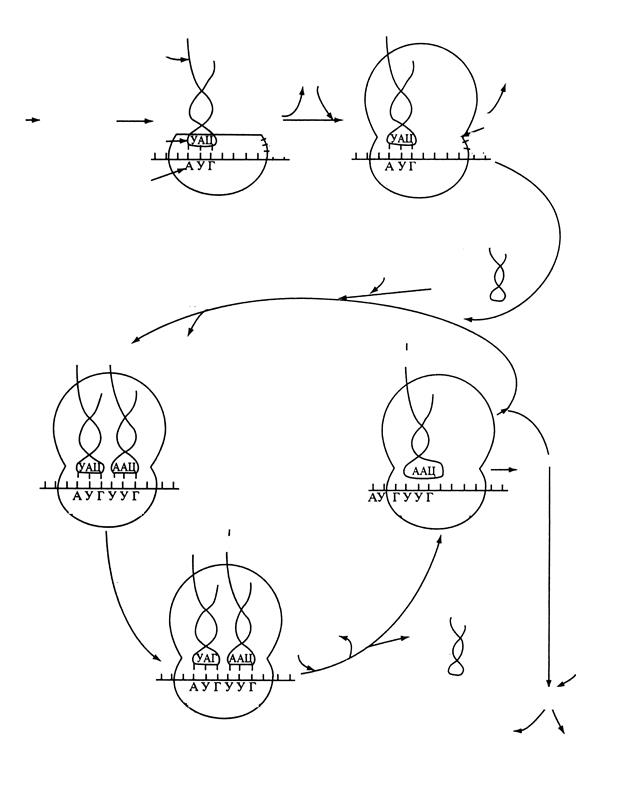
IF1, IF2, IF3 – факторы инициации, EF1, EF3 – факторы элонгации
Рисунок 3.5 – Основные этапы трансляции
АМФ, что эквивалентно затрате двух макроэргов, а инициация трансляции требует один макроэрг – ГТФ. В процессе элонгации затрачивается два макроэрга ГТФ: один на доставку аминоацил-тРНК в А-центр рибосомы, а второй — на процесс транслокации. И, наконец, на терминацию требуется один макроэрг ГТФ.
После окончания биосинтеза полипептидной цепи начинается период посттрансляционных превращений полипептида. Эти модификации могут включать в себя: частичный протеолиз (расщепление), модификации аминокислот (карбоксилирование, фосфорилирование, гликозилирование, ацилирование и др.), формирование пространственной структуры белка, образование дисульфидных связей, присоединение простетических групп, образование олигомерных структур и т.д.
Ранее формирование пространственной структуры (фолдинг илисвертывание полипептида) считалось самопроизвольным процессом, в результате которого возникала активная форма белка, энергетически более выгодная и стабильная, нежели хаотичный клубок полипептида. Последние исследования в области молекулярной биологии показали, что пространственная структура белка формируется при участии специальных белков – шаперонов (или белков теплового шока) – белковых комплексов, которые предупреждают неправильное сворачивание полипептида при выходе его из рибосомы и формируют нативную конформацию белка. Механизм сворачивания основан на способности шаперонов изменять кинетику межмолекулярных взаимодействий аминокислотных остатков, причем пространственная структура в конечном итоге будет все-таки опредляться аминокислотной последовательностью белка. Связывание шаперонов с фрагментами полипептидной цепи стабилизирует частично свернутую молекулу до того момента, пока не произойдет правильное пространственное сворачивание белка.
Регуляция синтеза белка.Регуляция синтеза белка очень сложный процесс, поскольку транскрипция и трансляция происходят в разных компартментах и обеспечиваются большим количеством соответствующих структур.
На уровне транскрипции регуляторные механизмы у прокариот и эукариот имеют ряд общих черт, а именно регуляция по механизму индукции и репрессии.
Регуляция по механизму индукции (на примере лактозного оперона). В отсутствие индуктора (лактозы) белок-репрессор связан с оператором. Поскольку участки оператора и промотора перекрываются, присоединение репрессора к оператору препятствует связыванию ДНК-полимеразы с промотором и транскрипция структурных генов оперона не идет. Когда индуктор (лактоза) появляется в среде, то присоединяется к белку репрессору, изменяя его конформацию и снижая сродство к оператору. РНК-полимераза связывается с промотором и траскрибирует структурные гены. В результате синтезируются ферменты, принимающие участие в утилизации лактозы (молочного сахара) (рисунок 3.6).
  П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.6 - Схематическое изображение регуляции синтеза белка
путем индукции
П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.6 - Схематическое изображение регуляции синтеза белка
путем индукции
|
Регуляция по механизму репрессии.При регуляции оперона по механизму репрессии белок-репрессор не имеет сродства к оператору. Когда к белку-репрессору присоединится молекула-корепрессор (например, конечный продукт метаболического пути), то в результате конформационных изменений белка комплекс белок-репрессор-корепрессор приобретает сродство к оператору и прекращает транскрипцию (рисунок 3.7).
 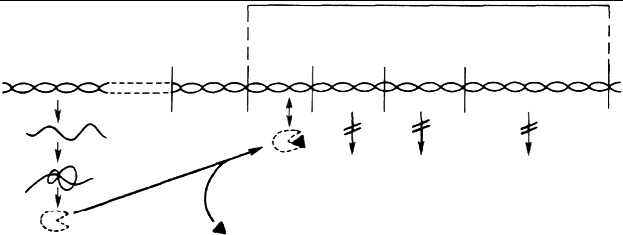 П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.7 - Схематическое изображение регуляции синтеза белка
путем репрессии
П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.7 - Схематическое изображение регуляции синтеза белка
путем репрессии
|
В клетках высших организмов существует два типа регуляции путем индукции и репрессии – кратковременная и длительная. С помощью первой, регулируется содержание белков в клетках в условиях изменения окружающей среды, с помощью второй –дифференцировка клеток и белковый состав тканей и органов.
Кроме того, для клеток эукариот характерна амплификация генов и их перестройка. Оба механизма обеспечивают резкое увеличение копий тех или иных белков, необходимых для реализации клеточного метаболизма.
Известно, что в клетках эукариот ДНК, соединенная с белками (гистонами), упакована в нуклеосомы. В этом состоянии транскрипция невозможна, и для экспрессии генов необходимо деблокирование транскриптона. Одним из возможных путей активирования транскриптона является процесс фосфорилирования гистонов. В результате действия белковых гормонов происходит опосредованное фосфорилирование ядерных белков (гистонов) и разрушение нуклеосом. Матрица при этом становится доступной для основных факторов инициации транскрипции, и начинается синтез РНК. При прекращении действия гормонов нуклеосомы восстанавливаются.
Ацетилирование и деацетилирование гистонов еще один из факторов регуляции генной активности. В результате ацетилирования положительный заряд белка уменьшается, и сродство гистона к отрицательно заряженной ДНК снижается. Это может привести к разрушению нуклеосом и деблокированию транскриптона. Деацетилирование гистонов приводит к противоположному эффекту.
Скорость синтеза белка напрямую зависит от количества мРНК, которое определяется временем ее «полужизни» или стабильностью in vivo.
Лимитирующей стадией процесса трансляции является ее инициация. Регуляция синтеза белка осуществляется также на стадии процессинга белка. Модификации новосинтезированных полипептидов осуществляются при помощи соответствующих ферментов, активность которых, в свою очередь, находится под генетическим контролем.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Как называется процесс биосинтеза ДНК? Дайте краткую характеристику данного процесса.
2. Как называется процесс биосинтеза РНК? Дайте краткую характеристику данного процесса.
3. Дайте поределение интронам, экзонам, сплайсингу.
4. Как называется процесс биосинтеза белка? Дайте краткую характеристику данного процесса.
5. Что такое генетический код? Перечислите его свойства.
6. Перечислите основные уровни регуляции биосинтеза белка. Дайте им краткую характеристику, приведите примеры.
Дата добавления: 2017-08-01; просмотров: 3416;

 Рисунок 3.4 - Общая схема высвобождения белка из рибосомы в процессе биосинтеза
Рисунок 3.4 - Общая схема высвобождения белка из рибосомы в процессе биосинтеза



 П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.6 - Схематическое изображение регуляции синтеза белка
путем индукции
П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.6 - Схематическое изображение регуляции синтеза белка
путем индукции

 П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.7 - Схематическое изображение регуляции синтеза белка
путем репрессии
П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.7 - Схематическое изображение регуляции синтеза белка
путем репрессии
