Растворов электролитов
В растворах электролитов перенос электричества осуществляется за счет перемещения ионов. Для количественной характеристики способности растворов проводить электрический ток при приложении электрического напряжения используется электрическая проводимость (удельная и молярная).
Удельная электрическая проводимость раствора электролита – это электрическая проводимость раствора, заключенного между двумя плоскими электродами, площадью 1 м2 каждый, расположенными параллельно на расстоянии 1 м друг от друга. Требования к электродам (плоские, параллельно расположенные) вытекают из необходимости создания однородного электрического поля.
Удельная электрическая проводимость æ является величиной, обратной удельному электрическому сопротивлению r:
æ = 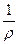
| (2.1) |
Удельное электрическое сопротивление r определяется из уравнения:
 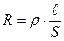 , ,
| (2.2) |
где R – электрическое сопротивление, Ом;
 – расстояние между электродами, м;
– расстояние между электродами, м;
S – эффективное поперечное сечение раствора электролита, заключенного между электродами, м2.
Единица измерения удельного электрического сопротивления – Ом×м. Следовательно, удельная электрическая проводимость æ выражается в Ом-1×м-1 или в См/м (сименс на метр).
Экспериментальное определение электрической проводимости растворов основано на измерении сопротивления кондуктометрической ячейки с платиновыми электродами и исследуемым раствором. Для любой ячейки можно определить константу k, которая называется постоянной кондуктометрической ячейки, и рассчитать удельную электрическую проводимость раствора по уравнению:
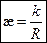 , ,
| (2.3) |
где k – постоянная кондуктометрической ячейки, м–1; R – измеренное сопротивление ячейки с раствором, Ом.
Постоянную кондуктометрической ячейки k выражают в м-1 и определяют по раствору, удельная электрическая проводимость которого известна (обычно используют раствор хлорида калия).
Удельная электрическая проводимость зависит от переносимого каждым ионом заряда, концентрации ионов, скорости их перемещения (см. формулу (2.10)). Последнее затрудняет сравнение различных электролитов по их электрической проводимости. Поэтому чаще пользуются молярной электрической проводимостью.
Молярная электрическая проводимость l – это проводимость раствора электролита, содержащего 1 моль растворенного вещества и находящегося между двумя плоскими электродами, расположенными параллельно на расстоянии 1 м друг от друга.
Молярная и удельная электрические проводимости связаны между собой уравнением:
l = 
| (2.4) |
где c – молярная концентрация электролита, моль/м3.
Молярную электрическую проводимость измеряют в
Ом-1×м2×моль-1 или См×м2/моль.
Такую величину как эквивалентная электрическая проводимость в настоящее время применять не рекомендуется.
Молярная электрическая проводимость возрастает с уменьшением концентрации раствора электролита, достигая максимального значения l¥ при ¥ разбавлении. Поскольку в предельно разбавленном растворе взаимодействие между ионами отсутствует, можно считать, что каждый ион движется независимо от других ионов и, следовательно, с максимальной скоростью.
В условиях предельного разбавления электролитов выполняется закон Кольрауша:
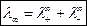 , ,
| (2.5) |
где 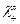 и
и 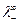 – молярные электрические проводимости соответственно катиона и аниона при бесконечном разбавлении.
– молярные электрические проводимости соответственно катиона и аниона при бесконечном разбавлении.
Перемещение иона в электрическом поле характеризуют величиной электрической подвижности ui, равной скорости движения иона в электрическом поле υi, деленной на напряженность этого электрического поля E:
| ui = υi/E | (2.6) |
Если скорость движения иона υi выражается в м/с, а напряженность электрического поля E – в В/м, то единицей измерения электрической подвижности ui будет м2/(В×с).
Другой величиной, часто используемой при рассмотрении растворов электролитов, является число переноса t, представляющее собой долю общего количества электричества, переносимую ионами данного вида:
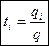 , ,
| (2.7) |
где qi – количество электричества, переносимого i-ми ионами, Кл;
q – количество электричества, переносимого всеми ионами, Кл.
Числа переноса ионов связаны с электрическими подвижностями ионов следующими соотношениями:
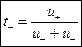 , ,
| (2.8.1) |
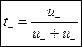 , ,
| (2.8.2) |
где u+ и u– – электрические подвижности катиона и аниона соответственно; t+ и t– – числа переноса соответственно катиона и аниона.
Алгебраическое суммирование уравнений (2.8.1) и (2.8.2) дает следующую очевидную формулу:
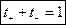
| (2.9) |
Связь между удельной электрической проводимостью æ и электрическими подвижностями ионов ui выражается уравнением:
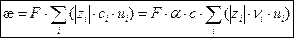 , ,
| (2.10) |
где F = 96485 Кл/моль – постоянная Фарадея;
zi – зарядовое число иона i-го вида;
сi – молярная концентрация i-х ионов, моль/м3;
ui – электрическая подвижность i-го иона, м2/(В×с);
α – степень диссоциации электролита;
c – молярная концентрация электролита, моль/м3;
ni – число ионов i-го вида в формульной единице электролита.
Для слабых электролитов используется понятие степени диссоциации a. При диссоциации слабого 1,1-зарядного электролита:
КА  К+ + А–
К+ + А–
степень диссоциации a определяется формулой:
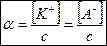 , ,
| (2.11) |
где [К+] и [А–] – равновесная молярная концентрация катионов и анионов соответственно, моль/л; с – молярная концентрация электролита, моль/л.
Константа диссоциации Кдис электролита КА выражается по закону действующих масс уравнением:
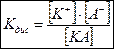 , ,
| (2.12) |
где [КА] – равновесная молярная концентрация недиссоциированных молекул электролита, моль/л.
Выразим молярные концентрации ионов К+ и А– и недиссоциированных молекул КА через степень диссоциации a, используя формулу (2.11) и уравнение материального баланса (2.15):
| [К+] = aс, | (2.13) |
| [А–] = aс, | (2.14) |
| [КА] = с-aс = (1-a)×с | (2.15) |
Подставив выражения (2.13) – (2.15) в уравнение (2.12), получим закон разведения Оствальда:

| (2.16) |
Степень диссоциации a слабого электролита в разбавленном растворе можно также выразить через молярную электрическую проводимость l:
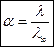 , ,
| (2.17) |
где l – молярная электрическая проводимость при данной концентрации, См×м2/моль; l¥ – молярная электрическая проводимость при бесконечном разведении, См×м2/моль.
Подстановка выражения (2.17) в уравнение (2.16) приводит к следующему соотношению:

| (2.18) |
Используя формулу (2.4), приведем выражение (2.18) к следующему виду:
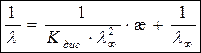
| (2.19) |
Уравнение (2.19) используется для определения Кдис и l¥ по экспериментальным данным о зависимости электропроводности от концентрации электролита. При этом Кдис определяется по тангенсу угла наклона прямой, построенной в координатах 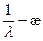 , к оси абсцисс, а l¥ находят по величине отрезка, отсекаемого данной прямой на оси ординат.
, к оси абсцисс, а l¥ находят по величине отрезка, отсекаемого данной прямой на оси ординат.
Задание 2
Определите графически константу кислотности Кк слабой кислоты по данным о зависимости электрического сопротивления ее водных растворов от разведения V при 25 °С, представленным в табл.2. Постоянная кондуктометрической ячейки k = 50 м–1.
Таблица 2. Исходные данные к заданию 2.
| № вар | Кислота | Формула | Электрическое сопротивление R, Ом, при разведении V, л/моль | |||||
| Синильная | HCN | |||||||
| Азотистая | HNO2 | |||||||
| Фторо-водородная | HF | |||||||
| Йодная | HIO4 | |||||||
| Муравьиная | HCOOH | |||||||
| Уксусная | CH3COOH | |||||||
| Пропионовая | C2H5COOH | |||||||
| Масляная | C3H7COOH | |||||||
| Изомасляная | C3H7COOH | |||||||
| Валериановая | C4H9COOH | |||||||
| Фторуксусная | CH2FCOOH | |||||||
| Хлоруксусная | CH2ClCOOH | |||||||
| Дихлор-уксусная | CHCl2COOH | |||||||
| Трихлор-уксусная | CCl3COOH | |||||||
| Йодуксусная | CH2ICOOH | |||||||
| Циан-уксусная | CH2CNCOOH | |||||||
| Фенил-уксусная | C6H5CH2CO-OH | |||||||
| Бензойная | C6H5COOH | |||||||
| Салициловая | HOC6H4CO-OH | |||||||
| Пикриновая | (NO2)3C6H2-OH | |||||||
| Синильная | HCN | |||||||
| Азотистая | HNO2 | |||||||
| Фторо-водородная | HF | |||||||
| Йодная | HIO4 | |||||||
| Пропионовая | C2H5COOH | |||||||
| Масляная | C3H7COOH | |||||||
| Изомасляная | C3H7COOH | |||||||
| Валериановая | C4H9COOH |
Рассмотрим решение задания 2 на примере.
Пример 2
Для водных растворов слабой одноосновной кислоты в кондуктометрической ячейке с постоянной k = 35 м-1 была получена следующая зависимость электрического сопротивления R раствора от разведения V:
| Разведение V, л/моль | ||||||
| Сопротивление R, Ом |
Определите константу диссоциации кислоты.
Для решения задачи удобно воспользоваться уравнением (2.19):

Удельную æ и молярную l электрические проводимости рассчитаем по формулам (2.3) и (2.4) соответственно:
æ =  , l =
, l = 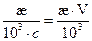
Результаты расчетов сведем в таблицу:
| № п/п | V, л/моль | R, Ом | æ, См/м | 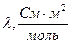
| 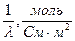
|
| 9,75∙10-2 | 3,12∙10-3 | 320,54 | |||
| 6,74∙10-2 | 4,32∙10-3 | 231,70 | |||
| 4,62∙10-2 | 5,92∙10-3 | 168,97 | |||
| 3,15∙10-2 | 8,06∙10-3 | 124,00 | |||
| 2,13∙10-2 | 1,09∙10-2 | 91,91 | |||
| 1,40∙10-2 | 1,43∙10-2 | 69,75 |
С целью определения Кк и l¥ построим график в координатах 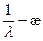 (рис. 1). Как следует из уравнения (2.19), отрезок, отсекаемый прямой, изображенной на рис.1, на оси y, равен 1/l¥. Уравнение линии тренда на рис.1 позволяет найти l¥:
(рис. 1). Как следует из уравнения (2.19), отрезок, отсекаемый прямой, изображенной на рис.1, на оси y, равен 1/l¥. Уравнение линии тренда на рис.1 позволяет найти l¥:
1/l¥ = 28,721 Þ l¥ = 3,48×10-2 См×м2/моль.
Константу кислотности вычислим по формуле (2.20):
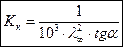
| (2.20) |
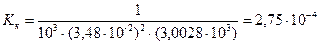 моль/л.
моль/л.
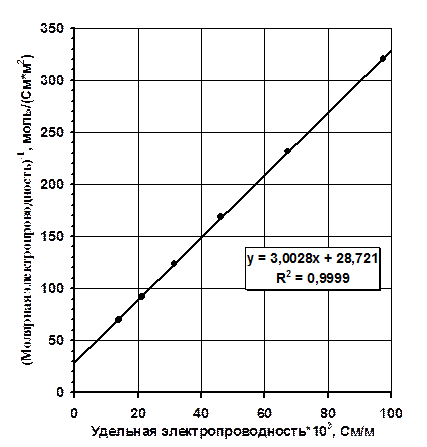
Рис. 1. График для определения константы кислотности слабой кислоты.
Дата добавления: 2017-08-01; просмотров: 300;
