Пространственное и электронное строение.
В соответствии с состоянием sp-гибридизации молекула ацетилена линейна.
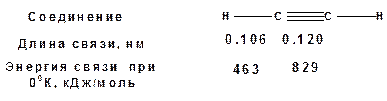
Энергия тройной связи 829 кДж/моль, что больше энергии двойной связи 607.1 кДж/моль, ординарной связи Сsp3–Сsp3 - 349.6 кДж/моль и ординарной связи Сsp3–Сsp2 - 360 кДж/моль. Однако две ординарные связи и одна двойная, а также четыре ординарные связи по энергии превосходят одну тройную связь. Поэтому тройная связь легко переходит в две ординарные и одну двойную связь путем присоединения по месту тройной связи двух атомов или атомных групп.
Из этого следует, что для алкинов, также как и для алкенов, наиболее характерны реакции присоединения. Однако то, что атомы углерода, связанные тройной связью, находятся в состоянии sp-гибридизации, придает алкинам определенные особенности в химических свойствах.
В первой лекции отмечалось, что с понижением степени гибридизации растет электроотрицательность атома углерода. Наибольшая электроотрицательность атома углерода в состоянии sp-гибридизации приводит к тому, что алкины обладают способностью не только выступать в роли нуклеофила в реакциях электрофильного присоединения (подвергаться атаке электрофильных частиц), но и выступать в роли электрофила (подвергаться атаке нуклеофильных частиц). Т.е. участвовать в реакциях нуклеофильного присоединения.
Повышенная электроотрицательность атома углерода в состоянии sp-гибридизации также приводит к тому, что терминальные алкины являются так называемыми С-Н – кислотами (способны к электролитической диссоциации по связи С-Н). В результате ионизации образуется устойчивый карбанион:
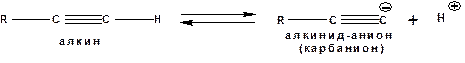
Причем алкины являются кислотами более сильными, чем этилен и аммиак, и более слабыми, чем вода:
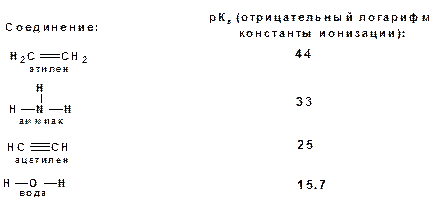
Причина более высокой кислотности алкинов по сравнению с алкенами заключается в большей устойчивости соответствующего карбаниона. Следствием возможности образования стабильного карбаниона является способность терминальных алкинов участвовать в реакциях замещения.
Дата добавления: 2017-08-01; просмотров: 512;
