СПИРТЫ (ОКСИСОЕДИНЕНИЯ)
Производные углеводородов, получаемые замещением одного или нескольких атомов водорода на группу ОН (окси-группа).
Классификация
1. По строению цепи (предельные, непредельные).
2. По атомности – одноатомные (одна группа ОН), многоатомные (2 и более групп ОН).
3. По положению группы ОН (первичные, вторичные, третичные).
Предельные одноатомные спирты
Общая формула СnH2n+1OH
| Гомологический ряд | Радикально-функциональная номенклатура, карбинальная | |
| СН3ОН | Метиловый спирт, карбинол, метанол | |
| С2Н5ОН | Этиловый спирт, метилкарбинол, этанол | |
| С3Н7ОН | СН3СН2-СН2ОН | Пропиловый спирт, этилкарбинол, 1-пропанол |
| 1 2 СН3-СН-ОН СН3 | Изопропиловый спирт, диметилкарбинол, 2-пропанол | |
| С4Н9ОН | СН3-СН2-СН2-СН2ОН | Бутиловый спирт, пропилкарбонат, 1-бутанол |
| 4 3 2 СН3-СН2-СН-ОН 1СН3 | Вторичный бутиловый спирт, метилэтилкарбинол, 2-бутанол | |
| СН3-СН-СН2-ОН СН3 | Изобутиловый спирт, изопропилкарбинол, 2-метил-1-пропанол | |
| СН3 СН3-С-ОН СН3 | Третичный бутиловый спирт, триметилкарбинол, диметилэтанол |
По систематической номенклатуре (IUPAC) спирты называют по углеводородам, соответствующим самой длинной цепочке углеродных атомов с добавлением окончания “ол”,
6 5 4 3 2 1
СН3-СН-СН2-СН2-СН-СН3 5-метил-2-гексанол
СН3 ОН
Нумерацию начинают с того конца, ближе к которому расположена группа ОН.
Изомерия
1. Структурная – изомерия цепи
изомерия положения окси-группы
2. Пространственная – оптическая, если все три группы у углерода, связанного с группой ОН, разные, например:
С3Н7
СН3-*С-С2Н5
ОН
3-метил-3-гексанол
Получение
1. Гидролиз галоидных алкилов (см. свойства галогенопроизводных).
2. Металлорганический синтез (реакции Гриньяра):
а) первичные спирты получают действием металлорганических соединений на формальдегид:
СН3-MgBr + CH2=O 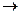 CH3-CH2-O-MgBr
CH3-CH2-O-MgBr 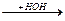 CH3-CH2OH + MgBr (OH)
CH3-CH2OH + MgBr (OH)
б) вторичные спирты получают действием металлорганических соединений на другие альдегиды:
O
CH3-CH2-MgBr+CH3-C 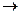 CH3-CH-CH2-CH3
CH3-CH-CH2-CH3 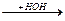
H
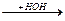 CH3-CH-CH2-CH3+MgBr (OH)
CH3-CH-CH2-CH3+MgBr (OH)
в) третичные спирты – действием металлорганических соединений на кетоны:
CH3 CH3
CH3-C-CH3 + H3C-MgBr 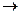 CH3-C-CH3
CH3-C-CH3 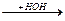 CH3-C-CH3 + MgBr (OH)
CH3-C-CH3 + MgBr (OH)
O OMgBr OH
третбутиловый спирт
3. Восстановление альдегидов, кетонов:
O H
CH3-C + H2 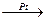 CH3-C-OH
CH3-C-OH
H H
CH3-C-CH3 + H2 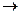 CH3-CH-CH3
CH3-CH-CH3
O OH
изопропиловый спирт
4. Гидратация олефинов (см. свойства олефинов)
Электронное и пространственное строение
Рассмотрим на примере метилового спирта
H
H-C-O-H 1s22s22p2x2py2pz
H
Угол должен быть 900, на деле он 110028/. Причина в высокой электроотрицательности кислорода, который притягивает к себе электронные облака связей С-Н и О-С орбиталей.
Так как у водорода гидроксильной группы его единственный электрон оттянут кислородом, ядро водорода приобретает способность притягиваться к другим электроотрицательным атомам, имеющим неподеленные электроны (атомам кислорода).
Физические свойства
С1-С10 – жидкости, С11 и больше – твердые вещества.
Температура кипения спиртов значительно выше, чем у соответствующих углеводородов, галогенопроизводных и простых эфиров. Это явление объясняется тем, что молекулы спиртов ассоциированы за счет образования водородных связей.
- 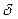 +
+ 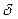
:O 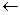 H…..:O
H…..:O 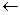 H…..:O
H…..:O 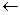 H
H
CH3 CH3 CH3
Образуются ассоциаты из 3-8- молекул.
При переходе в парообразное состояние водородные связи разрушаются, на то тратится дополнительная энергия. Температура кипения из-за этого повышается.
Ткип: у первичных > у вторичных > у третичных
Тпл - наоборот: у третичных > у вторичных > у первичных
Растворимость. Спирты растворяются в воде, образуя при этом водородные связи с водой.
С1-С3 – смешиваются неограниченно;
C4-C5 – ограниченно;
высшие – нерастворимы в воде.
Плотность спиртов <1.
Спектральная характеристика спиртов
Дают характерные полосы поглощения в ИК-области. 3600 см-1 (поглощает неассоциированная ОН-группа) и 3200 см-1 (при образовании водородных связей – ассоциированная ОН-группа).
Химические свойства
Обуславливаются наличием группы ОН. Она определяет важнейшие свойства спиртов. Можно выделить 3 группы химических превращений с участием группы ОН.
I. Реакции замещения водорода в окси-группе.
1) Образование алкоголятов
а) действие щелочных металлов и некоторых других активных металлов (Mg, Ca, Al)
C2H5OH + Na 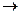 C2H5ONa + H
C2H5ONa + H
этилат натрия
Алкоголяты нацело разлагаются водой с образованием спиртов и щелочи.
C2H5Ona + HOH 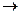 C2H5OH + NaOH
C2H5OH + NaOH
б) Реакция Чугаева-Церевитинова – действие магнийорганических соединений.
C2H5OH + CH3MgBr 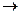 C2H5OmgBr + CH4
C2H5OmgBr + CH4
Реакция применяется в анализе спиртов для определения количества “подвижного водорода”. В этих реакциях спирты проявляют очень слабые кислотные свойства.
2) Образование сложных эфиров на остаток кислоты – ацил.
а) Реакция этерефикации – взаимодействие спиртов с карбоновыми кислотами.
H2SO4 конц
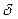 - или
- или
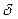 + O HCl газ O
+ O HCl газ O
CH3-C + HO18C2H5 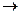 H2O16 + CH3-C
H2O16 + CH3-C
O16H O18-C2H5
уксусно-этиловый эфир
С помощью метода меченых атомов установлено, что реакция этерификации – это замещение ОН-группы на алкоксигруппу. Эта реакция обратима, т.к. образующаяся вода вызывает гидролиз сложного эфира.
б) Ацилирование спиртов ангидридами кислот.
O O
CH3-C H CH3-C
 +O: + :OC2H5
+O: + :OC2H5  OH
OH
CH3-C OC2H5
O CH3-C
 - O
- O
уксусный ангидрид
Эта реакция обратима, т.к. при взаимодействии спирта с ангидридом вода не выделяется (гидролиз не возможен).
в) ацилирование спиртов хлорангидридами кислот
 -
-
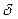 +O O
+O O
СH3-C + HOC2H5 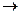 HCl + CH3-C-OC2H5
HCl + CH3-C-OC2H5
Cl:
хлорангидрид
уксусной кислоты
3) Образование простых эфиров
Простые эфиры образуются в результате замещения водорода окси-группы на алкил (алкилирование спиртов).
а) алкилирование галоидными алкилами
C2H5OH + ClCH3 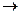 HCl + C2H5OCH3
HCl + C2H5OCH3
б) алкилирование алкилсульфатами или диалкилсульфатами
C2H5OH + CH3O-SO2OH 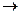 C2H5OCH3 + H2SO4
C2H5OCH3 + H2SO4
C2H5OH + CH3OSO2OCH3 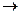 C2H5OCH3 + HOSO2OCH3
C2H5OCH3 + HOSO2OCH3
в) межмолекулярная дегидратация в присутствии твердого катализатора
C2H5OH + HOC2H5 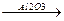 C2H5OC2H5 + H2O
C2H5OC2H5 + H2O
2400C
г) алкилирование изоолефинами
CH2 CH3
CH3OH + C-CH3 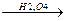 CH3-O-C-CH3
CH3-O-C-CH3
CH3 p,600C CH3
изобутилен
II. Реакции с отрывом группы ОН.
1) Замещение группы ОН на Hal.
а) действие HHal;
б) действие PHаl и PНal5;
в) действие SOCl2 и SO2Cl2 (см. способы получения галогенопроизводных).
2) дегидратация спиртов (внутримолекулярное отщепление воды)
CH3-CH-CH-CH3 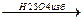 H2O + CH3-CH=C-CH3
H2O + CH3-CH=C-CH3
OH CH3 1800C CH3
3-метил-2-бутанол 2-метил-2-бутен
Отщепление водорода идет от наименее гидрированного из 2-х соседних звеньев с гидроксилсодержащими (правило Зайцева).
III. Окисление и дегидрирование спиртов
Отношение спиртов к окислению связано с индукционным влиянием связи С-О. Полярная связь С-О увеличивает подвижность атомов водорода при углероде, связанном с группой ОН.
H
H-C  O
O  H
H
H
1) Окисление первичных спиртов
а) до альдегидов;
H O
CH3-C-H + O  H2O + CH3-C + H2O
H2O + CH3-C + H2O
OH H
б) до кислот
H OH
CH3-C-H + O + O 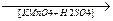 H2O + CH3-C
H2O + CH3-C
OH O
2) Окисление вторичных спиртов идет до кетонов
H
CH3-C-CH + O 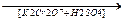 H2O + CH3-C=O
H2O + CH3-C=O
CH3 CH3
3) Третичные спирты при аналогичных условиях не окисляются, т.к. не имеют подвижного атома углерода, связанного с группой ОН. Однако при действии сильных окислителей (концентрированные растворы при высокой температуре), реакция окисления идет с разрушением углеродной цепи. При этом окислению подвергаются соседние звенья (наименее гидрированные), т.к. там больше сказывается индукционное влияние гидроксильной группы.
OH OH OH O HO
CH3-CH2-C-CH3 + O 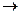 CH3-CH-C-CH3
CH3-CH-C-CH3 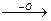 CH3-C-C-CH3
CH3-C-C-CH3 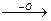
O O
 CH3-C-OH + C-CH3
CH3-C-OH + C-CH3
CH3
4) Дегидрирование спиртов – под действием катализаторов.
Также происходит с участием самых подвижных атомов водорода: водорода оксигруппы и водорода у соседнего атома углерода.
H H
CH3-C-H  H2 + CH3-C
H2 + CH3-C
OH 100-1800C O
Дегидрирование под действием хлора.
H H
CH3-C-H + Cl2  2HCl + CH-C
2HCl + CH-C
OH O
В реакциях замещения и отщепления водорода наиболее активны спирты первичные, а в реакциях замещения и отщепления группы ОН, наоборот, наиболее легко реагируют спирты третичные.
НЕПРЕДЕЛЬНЫЕ СПИРТЫ
Содержат в составе молекулы группу ОН и двойную или тройную связи. Строение непредельных спиртов имеет ограничение, определяемое правилом Эльтекова. Спирты, у которых группа ОН находится при атоме углерода с двойной связью, в свободном состоянии не существуют
C=C
OH
и уже в процессе образования изомеризуются в соответствующие альдегиды или кетоны, т.к. имеется p-  -сопряжение, повышается подвижность водорода и увеличивается нуклеофильность СН2.
-сопряжение, повышается подвижность водорода и увеличивается нуклеофильность СН2.
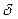 - ..
- .. 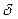 +
+
CH2=CH-O-H 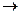 CH3-C
CH3-C
Виниловый уксусный
спирт альдегид
Способы получения
Кроме общих способов получения спиртов, применяются:
а) для получения ацетиленовых спиртов – реакция взаимодействия ацетилена с альдегидами и кетонами (см. химические свойства ацетиленовых углеводородов).
O
H-C + CH 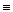 CH
CH 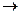 CH2-C
CH2-C 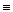 CH
CH
H OH
пропаргиловый спирт
б) нагревание глицеринов с щавелевой кислотой
СH2OH HO-C=O CH2-O-C=O CH2
CHOH + 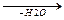 CH2-O-C=O
CH2-O-C=O 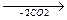 CH
CH
CH2OH HO-C=O CH2OH CH2OH
аллиловый спирт
Свойства
Дают реакции спиртов и реакции за счет кратных связей. Легко окисляются, полимеризуются.
Дата добавления: 2017-06-02; просмотров: 2490;
