ТЕРМОКАТАЛИТИЧЕСКИЕ ПРЕВРАЩЕНИЯ
По характеру взаимодействия катализатора с реагирующими веществами и по типу промежуточных продуктов различают окислительно-восстановительные и кислотно-основные реакции и соответственно катализаторы.
Многие промышленные катализаторы являются бифункциональными, так как окислительно-восстановительный катализатор наносят на кислотный носитель. С другой стороны, многие сульфиды и окислы сами по себе обладают и окислительно-восстановительной, и кислотно-основной активностью.
Механизм действия катализаторов
Окислительно-восстановительного типа
В окислительно-восстановительных реакциях каталитическое воздействие обусловлено, по-видимому, образованием гомеополярных связей адсорбированных молекул реагирующих веществ с активными центрами катализатора. Эти реакции катализируются металлами и полупроводниками. Активность переходных металлов (Fe, Co, Ni, Ru, Rh, W, Re, Os, Ir, Pt и др.) в окислительно-восстановительных реакциях объясняется незавершенностью их d‑оболочек. Неспаренный электрон незавершенной d-орбитали действует как «свободная валентность», в значительной мере подобно свободному радикалу. Если адсорбированная молекула имеет незанятые орбитали, то возникает π-связь с такими активными центрами. Молекула, являющаяся донором пары электронов, может образовать координационную связь с незаполненной орбиталью катализатора.
В случае полупроводников свободные валентности (свободные электроны и электронные дырки) появляются вследствие неполной координированности атомов кристаллической решетки. Обычно это связано с различными дефектами кристалла полупроводника. Например, узел кристалла, в котором отсутствует катион, ведет себя как отрицательный заряд, отталкивая электроны в ближайших узлах. В результате эти электроны могут быть вытеснены из валентной зоны в зону проводимости.
Появление электронов в зоне проводимости в полупроводниках может быть вызвано также присутствием в кристалле различных примесей. На поверхности кристалла такие электроны будут играть роль свободной валентности.
Таким образом, каталитическая активность прямо связывается с числом свободных валентностей на поверхности катализатора.
Кислотный катализ
Катализ кислотами широко применяется в нефтеперерабатывающей промышленности. Каталитическое действие кислот обусловлено образованием при их взаимодействии с углеводородами катионов, называемых карбоний-ионами или карбкатионами. Обычно карбкатионы образуются при передаче протона от кислоты к молекуле ненасыщенного углеводорода:
НХ + CH3CH=CHR ® CH3CH2CH+R + X-
Кислоты Льюиса являются энергичными акцепторами электронной пары и также могут инициировать реакцию с участием карбоний-иона:
ALX3 + RH ® R+ + HAIX-3
Образование карбкатионов в присутствии кислых галогенидов облегчается, если в системе имеется некоторое количество галогеналкилов:
AlX3 + RX ® R+ + A1X4-
Галогеналкилы в этом случае играют роль промоторов.
Карбкатионы — чрезвычайно реакционноспособные соединения. Константы скорости ионных реакций на несколько порядков выше аналогичных радикальных реакций. Об относительной устойчивости карбкатионов можно судить по теплоте их образования, в кДж/моль:
| СН3+ | СН3СН2СН2СН2+ | ||
| СН3СН2+ | СН3СH2 С+НСН3+ | ||
| CH3CH2CH2+ | (СН3)3С+ | ||
| CH3 C+HCH3+ | (CH3)3CCH2+ | 8.2 |
Как следует из этих данных, стабильность карбкатионов возрастает в последовательности: первичный < вторичный < третичный.
Основными реакциями карбкатионов, как и радикалов, являются мономолекулярный распад по β-правилу и бимолекулярные реакции замещения и присоединения. Существенное отличие карбкатионов от радикалов — их способность к изомеризации.
 15.3. Реакции карбкатионов
15.3. Реакции карбкатионов
Изомеризация. Изомеризация карбкатионов может происходить в результате переноса как гидрид-иона, так и метиланиона:
+ + +
CH2 CH CH2 CH2 CH3« CH3 CH CH CH2 CH3 « CH3 CH2 CH CH2 CH3
 •• ••
•• ••


 Н Н
Н Н
+ + +
 CH3CHCH2:CH3 « CH3CHCH2 « CH3CCH3+ 76 кДж/моль
CH3CHCH2:CH3 « CH3CHCH2 « CH3CCH3+ 76 кДж/моль
 | |
| |
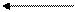 CH3 CH3
CH3 CH3
Подобное перемещение происходит быстро в направлении от первичного иона карбония к вторичному и далее к наиболее устойчивому — третичному.
Распад по β-правилу. Расщепление карбкатионов обычно происходит по наиболее слабой связи β-С—С. Реакция эндотермична:
+
CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH3 ®
+
® CH2=CH2 + CH2 CH2 CH2 CH2 CH2 CH3 — 92 кДж/моль
Склонность к распаду снижается при переходе от первичного иона к вторичному и от вторичного к третичному. Если для распада первичного октилкатиона требуется 92 кДж/моль, то для вторичного октилкатиона надо затратить 176 кДж/моль.
Склонность к распаду возрастает при отщеплении вторичного иона и — еще в большей степени — третичного:
+
CH3 CH2 CH CH2 C(CH3)2 CH2 CH3 ®
+
®CH3CH2CH=CH2 + C(CH3)2CH2CH3- 21 кДж/моль
Сопоставление энергетики распада и изомеризации карбкатионов показывает, что изомеризация должна предшествовать в большинстве случаев распаду. Преимущественное образование третичных карбкатионов и их устойчивость должны приводить к накоплению изоструктур при распаде неразветвленных алкильных карбкатионов с большим числом углеродных атомов.
Присоединение карбкатионов к алкенам и аренам. Эта реакция обратна реакции распада карбкатионов:
+ CH3 +
|
(CH3)3C + CH2=CCH3 ® (CH3)3CCH2C(CH3)2
+
(CH3)3C + C6H6 ® 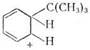
Поэтому характер изменения теплового эффекта противоположен реакции распада.
Потеря протона смежным углеродным атомом и передача протона молекуле алкена. Например:
+
СН3СН2СНСН3 ® СН3СН=СНСН3 + Н+
+
СН2СН(СН3)СН3 + СН3СН=СНСН3 ®
+
® СН2=С(СН3)СН3+СН3СНСН2СН3 + 42 кДж/моль
Наиболее энергетически выгодна такая реакция, когда протон отщепляется от первичного карбкатиона, а в результате образуется третичный карбкатион.
Отрыв гидрид-иона от молекулы углеводорода. Например:
+
СН3СНСН2СН3 + СН3СН(СН3)СН3 ®
+
® СН3СН2СН2СН3 + СН3С(СН3)СН3 + 67 кДж/моль
Активность карбкатиона в реакции отрыва гидрид-иона от молекулы углеводорода также снижается в ряду:
R+перв > R+втор > R+трет
Карбкатионные реакции всегда протекают или в жидкой фазе, или на поверхности твердого катализатора. Сольватация в растворе и адсорбция при реакции на твердой поверхности значительно изменяют тепловые эффекты реакции ионов. В результате соотношения между различными реакциями ионов в реальных процессах могут существенно отличаться от расчетных.
Дата добавления: 2017-06-02; просмотров: 557;
