Лекция № 5. Колебательная ИК-спектроскопия.
Понятие о различных типах колебаний в молекуле. Взаимодействие колебаний. Водородная связь в ИК - спектре. Характеристические частоты. Расположение основных групп характеристических частот.
Понятие о различных типах колебаний в молекуле
Молекулярные колебания подразделяются на два типа: валентные и деформационные. Валентное колебание – это такое ритмичное движение вдоль связи, когда межатомное расстояние периодически увеличивается или уменьшается. Деформационное колебание может заключаться в изменение валентного угла (т.е. угла, образованного связями у общего атома) или в движении группы атомов по отношению к остальной части молекулы без смещения атомов относительно друг друга внутри этой группы. Например, крутильные, маятниковые и торсионные колебания происходят с изменением валентных углов в системе внутренних координат молекулы.
В ИК-спектрах наблюдаются только такие колебания, которые приводят к периодическому изменению дипольного момента молекулы. Переменное электрическое поле, возникающее при изменении распределения зарядов в процессе колебания, связывает колебание молекулы с осциллирующим электрическим полем электромагнитного излучения.
Основные колебания происходят без изменения центра тяжести молекулы. Теоретическое число основных колебаний (частот поглощения) наблюдается редко, чисто полос увеличивается за счет обертонов (частот, кратных данной частоте) и составных частот (сумма двух разных частот). С другой стороны, теоретическое число полос уменьшается за счет следующих факторов.
1. Часть основных частот не попадает в область 4000 – 400 см-1.
2. Некоторые из основных полос является такими слабыми, что не наблюдается.
3. Частоты некоторых основных колебаний настолько близки, что сливаются и проявляются в виде одной полосы.
4. Вырождение нескольких частот в высокосиммертичных молекулах.
5. Некоторые из основных колебаний отсутствуют из-за того, что в процессе колебания не изменяется дипольный момент молекулы.
Взаимодействие колебаний
Колебания, обусловленные деформацией валентного угла, часто взаимодействуют с валентными колебаниями.
Связь колебаний может быть эффективной только при следующих условиях:
1. Взаимодействующие колебания должны относится к одному типу симметрии.
2. Сильное взаимодействие между валентными колебаниями требует общего атома между группами.
3. Взаимодействие колебаний групп максимально в случае близости их частот.
4. Валентные и деформационные колебания взаимодействуют в том случае, когда растягивающая связь образует одну из сторон изменяющегося угла.
5. Для взаимодействия между деформационными колебаниями необходима общая связь.
6. Взаимодействие колебаний становится пренебрежимо малым, если группы разделены одним или большим числом атомов углерода, а колебания происходят во взаимно перпендикулярным плоскостях.
Взаимодействие между двумя основными колебаниями приводит к двум новым колебаниям с частотами выше и ниже, чем наблюдаемые в отсутствие взаимодействия. Основные колебания и обертоны или составные частоты также могут взаимодействовать. Такое взаимодействие известно как резонанс Ферми. Для его возникновения требуется принадлежность колебательных уровней к одному типу симметрии, а расположение взаимодействующих групп в молекуле должно допускать механическую связь.
Водородная связь в ИК – спектре
Водородная система может возникать в любой системе содержащей доноры протонов (группы Х-Н) и акцепторы протонов (группы Y:), при условии что возможно эффективное перекрывание s-орбитали водорода с p- или π-орбиталью акцепторной группы. Атомы X и Y: электроотрицательны, причем у Y: имеется неподеленная пара электронов. Донорами протонов в органических молекулах обычно являются карбоксильные, гидроксильные, амино- или амидогруппы. Акцепторами протонов обычно служат атомы кислорода, азота и галогенов.
Прочность водородной связи максимальная, когда группа-донор протонов и ось орбитали неподеленной пары коллинеарны. Прочность водородной связи уменьшается при увеличении расстояния между X и Y.
Водородная связь изменяет силовые постоянные обеих групп; тем самым изменяются частоты как валентного, так и деформационного колебаний. Когда образуется водородная связь, частота деформационного колебания Н-Х, как правило, сдвигается в сторону более коротких волн; этот сдвиг менее выражен, чем для валентных колебаний.
Возникновение межмолекулярных водородных (МВС) связей приводит к ассоциации двух или более молекул одного и тог же или разных соединений. Внутримолекулярные водородные связи (ВВС) возникают тогда, когда в одной и той же молекуле имеются протонодонорная и протоноакцепторная группа и нет пространственных затруднений при перекрывании орбиталей. Степень межмолекулярных и внутримолекулярных взаимодействий зависит от температуры. Влияние концентрации растворов на меж- и внутримолекулярную водородную связь существенно различается. Полосы, обусловленные МВС, обычно исчезают при низких концентрациях (менее 0,01 моль·л-1 в неполярных растворителях). ВВС представляет собой «внутренний» эффект, который сохраняется даже при очень низких концентрациях.
Изменение частоты поглощения при переходе от поглощения «свободно» гидроксильной группы к связанной характеризует прочность водородной связи. На прочность связи влияют: напряжение кольца, геометрия молекулы, относительная кислотность и основность донорных и акцепторных групп. ВВС при одних и тех же связанных группах прочнее в случае шестичленного цикла, чем для циклов меньшего размера. Самые прочные водородные связи образуются при стабилизации цикла в результате резонанса.
Важным аспектом при образовании ВС является взаимодействие между функциональными группами растворителя и растворенного вещества. Если растворенное вещество полярно, то в условиях регистрации ИК-спектра необходимо указывать использованный растворитель и концентрацию растворенного вещества.
Характеристические частоты
Экспериментальные исследования большого числа молекул, обладающих одними и теми же химическими группами, показали, что, независимо от изменений в остальной части молекулы, эти одинаковые группы поглощают в узком интервале частот. Такие частоты получили название характеристические или групповые. К ним относятся, например, колебания групп СН, СН2, СН3, О-Н, N-H, NH2, C=C, 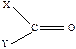 , NO2 и др.
, NO2 и др.
Наличие групповых частот вызвано тем, что в таком колебании наибольшее участие принимает некоторая группа атомов, вклад остальной части молекулы мал, хотя, строго говоря, в каждом колебании изменяются длины всех связей и величины углов между связями.
В двухатомной молекуле частота колебаний зависит от двух параметров: массы атомов и силового коэффициента, связанного с упругостью связи.
В многоатомных молекулах дело обстоит намного сложнее, но тем не менее эта зависимость помогает очень грубо оценить области, в которых проявляются отдельные колебания и их характеристичность. Колебание будет тем более характеристичным, чем больше параметры колеблющейся группы атомов отличаются от параметров остальной части молекулы. Так, характеристичными будут колебания групп, содержащих легкий атом водорода (СН3, СН2, СН, NH2, NH, OH и др.). Группы, содержащие кратные связи >С=С<, >С=N, -C≡C-, >C=О и др., имеют характерные полосы поглощения, относящиеся к колебаниям, в которых в основном происходит растяжение соответствующих связей.
Если же атомы близки по массе и соединены связями, имеющими близкие силовые коэффициенты, то невозможно выделить колебания,, относящиеся к индивидуальным связям; полосы поглощения отвечают колебаниям большого числа углов и связей. Поэтому любое замещение, небольшое изменение геометрии молекулы приводит к сдвигам полос поглощения.
В ряде случае можно выделить такие колебаний, при которых изменяются преимущественно длины связей или углы между связями. Согласно этому первое колебание называется валентными, а второе деформационным. Однако всегда следует помнить, что в каждом колебании принимают большее или меньшее участие соседние связи и прилежащие углы, т.е. не существует, строго говоря, чисто валентных или чисто деформационных колебаний (за исключением линейных молекулы).
Расположение основных групп характеристических частот
Области поглощения, найденные для некоторых групп органических соединений, представлены в табл. 1.
В области наиболее высоких частот (3600 – 2800 см-1) находятся полосы, отвечающие колебаниям групп, содержащих легкий атом водорода, т.е. групп С-Н, N-Y, О-Н. Эти колебания являются валентными.
Увеличение массы атомов при сохранении порядка связи смещает полосы поглощения в длинноволновую область (в сторону меньших частот), например колебаний связи С-Cl в алифатических соединениях расположены в области 700 – 600 см-1. Полосы поглощения скелета органической молекулы, содержащей связи С-С, С-О, С-N, находятся в области 1500 – 700 см-1, но, как уже указывалось, для них нет колебаний, принадлежащих отдельным связям. Характер спектра в этом интервале частот существенно изменяется даже при небольших изменениях в структуре соединений. Это используется для целей идентификации, поскольку каждое соединение имеет присущий только ему набор полос поглощения. Эту область называют областью "отпечатков пальцев".
Таблица 1
Области поглощения некоторых структурных элементов
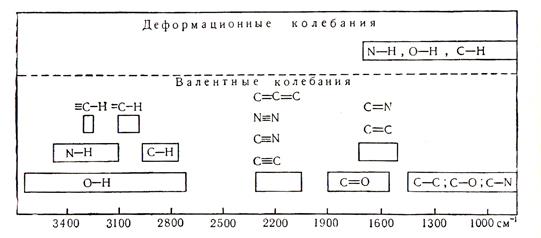
Увеличение кратности связи (при сохранении массы) вызывает повышение частот. Групповые колебания соединений с двойными связями (С=С, С=О, С=N) лежат в области 1800 – 1500 см-1. Обычно эти колебания не являются чисто валентными, поскольку в них большое участие принимают прилежащие углы и связи. Эта область очень ценна при изучении внутримолекулярных взаимодействий.
Полосы поглощения тройных связей (С≡С, C≡N) следует искать в области 2000 - 2300 см-1, поскольку силовой коэффициент тройной связи больше силовых коэффициентов одинарной и двойной связей.
Колебаний, определяемые изменением углов, встречаются в области значительно меньших частот, чем колебаний, связанные с растяжением соответствующих связей.
Интерпретация спектров
При интерпретации ИК-спектров нет жестких правил. Однако прежде чем приступать к этой работе, нужно добиться, чтобы спектр удовлетворял следующим требованиям.
1. Спектр должен быть достаточным и хорошо разрешенным.
2. При съемке спектра нужно использовать достаточно чистый образец.
3. Спектрофотометр должен быть прокалиброван так, чтобы волновые числа или длины волн наблюдаемых полос соответствовали их истинным значениям. Калибровку спектрометра необходимо выполнять по подходящим стандартам, таким как полистирол или пары воды.
4. Должен быть описан метод подготовки пробы. При работе с раствором должны быть указаны растворитель, концентрация и толщина кюветы.
ИК-спектр нужно интерпретировать на основе эмпирического сравнения спектров и экстраполяция данных по более простым молекулам. Многочисленные ИК-спектры органических молекул обобщены в таблицах характеристических групповых частот.
При предварительном рассмотрении спектра наиболее информативными являются две области: 4000 – 1300 и 909 – 650 см-1. Высокочастотная часть спектра называется областью функциональных групп. В этой части спектра наблюдаются характеристические частоты валентных колебаний таких функциональных групп, как ОН, NH, С=О и др. Отсутствие полос в этой области обычно используется как доказательство отсутствии этих групп в молекуле. Отсутствие поглощения в области 1850 – 1540 см-1 исключает структуры, содержащие карбонильную группу.
Основные колебания функциональных групп S-Н и С=С дают слабые полосы в высокочастотной области, которые весьма важны для структурного анализа. Сильные полосы колебаний углеродного скелета (скелетные колебаний) для ароматических и гетероароматических соединений попадают в область 1600 – 1300 см-1.
Отсутствие сильных полос поглощения в области 900 – 650 см-1 обычно указывает на неароматическую структуру. Если низкочастотную область спектра продлить до 1000 см-1, то в нее попадут полосы, характерные для алкеновых структур.
Промежуточная область спектра 1300 – 900 см-1 обычно называют областью «отпечатков пальцев». Поглощение в этой области часто имеет сложный вид, причем некоторые полосы обусловлены взаимодействием колебанием. Эта часть спектра информативная, когда исследуется совместно с другими областями.
Первый совет: не предпринимайте лобовой прямой атаки на ИК-спектр. Поищите доказательства присутствия или отсутствия обычных функциональных групп с характеристическим поглощением. Начните с групп ОН, С=О и NH, так как прямой ответ на уровне «да/нет» обычно возможен с помощью диаграммы (рис. 1). Ответ «да» для любой из этих групп значительно сужает круг поиска.
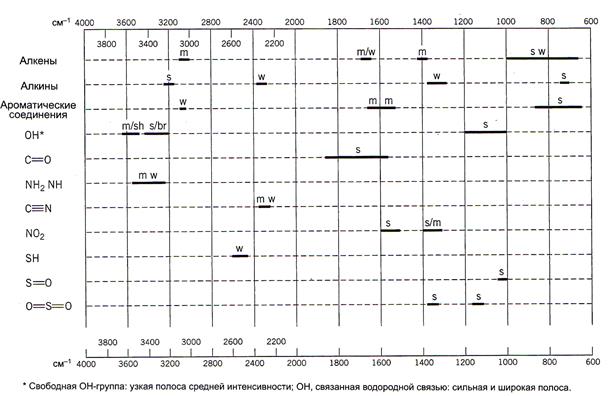
Рис. 1. Упрощенная диаграмма характеристических частот некоторых распространенных функциональных групп (принятые обозначения: s - сильная; m – средняя; w – сильная; sh – узкая; br – широкая)
Дата добавления: 2017-06-02; просмотров: 360;
