Генетичне визначення первинної структури білків
До теперішнього часу вже добре відомо, що саме ДНК несе в собі інформацію про особливості будови і функціонування живого організму. Фактично мізерні кількості хімічної сполуки, що міститься в зиготі, визначають перетворення однієї клітини в цілісний організм людини, регулює процеси його життєдіяльності.
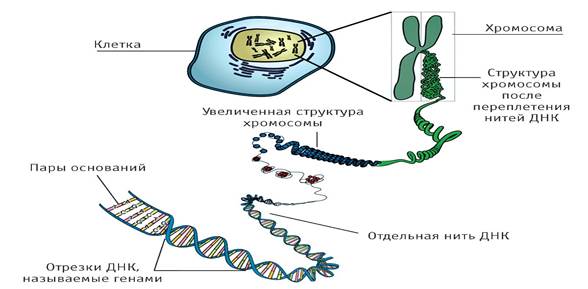
Головна роль у функціонуванні будь-якого організму належить білкам. Структура і властивості цих складних молекул забезпечують різноманітність живої матерії.
Білки є великими полімерними сполуками, що складаються з амінокислот. Всі аміно кислоти, за винятком проліну, мають загальну
структуру, яка обов'язково включає аміногруппу (-NН2) і карбоксильну групу (-СООН), об'єднані зв'язком з вуглеводнем. До цього атому приєднується бічна група - радикал, що має специфічні для кожної амінокислоти властивості.
Окремі амінокислоти пов'язані одна з одною ковалентними пептидними зв'язками між карбоксильною і амино групами:
Хімічні сполуки, що включають в себе велику кількість амінокислотних залишків, називають поліпептидами. Білками називаються поліпептіди, що включають від ста до декількох тисяч амінокислот. Білки розрізняються за кількістю та складом амінокислот. Виділяють кілька видів організації білкових молекул.
Дивись відео про структуру білків
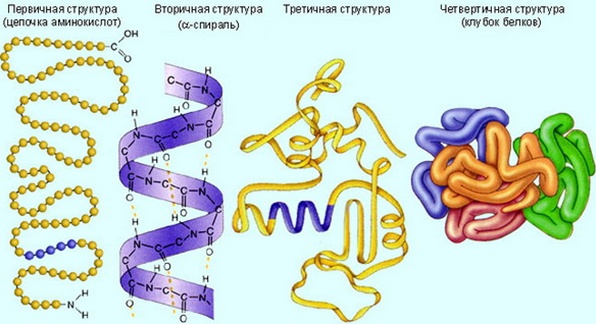
Проста послідовність амінокислот в поліпептідном ланцюжці отримала назву первинної структури. Формування водневих зв'язків між окремими амінокислотними залишками призводить до утворення спіралі - вторинної структури білка. Наявність в поліпептидного ланцюга аминокислот з великими радикалами супроводжується їхньою складною упаковкою відносно один одного за допомогою різноманітних зв'язків (дисульфідних, іонних, водневих). В результаті утворюється клубок або глобула - третинна структура білка. Іногда кілька поліпептидних ланцюгів об'єднуються в складний комплекс, званий четвертинної структурою білка.
Конкретна форма білка, що визначає його властивості, безпосередньо залежить від складу аминокислот. Зміна його впливає на функцію білка аж до повного зникнення його фермен татівной чи якоїсь іншої активності.
Білки-ферменти виконують дуже важливу роль в обміні речовин в організмі. Вони є катализатором хімічних реакцій, забезпечуючи їх в умовах гомеостазу. Але це не єдине завдання білкових молекул. Наприклад, вони є структурною основою як клітин, так і органів. Сократітельні білки забезпечують рух клітин і організму. Транспортні білки переносять различні хімічні речовини з одного органу у другий. Захисні білки забезпечують стійкість організму до різних впливів. Регуляторні білки - регулюють основні процеси в клітині і в організмі в цілому.
Проте унікальна структура кожної білкової молекули, її амінокислотний склад визначається особливим процесом синтезу білка, в результаті якого реалізується інформація про послідовністі амінокислот, записана в ДНК.
Як відомо до складу ДНК входить послідовність з 4 нуклеотидів, білкові молекули включають 20 амінокислот. Спадкова інформація, закодована за допомогою нуклеотидів, «переписується» в первинну структуру - поліпептидний ланцюг.
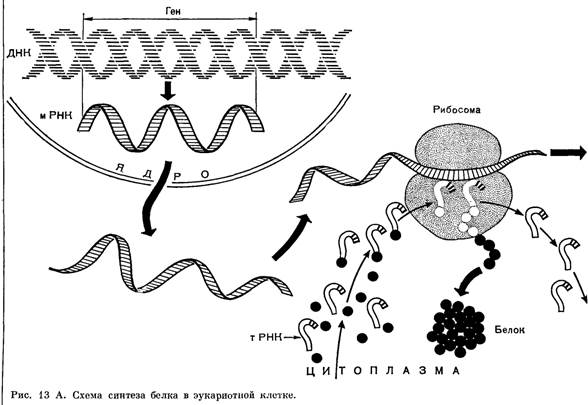
Реалізація інформації, що міститься в ДНК, починається з етапу транскрипції.
Транскрипція - це синтез одноланцюжкової молекули РНК на матриці ДНК. Цей процес проісходить завдяки компліментарності нуклеїнових підстав за винятком того, що в молекулі РНК замість тимінового нуклеотиду вбудовується урациловий, який також відповідає аденіну.
Ділянка ДНК, за якою синтезується РНК, називається транскрипционной одиницею. У зоні синтезу відбувається розрив водневих зв'язків між нитками ДНК. Транскрипція починається з ділянки ініціації і закінчується на ділянці зупинки - термінаторі. Нуклеотидні послідовності в цих ділянках ДНК розпізнаються спеціальними білками, які контролюють роботу РНК-полі-Мераз. Зазвичай РНК утворюється на матриці тільки однієї з двох полінуклеотидних ланцюгів ДНК.
3. Типи молекул РНК:
Матричні або інформаційні РНК (мРНК, іРНК), головним завданням яких є перенесення інформації з ДНК до місця сінтезу білка, до рибосоми, де вони стають матрицею для синтезу поліпептидного ланцюга. Вони становлять близько 5% всієї РНК клітини.
Рибосомні РНК (рРНК), що входять в нуклеопротеїдну структуру - рибосому, за допомогою якої відбувається синтез поліпептидного ланцюга - первинної структури білка.
Транспортні РНК (тРНК), які доставляють амінокислоти до місця синтезу білка. Для кожної з амінокислот існують свої транспортні РНК, які відрізняються за складом нуклеотидів. В тРНК нуклеотидний ланцюг має неспецифічну просторову структуру, яка схожа на лист конюшини. Для всіх молекул характерно розташування на «стеблинці» «листа» певної нуклеотидної послідовності, до якої приєднується амінокислота. Протилежний цьому кінецева частина тРНК утворює петлю. Вона містить антикодон - три нуклеотиди, строго специфічних для амінокислоти, яку приносить ця РНК.
Амінокислота ковалентно зв'язується з тРНК при наявності ферментів - аміноацил-тРНК-синтетаз.
Другий етап реалізації спадкової інформації починається після від'єднання молекул РНК від ДНК. Він отримав назву процесинг. В цей період з РНК вирізаються ділянки (сплайсинг), які не несуть інформацію про структуру білка. Крім того, РНК набуває спеціального закінчення: до одного кінця приєднується метілірованний залишок гуанозіна (САР), з іншого боку утворюється ланцюжок із залишків аденіну (роlу А - «хвіст»). В такому стані мРНК виходить в цитоплазму до місця утворення білка.
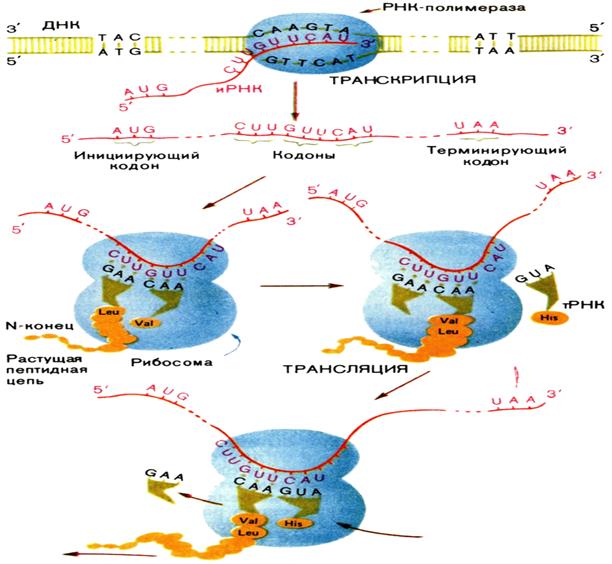
Третій етап - це перенесення інформації з мРНК на амінокислотну послідовність. Даний процес називається трансляцією. Він відбувається в рибосомах за участю транспортних РНК. Цей етап складається з трьох стадій: ініціації, елонгації та термінації.
Ініціація починається з прикріплення малої субодиниці рибосоми до мРНК на ділянці зв'язування, який містить звичайно 3 нуклеотиду: АУГ. Потім туди ж приєднується тРНК, що несе метіонін, оскільки її антикодон компліментарний послідовності АУГ на мРНК. Після цього більша і мала субодиниці об'єднуються і образується активна рибосома. У великій субодиниці рибосоми відбувається з'єднання двох амінокислот з утворенням пептидного зв'язку з участю спеціального ферменту - пептидил-трансферази.
Потім рибосома зміщується вздовж мРНК на 3 нуклеотиди, і тРНК з А-ділянки виявляється в Р-ділянці. Таким чином звільняється А-ділянка для іншої тРНК, антикодон якої буде компліментарен наступним нуклеотидам на мРНК. Багатократне повторення подібного процесу, включаючого утворення пептидного зв'язку між аминокислотами і просування рибосоми вздовж мРНК на 1 «крок», відповідний трьом нуклеотидам, призводить до постійного подовження поліпептидного ланцюга. При цьому послідовність амінокислот у цьому білку чітко обумовлена складом нуклеотидів в мРНК. Стадія подовження поліпептидного ланцюга на етапі трансляції отримала назву елонгації.
Відтворення поліпептидного ланцюга триває, поки рибосома не досягне нуклеотидної послідовності на мРНК, яка не кодує аминокислот - «стоп-кодон». Коли в А-ділянці рибосоми виявляється «стоп-кодон», туди входить спеціальний терминируются білок, який звільняє поліпептид від з'єднання з рибосомою. Потім рибосома поділяється на субодиниці і може прийняти участь в синтезі іншого поліпептидного ланцюга. Ця стадія трансляції отримала назву термінації.
Таким чином, процес передачі та реалізації спадкової інформації з молекули ДНК здійснюється шляхом утворення різноманітних білків за участю різних типів РНК
При цьому структура білкової молекули, склад її амінокислот визначається послідовністю нуклеотидів в відповідній ділянці молекули ДНК. Принцип реалізації спадкової інформації (експрессінг) від ДНК через РНК до білка є основою центральної догми молекулярної біології:
Транскрипція - Процесинг - Трансляція
Дата добавления: 2017-03-29; просмотров: 2261;
