Учение о составе вещества
В основе классической химии лежит концепция атомизма, которая была сформулирована еще в античной философии Левкипом, Демокритом и Эпикуром. На основе атомизма в середине 19 века были сформулированы основные положения атомно-молекулярного учения.
1. Вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его химическими свойствами. Молекулы отличаются между собой составом, размерами, физическими и химическими свойствами.
2. Молекулы находятся в непрерывном движении; между ними существует взаимное притяжение и отталкивание. Скорость движения молекул зависит от агрегатного состояния веществ.
3. При физических явлениях состав молекул остается неизменным, при химических реакциях из одних молекул образуются другие.
4. Молекулы состоят из атомов. Свойства атомов одного элемента отличаются от свойств атомов других элементов. Атомы характеризуются определенными размерами и массой. Масса атома, выраженная в атомных единицах массы (а.е.м.) называется относительной атомной массой.
1 а.е.м. = 1,667 10-27кг.
Атомно-молекулярное учение позволило объяснить основные понятия и законы химии. Понятие «химический элемент» предложил Р.Бойль, обозначение химических элементов символами предложил в 1814 г. Й. Берцелиус. Химический элемент – определенный вид атомов с одинаковым зарядом ядра. Заряд ядра численно равен порядковому номеру элемента в периодической системе. В настоящее время известно 118 химических элементов, из них 94 обнаружены в природе, остальные 24 получены искусственно в результате ядерных реакций.
Атом- наименьшая частица химического элемента, сохраняющая все его химические свойства. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: Атом- это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов.
Изотопы – атомы одного и того же химического элемента, имеющие разную массу и, соответственно, различное количество нейтронов в ядре. Изотопы могут быть стабильными, т.е. их ядра не подверженными самопроизвольному распаду, и радиоактивными, которые способны превращаться в атомы других элементов до тех пор, пока не образуется стабильный изотоп (Уран-238 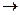 Свинец-206).
Свинец-206).
Аллотропия – способность элементов существовать в виде различных простых веществ, отличающихся физическими и химическими свойствами. Аллотропия может быть результатом образования молекул с различным числом атомов (например, атомарный кислород O, молекулярный кислород O2 и озон O3) или образования различных кристаллических форм (например, графит и алмаз). В результате аллотропии из 118 элементов образуется около 400 простых веществ.
Молекула - это наименьшая частица данного вещества, обладающая его химическими свойствами. Понятие молекула ввел итальянский ученый А.Авогадро. В 1811 году он предложил молекулярную теорию строения вещества.
Химические свойства молекулы определяются ее составом и химическим строением. Размеры молекул определяются их массой и структурой и у больших молекул могут достигать 10-5 см. В настоящее время известно свыше 18 млн. видов молекул разных веществ.
Химическая формула - это условная запись состава вещества с помощью химических знаков и индексов. Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Дата добавления: 2017-01-13; просмотров: 612;
