Биологическое значение.
Наиболее активно происходит дезаминироание глутаминовой кислоты, процесс катализирует фермент глутаматдегидрогеназа, ну а верный ассистент - кофермент это НАД+.
Реакции идет в 2 этапа.
1. Вначале происходит ферментативное дегидрирование глутамата и образование альфа-иминоглутарата.
2. Неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется альфа-кетоглутарат.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент- олигомер из 6 субъединиц. Играет важную роль, т.к. является регуяторным ферментом аминокислотного обмена.
Ингибиторы - АТФ, ГТФ и НАДН.
Активаторы - высокая концентрация АДФ.
Биологическая роль - регуляторным ферментом аминокислотного обмена.
Окислительное дезаминирование глутаминовой кислоты.
Глутаматдегидрогеназа.
ЭТО ЕСТЬ обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное аминирование α-кетоглутарата.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц. Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДФ активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образование α-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Синтез глутаматдегидрогеназы может индуцироваться стероидными гормонами (кортизолом).
Непрямое дезаминирование, транс-дезаминирование, химизм, био-
Логическая роль.
Большинство аминокислот не способно де-заминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглу-тарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования.
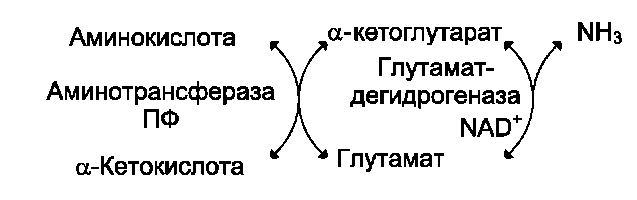
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: амино-трансферазы (кофермент ПФ) и глутаматдегид-рогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое деза-минирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы , что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты.
Дата добавления: 2017-01-13; просмотров: 4409;
