Метод электронных уравнений
Пример. Расставить коэффициенты в уравнении реакции:
KMnO4 + H2S + H2SO4 → MnSO4 + S + K2SO4 + H2O.
• Пишем схему реакции и проставляем степени окисления элементов.
• Видно, что степень окисления изменилась у марганца и серы: марганец был +7, стал +2, сера была –2, стала 0.
• Отражаем эти изменения степени окисления в электронных уравнениях и определяем элемент-окислитель и элемент-восстановитель:
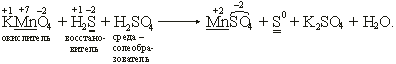
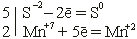
K2S – восстановитель, KMnO4 – окислитель.
Слева от электронных уравнений проводим вертикальную черту и проставляем коэффициенты, соответствующие числу электронов, отданных восстановителем и принятых окислителем. Множители перед вертикальной чертой «5» и «2» и есть основные коэффициенты перед окислителем и восстановителем.
• Переносим найденные основные коэффициенты при восстановителе и окислителе в заданную схему реакции:
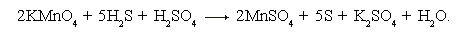
• Находим коэффициенты при других реагирующих веществах в следующем порядке: металлы, кислотные остатки (или неметаллы), водород, кислород.
• Правильность подбора коэффициентов проверяем равенством атомов кислорода в обеих частях уравнения:
2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O
Дата добавления: 2016-12-16; просмотров: 728;
