Изомерия комплексных соединений – самостоятельное изучение.
1. Геометрическая изомерия. В тетраэдрических К.С. этот вид изомерии не наблюдается. В плоских квадратных комплексах состава МА2В2 наблюдается цис- и транс-изомерия. Подобная изомерия возможна также в октаэдрических комплексах состава МА4В2 и МА3В3.
При названии комплексов, способных к существованию в виде цис- и транс-изомеров, состветствующая структура указывается при помощи приставки, отделённой дефисом, перед названием соединения, например цис-дихлоротетрамминкобальта(+3) хлорид.
2. Ионизационная изомерия. Соединения, которые имеют одинаковый состав, но образуют в растворе разные ионы, называют ионизационными изомерами. Характерными примерами являются [Co(NH3)4Cl2]NO2 и [Co(NH3)4(Cl)(NO2)]Cl; [Coen2(NO2)Cl]SCN, [Coen2(NO2)(SCN)]Cl и [Coen2(SCN)Cl]NO2; [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2.
Иногда встречается особый случай, часто называемый сольватной (гидратной) изомерией, например, в трёх изомерах CrCl3.6H2O:
а) [Cr(H2O)6]Cl3 – фиолетовый, не теряет воду при высушивании над H2SO4, все хлорид-ионы осаждаются ионами Ag+; б) [Cr(H2O)5Cl]Cl2.H2O – зелёный, теряет одну молекулу H2O при высушивании над H2SO4, ионами Ag+ осаждаются два хлорид-иона; в) [Cr(H2O)4Cl2]Cl.2H2O – также имеет зелёный цвет, но теряет две молекулы H2O при высушивании над H2SO4, ионами Ag+ осаждается один хлорид-ион. Дополнительные доказательства справедливости этих формул получены из данных по измерению мольной электропроводности. Примерами, которые иллюстрируют одновременно ионизационную и гидратную изомерию, могут служить соединения [Co(NH3)4(H2O)Cl]Br2 и [Co(NH3)4Br2]Cl . H2O.
3. Изомерия лигандов. Некоторые лиганды могут существовать в виде изомеров и входить в состав комплексов. Поскольку существуют 1,2-диаминопропан (pn) и 1,3-диаминопропан (tn), то могут быть изомерны и комплексы [Co(pn)2Cl2]Cl и [Co(tn)2Cl2]Cl.
4. Солевая изомерия. Такая изомерия наблюдается для лигандов, способных координироваться более чем одним способом. Наиболее известный пример - изомерия нитро- и нитрито-комплексов: [Co(NH3)5NO2]2+ - нитро-изомер и [Co(NH3)5ОNO]2+ - нитрито-изомер.
5. Координационная изомерия. В соединениях с комплексным катионом и комплексным анионом, распределение лигандов может меняться между координационными сферами, что приводит к образованию изомеров: [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6]; [Co(NH3)6][Cr(C2O4)3] и [Cr(NH3)6][Co(C2O4)3].
6. Полимеризационные изомеры. Эти соединения не являются изомерами в строгом смысле слова, но их принято рассматривать с этой точки зрения. Они различаются по молекулярному весу, хотя обладают одинаковым эмпирическим составом. Примерами таких веществ являются: [Pt(NH3)2Cl2] и [Pt(NH3)4][PtCl4].
Химическая связь в комплексных соединениях (основные тории)
1. Электростатические представления (Коссель, Магнус, 1916-1922).
Взаимодействие между КО и ионными лигандами происходит по закону Кулона. Частицы КО и лиганда считаются «недеформируемыми» шарами с определенным зарядом и радиусом. Когда сила притяжения лиганда к КО уравновешивается силой отталкивания меду лигандами, тогда и образуется комплексное соединение.
Из закона Кулона следует:
1) чем больше заряд и чем меньше радиус КО и лиганда, тем прочнее комплекс;
а) в следующем ряду устойчивость ионов уменьшается: [AlCl4]─, [AlBr4]─, [AlI4]─.
б) Кнест([Cu(NH3)2]+) = 10─11 больше, чем Кнест([Cu(NH3)4]2+ = 10─13.
2) к.ч. комплексообразователя с ионными лигандами обычно меньше, чем к.ч. комплексообразователя с дипольными молекулами (т.к. силы отталкивания между ионами больше): [Co(CNS)4]2─ и [Co(NH3)6]2+.
Основные недостатки теории: не может объяснить существование комплексных соединений с незаряженными лигандами; с комплексообразователем в нулевой степени окисления; не объясняет магнитные и оптические свойства комплексных соединений.
2. Метод валентных связей (МВС), (Полинг, 1930г.).
Основные положения:
1) связь к.о. и лиганда – донорно-акцепторная; к.о. должен иметь для образования ковалентных связей некоторое число вакантных орбиталей, определяющее его координационное число; орбитали лигандов точно не определяются; лиганды отдают в общее пользование электронную пару, к.о. – свободную орбиталь. Мерой прочности связи является степень перекрывания орбиталей.
2) Орбитали к.о. подвергаются гибридизации. Тип гибридизации обусловлен: числом лигандов; природой лигандов; электронным строением лигандов.
| КЧ | Тип гибридизации | Пространственное строение | Пример | Относит. прочность связи |
| sp | Линейное | [Ag(CN)2]─ | 1,932 | |
| sp2 | Тригональное | [HgI3]- | 1,991 | |
| sp3 | Тетраэдрическое | [FeBr4]2- | 2,000 | |
| dsp2 | Квадратное | [Ni(CN)4]2- | 2,694 | |
| dsp3, d3sp | Тригональная бипирамида | [CuCl5]3- | ||
| d2sp2, d4s | Квадратная бипирамида | [Ni(CN)5]3- | ||
| d2sp3, sp3d2 | Октаэдрическое | [Co(NH3)6]3+ | 2,923 | |
| d3sp3 | Пентагональная бипирамида | [V(CN)7]4- | ||
| d4sp3 | Квадратная антипризма | [TaF8]3- |
3) Дополнительную прочность комплексные соединения получают за счет π-связывания (электроны – от к.о., свободные π-орбитали – от лиганда).
4) Магнитные свойства определяют по заселенности орбиталей: есть неспаренные электроны, значит, комплекс обладает парамагнитными свойствами; нет неспаренных электронов – комплекс будет диамагнитным.
Примеры.
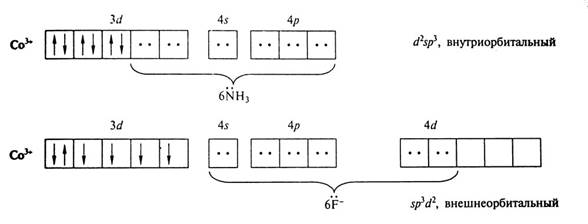
Первый комплекс - спин-спаренный; или низкоспиновый. Второй комплекс - спин-свободный или высокоспиновый.
Основные недостатки теории. Не все лиганды способны легко отдавать пару электронов для образования σ-связи. Известно много лигандов (СО, RNC, PX3, PR3, SR2 и т. д.), которые очень бедны донорными электронными парами, но образуют прочные комплексы с металлами. Т.е. теория описывает ограниченный круг веществ; комплексы с многоцентровыми связями не рассматривает; не объясняет оптические свойства веществ.
Дата добавления: 2016-12-08; просмотров: 3752;
