Сукцинат: ФАД – оксидоредуктаза
В этом названии отмечены сразу три особенности:
а) донором атомов водорода (субстратом) является янтарная кислота (сукцинат);
б) акцептором атомов водорода служит флавинадениндинуклеотид (ФАД);
в) от донора к акцептору переносятся атомы водорода.
Систематическое научное название фермента позволяет написать уравнение химической реакции, которую ускоряет данный фермент. Например, ферментативное окисление янтарной кислоты:
СДГ
HOOC – CH2CH2 – COOH + ФАД → HOOC – CH = CH – COOH + ФАД ∙ 2H
донор акцептор донор акцептор
(red) (ox) (ox) (red)
Названия ферментов по научной номенклатуре несоизмеримо выигрывают в точности, но становятся в ряде случаев гораздо сложнее старых – тривиальных и рациональных. В связи со значительным усложнением научных названий в новой номенклатуре ферментов допускается сохранение наряду с систематическим старых (тривиальных рабочих и рациональных) названий ферментов.
Тривиальная номенклатура ферментов в историческом плане была первой. Наименование ферментам давали по случайным признакам. Например, пепсин (от греч. пепсис – пищеварение), трипсин (от греч. трипсис – разжижаю), папаин (от названия дынного дерева Carica papaja, из сока которого он выделен). По действию все эти ферменты являются протеолитическими, т.е. ускоряют гидролиз протеинов (белков). Характерное название было дано группе окрашенных внутриклеточных окислительно-восстановительных ферментов – цитохромы (от лат. citos – клетка и chroma – цвет).
Достоинство тривиальной номенклатуры ферментов - краткость названия, недостаток – название фермента не отражает название субстрата (вещества) и тип его ферментативного превращения.
Согласно рациональной номенклатуре, название фермента составляется из названия субстрата и характерного окончания –аза. Липаза (от греч. липос – жир) – ускоряет гидролиз жиров, амилаза ( от греч. амилон – крахмал) – ускоряет гидролиз крахмала, протеаза – ускоряет гидролиз белков (протеинов), уреаза (от греч. уреа – мочевина) – ускоряет гидролиз мочевины.
В дальнейшем, когда методами аналитической химии была расшифрована химическая природа добавочных групп сложных ферментов, возникла новая номенклатура: ферменты стали называть по названию простетической группы. Например, геминфермент (простетическая группа – гем,), пиридоксальфермент (простетическая группа – пиридоксаль).
Решение упражнений
Задание 1. Фермент цикла Кребса малатдегидрогеназа является НАД-зависимым ферментом, катализирующим превращение яблочной кислоты (малат) в соответствии со следующей схемой:
L – малат + НАД+ → оксалоацетат + НАДН…Н+
Напишите уравнение реакции и определите к какому классу и подклассу ферментов относится малатдегидрогеназа.
Решение. В предметном указателе учебника по названию фермента находим соответствующий раздел и реакцию, которую он ускоряет:
COOH COOH
| |
 HO – C – H + НАД+ C = O + НАДН…H+
HO – C – H + НАД+ C = O + НАДН…H+
| акцептор (ox) | акцептор (red)
CH2COOH CH2COOH
донор (red) донор (ox)
Далее даем характеристику ферменту и определяем его принадлежность к определенному классу и подклассу в соответствии с Международной классификацией ферментов.
Малатдегидрогеназа является двухкомпонентным ферментом. В качестве кофермента содержит никотинамидадениндинуклеотид (НАД+), который за счет связывания со специфической белковой частью, обладает способностью восстанавливаться по ядру никотинамида (остаток витамина В5 (РР) – составная часть НАД+). В результате пиридинпротеины способны отнимать от субстратов (доноров) атом водорода, окисляя их путем дегидирования. Пиридинпротеины относятся к анаэробным дегидрогеназам, т.е. не передают снятые с субстратов атомы водорода не на кислород, а посылают их на ближайший в окислительно-восстановительной цепи другой фермент (см. раздел «Биологическое окисление»).
Малатдегидрогеназа относится в первому классу (оксидоредуктазы) и к первому подклассу (окисление спиртовых групп – CH – OH), следовательно,
КФ. 1.1. |
Задание 2. Некоторые α-аминокислоты играют доминирующую роль в обеспечении работы мозга, так как являются предшественниками нейромедиаторов и гормонов. При отсутствии в пище такой незаменимой кислоты, как фенилаланин, у человека замедляется реакция, и он начинает «туго соображать». За способность к концентрации внимания и повышение общего тонуса отвечает дофамин (ДОФА, или 3,4-дигидроксифенилаланин), предшественником которого является аминокислота тирозин. Тирозин в свою очередь образуется из фенилаланина при каталитическом участии фенилаланин-4-гидрокслазы в соответствии со следующей схемой процесса:
фенилаланин + О2 +НАДФН…Н+ → тирозин + НАДФ+ +Н2О
Напишите уравнение реакции, определите класс и подкласс, к которому относится указанный фермент в соответствии с Международной классификацией ферментов.
Решение. Находим в учебнике реакцию, которую катализирует указанная гидроксилаза:
 |
 H2NCHCOOH + O2 + НАДФН…Н+ → H2NCHCOOH + НАДФ+ + H2O
H2NCHCOOH + O2 + НАДФН…Н+ → H2NCHCOOH + НАДФ+ + H2O
│ │
CH2 CH2

 │ │
│ │


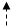 |
 │
│
OH
донор акцептор донор донор донор акцептор
(red) (ox) (red) (ox) (ox) (red)
прямое
Как видно из уравнения реакции, окисление фенилаланина осуществляется за счет прямого включения в 4-е положение бензольного ядра атома кислорода. Кроме того, в качестве парного донора, от которого поступают атомы водорода на один из атомов молекулярного кислорода, фермент использует восстановленный по ядру никотинамида кофермент НАДФН…Н+ (никотинамидадениндинуклеотидфосфат). Следовательно, указанная гидроксилаза относится к первому классу (оксидоредуктазы) и к 14 подклассу (включение одного атома водорода в два окисляемых субстрата), КФ. 1.14.
Задание 3. Глутаматдекарбоксилаза катализирует превращение глутаминовой кислоты по ее α-COOH группе в соответствии со следующей схемой реакции:
глутаминовая кислота → γ-аминомаслянная кислота + CO2
(ГАМК)
ГАМК накапливается в мозговой ткани и действует как сигнальное вещество – нейромедиатор, тормозящий деятельность центральной нервной системы при чрезмерном психическом возбуждении.
Напишите уравнение реакции, определите класс и подкласс глутаматдекарбоксилазы.
Решение. Находим в учебнике реакцию, которую катализирует указанный фермент:
 |
 H2N – CH – COO H → H2N – CH2 – CH2 – CH2 – COOH + CO2
H2N – CH – COO H → H2N – CH2 – CH2 – CH2 – COOH + CO2
|
(CH2)2COOH
А – В А В
Даем характеристику ферментам, катализирующим промежуточный обмен аминокислот путем реакций декарбоксилирования. Определяем принадлежность глутаматдекарбоксилазы к определенному классу и подклассу в соответствии с Международной классификацией ферментов.
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются ферментами, отличающимися от декарбоксилаз α-кетокислот как по белковому компоненту, так и по природе добавочной группы. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (производное витамина В6, см. учебник).
Декарбоксилазы катализируют отщепление углекислого газа за счет разрыва в субстрате А–В связи С–С, следовательно глутаматдекарбоксилаза в соответствии с общей схемой действия (см. классификацию) относится к четвертому классу (лиазы) и первому подклассу (расщепляют связи С-С), т.е. КФ. 4.1.
Задание 4. В процессе поэтапного распада пищевых белков в желудочно-кишечном тракте принимают участие различные ферменты желудочного, панкреатического и кишечного соков. Трипсин, содержащийся в панкреатическом соке, расщепляет фрагменты молекул белков после действия пепсина желудочного сока. Предположим, что после действия пепсина образовались разнообразные полипептиды (пептоны), в их числе франмент следующего полипептида:
… -глу-три-ала-арг-цис-гли-гли-про-лиз-тир-гис-ала- …
Приведите схему дальнейшего расщепления этого фрагмента с участием трипсина. Укажите к какому классу и подклассу относится трипсин в соответствии с Международной классификацией ферментов.
Решение. По тривиальному названию фермента находим в учебнике информацию о последовательности действия ферментов желудочно-кишечного тракта в процессе переваривания белков и их избирательности (специфичности) действия после определенных аминокислот в молекуле белка.
Распад белков с участием протеолитических ферментов желудочно-кишечного тракта осуществляется за счет разрыва пептидных связей с присоединением элементов воды. В соответствии с общей схемой действия (см. классификацию ферментов) указанные ферменты относятся к третьему классу (гидролазы) и четвертому подклассу (пептидазы) – гидролизуют пептидные связи (– CO – NH –), т.е. КФ. 3.4.
Трипсин относится к группе протеолитических ферментов, катализирующих гидролиз пептидных связей внутри пептидной цепи. Такие ферменты получили название эндопептидаз. Эндопептидазы обладают разной субстратной специфичностью действия, определяемой природой радикалов аминокислот по соседству с разрываемой пептидной связью. Трипсин обладает более узкой субстратной специфичностью по сравнению с пепсином желудочного сока, так как разрывает пептидные связи, в образовании которых участвуют α-карбоксильные группы лизина и аргинина, т.е. основные аминокислоты (см. классификацию аминокислот).
Следовательно, схему действия трипсина на фрагмент белка можно показать следующим образом:
↓ ↓
… -глу-три-ала-CONH – CH – CO – NH-цис-(гли)2-про-CONH –CH – NH-тир-гис-ала-…
| |
(CH2)3 (CH2)4
| |
NH NH3
+ | + +
NH3 – C = NH2
+ 2H2O → …-глу-три-ала-арг(OH) + (H2N)цис-(гли)2-про-лиз(OH) + (H2N)тир-гис-ала-...
Специфичность действия трипсина нашла широкое применение в исследовательской работе при установлении первичной структуры индивидуальных белков по методу Эдмана.
Дата добавления: 2016-11-22; просмотров: 1330;
