Протеиногенные α-аминокислоты
ПЕПТИДЫ, БЕЛКИ
Пептиды управляют жизненными функциями любого организма. Роль пептидов в процессах жизнедеятельности крайне многообразна. Многие из них служат гормонами (окситоцин, вазопрессин, гастрин, глюкагон, инсулин и др.), некоторые представлены сильнейшими ядами (яды змей, жаб, улиток, пауков, насекомых, высших грибов, микроорганизмов), мощными антибиотиками (пептиды микробов), ризилинг-факторами (способствуют синтезу и высвобождению гормонов), регуляторами клеточного деления, переносчиками молекул и ионов через биологические мембраны, регуляторами психической деятельности (способны вызывать радость и страх, гнев и удовольствие, могут ослаблять или усиливать боль, улучшать или ухудшать память), регуляторами физиологического состояния (могут влиять на чувство голода, работу сердца, сосудов и др.).
В настоящее время насчитывается более 50 классов пептидов. Пептиды образуются в самых различных тканях человека. Интерес к ним объясним, так как их избыток или недостаток лежит в основе многих заболеваний. У здорового человека баланс пептидов поддерживается с высокой точностью.
Значительное число природных пептидов синтезировано; кроме того, получены сотни аналогов, некоторые из которых обладают более сильным биологическим действием, нежели их природные предшественники. И те, и другие находят широкое практическое применение в медицинской практике, широко используются в пищевых технологиях в качестве вкусовых добавок – заменителей сахара (например, аспартам).
Структурными элементами пептидов и белков являются остатки α-аминокислот. Пептидами называют соединения, построенные из небольшого числа молекул α-аминокислот, а системы, состоящие из множества соединенных между собой пептидных звеньев, называют полипептидами. Условно принято, что пептиды содержат от двух до 50 аминокислотных остатков, полипептиды – не более 100; если же их число превышает 100, то это белки. Остатки α-аминокислот во все перечисленных соединениях связаны между собой ковалентными пептидными связями (– CO – NH –).
В состав белков входит 20 протеиногенных α-аминокислот (табл. 1). Протеиногенными называют α-аминокислоты, которые постоянно встречаются в природных белках, кодируются генетическим кодом и включаются белки в процессе их биосинтеза – трансляции.
Таблица 1
Протеиногенные α-аминокислоты
| Алифатические | Серосодержащие | |||||||||||||
| глицин (гли) | аланин (ала) | валин* (вал) | лейцин* (лей) | изолейцин* (иле) | цистеин (цис) | метионин* (мет) | ||||||||
| │ H | │ CH3 | │ H3C – CH │ CH3 | │ CH2 │ H3C – CH │ CH3 | │ CH – CH3 │ CH2 │ CH3 | │ CH2 │ SH | │ (CH2)2 │ S │ CH3 | ||||||||
| Ароматические | Иминокислоты | Нейтральные | ||||||||||||
| фениналанин* (фен) | тирозин (тир) | триптофан* (три) | пролин (про) | серин (сер) | треонин* (тре) | |||||||||
│
CH2
│
 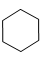
| │
CH2
│
  │
OH
│
OH
| │
CH2
│
   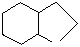 │
H
│
H
| COOH │ CH / \ HN CH2 \ / H2C – CH2 | │ CH2 │ OH | │ CH – OH │ CH3 | |||||||||
| * незаменимые кислоты | ||||||||||||||
| Нейтральные | Кислые | Основные | ||||||||||||
| аспарагин (асн) | глутамин (глн) | аспараги-новая к-та (асп) | глутаминовая к-та (глу) | гистидин (гис) | лизин* (лиз) | аргинин (арг) | ||||||||
| │ CH2 │ CONH2 | │ CH2 │ CH2 │ CONH2 | │ CH2 │ COO - | │ (CH2)2 │ COO - | │
CH2
 │ N
║ ║ │ N
║ ║
  N
│
H
N
│
H
| │ (CH2)4 │ NH3 + | │ (CH2)3 │ NH │ C / \\ H3N NH2 + + | ||||||||
Все протеиногенные аминокислоты характеризуются общей структурной особенностью – наличием карбоксильной группы (– COOH) и аминогруппы (– NH2), которые связанны с одним и тем же атомом углерода, находящимся в α-положении по отношению к карбоксильной группе:
 α
α
H2N – CH – COOH
│
R
Различаются же аминокислоты только боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре.
Образование пептидов можно условно показать на примере межмолекулярного взаимодействия двух любых аминокислот друг с другом. При этом из двух молекул аминокислот образуется дипептид, из трех – трипептид и т.д. (для того, чтобы понять закономерность связывания остатков аминокислот в пептидах и белках, необходимо записать общий структурный блок аминокислот, а боковые цепи, связанные с α-углеродным атомом, убрать вниз).
Межмолекулярное взаимодействие α-аминокислот осуществляется по типу реакции поликонденсации (образование пептидных связей (– CONH –) сопровождается выделением низкомолекулярного вещества – воды):

 α α α α
α α α α
H2N–CH2–COOH+H NH–CH–COOH → H2N–CH2 –CO –NH –CH –COOH→
│ -H2O │
CH3 дипептид CH3
 H2N–CH2–COOH
H2N–CH2–COOH
 H2N–CH2 –CO–NH–CH–CO –NH–CH2 – COOH и т.д.
H2N–CH2 –CO–NH–CH–CO –NH–CH2 – COOH и т.д.
-H2O │
CH3
трипептид
Исключение: в образовании пептидной связи у пролина (иминокислота) принимает участие α-иминогруппа, в этом случае пептидная связь будет – CO – N –:
 α
α  α
α
 H2N –CH–CO OH + H N –CH–COOH H2N–CH – CO – N – CH – COOH
H2N –CH–CO OH + H N –CH–COOH H2N–CH – CO – N – CH – COOH
| / \ -H2O | / \
CH3 H2C CH2 CH3 H2C CH2
\ / \ /
CH2 CH2
Таким образом, характерной особенностью строения полипептидной цепи является наличие монотонно повторяющихся –NH–CH–CO– фрагмен-
|
тов, которые образую скелет, или остов молекулы. Полипептидная цепь является структурной основой белков.
В действительности синтез пептидов и полипептидов из аминокислот – очень сложный процесс (в клетках они синтезируются в процессе трансляции на рибосомах).
Протеиногенные аминокислоты способны включаться в пептиды, полипептиды и белки в процессе их биосинтеза в различных комбинациях и последовательностях (в соответствии с генетической информацией), в результате образуются пептиды, полипептиды и белки, обладающие совершенно разными свойствами и биологической активностью. Подсчитано, что из 20 аминокислот можно получить 2,4·1018 различных комбинаций, т.е. изомеров, но ведь это очень короткий полипептид! Сколько же может существовать аминокислотных последовательностей?
Дипептид, состоящий их двух разных аминокислот – А и В, в зависимости от порядка их расположения, может иметь две изомерные формы: АВ и ВА. Трипептид, состоящий из трех различных аминокислот – А, В и С, может существовать в шести, отличающихся по последовательности, вариантах: АВС, АСВ, ВАС, ВСА, САВ, и СВА. Число возможных изомеров по последовательностям аминокислот, при условии отсутствия повторов, можно рассчитать по формуле «эн факториала»: n! = n (n–1)(n–2) и т.д., где n – число аминокислот. Например, трипептид из трех разных аминокислот может иметь 3! = 3 (3–1)(3–2) = 6 различных изомеров. Для полипептида из 10 различных аминокислот, ни одна из которых не повторяется в нем дважды, число изомеров составит 10! = 10 · 9 · 8 · 7 · 6 · 5 · 4 · 3 · 2 ·1, что дает в результате цифру равную 3628800.
Сколько различных дипептидов может существовать при условии, что любая из двух аминокислот (А и В) может занимать любое из двух возможных положений, причем каждую аминокислоту можно использовать более одного раза?
Дипептид может иметь следующие изомерные формы: АВ, ВА, АА, ВВ. Отсюда следует, что число возможных изомеров в этом случае можно рассчитать по формуле: Аn: где n – число возможных повторов, А – общее количество аминокислот, т.е. в приведенном примере число возможных изомеров дипептида будет: 22 = 4.
Следовательно, 20 протеиногенных аминокислот при условии их повторов дают достаточное количество разнообразных белков, которое обеспечивает существование на нашей планете не только известных ныне биологических видов (более 10 млн.), но и предусматривает возможность возникновения в ходе биологической эволюции новых видов организмов.
Дата добавления: 2016-11-22; просмотров: 1151;
