Титриметрический (объемный) анализ
Молярная концентрация сэ = nэ/V, где nэ – количество вещества эквивалентов, моль; V – объем раствора, л; единица измерения концентрации – моль/л.
Количество вещества эквивалента (nэ) nэ = m/Mэ = cэ V, где m – масса вещества, г; Mэ – молярная масса эквивалента, г/моль, V – объем раствора, л.
Закон эквивалентов: nэ(А) = nэ(В) или
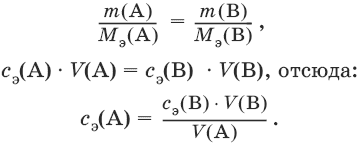
Титр – количество граммов растворенного вещества, содержащегося в 1 мл раствора.
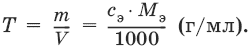
Титр по определяемому веществу – количество граммов определяемого вещества, которое реагирует с 1 мл титранта.
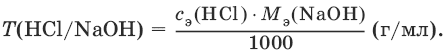
Прямое титрование – простейший прием титрования, заключающийся в том, что к определенному объему раствора определяемого вещества (А) по каплям приливают титрант (рабочий раствор) вещества (В).
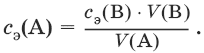
Обратное титрование – процесс титрования, при котором к определенному объему раствора определяемого вещества (А) приливают точно известный объем титранта (В1), взятого в избытке. Избыток не вошедшего в реакцию вещества (В1) оттитровывают раствором другого титранта (В2) точно известной концентрации.
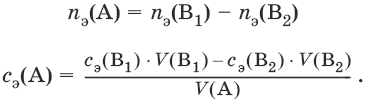
Заместительное титрование. Процесс титрования, при котором к определяемому веществу (А) прибавляют вспомогательное вещество (Р), реагирующее с ним с выделением эквивалентного количества нового вещества (А1), которое оттитровывают соответствующим титрантом (В). Таким образом, вместо непосредственного титрования определяемого вещества (А) титруют его заместитель (А1). Так как количества A и A1 эквивалентны, то количество вещества эквивалента определяемого вещества nэ(А) равно количеству вещества эквивалента титранта nэ(В):
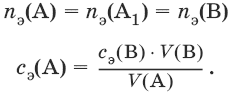
Дата добавления: 2016-04-23; просмотров: 1145;
