Абсолютная энтропия идеального кристалла при ОК равна нулю.
В идеальном кристалле при О К все частицы находятся в одном энергетическом состоянии, т.к. кристалл упорядочен, тепловое движение
отсутствует, то для идеального кристалла возможно только 1 состояние полной упорядоченности, т.е.
W=1
S=K ln 1=0
Энтропии веществ как и их теплота образования принято относить к
определенным условиям ( 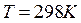 и
и 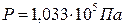 )
)
Энтропию при этих условиях называют стандартной энтропией образования и её значения сведены в таблицу
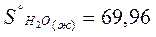 Дж/моль* К Дж/моль* К
| 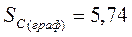 Дж/моль* К Дж/моль* К
| |
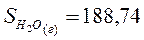 Дж/моль* К Дж/моль* К
| 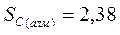 Дж/моль* К Дж/моль* К
|
Энтропия является функцией состояния системы и ее изменения в ходе химических реакций рассчитывается как разница суммарных энтропии продуктов реакций и исходных веществ
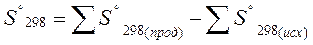 |
Вывод:
Изменение энтропии указывает на термодинамическую вероятность самопроизвольного протекания процесса. Если S > 0, то процесс, наиболее вероятен. S < 0, то процесс менее вероятен, но он может быть осуществлен.
Энергия Гиббса.
У любой химической реакции наблюдаются два противоположных тенденции: с одной стороны тенденция к достижению min энергии путем образования более крупных частиц. Это описывается функцией DН. С другой стороны тенденция к разбрасыванию частиц в большом объеме. Это описывается функцией состояния S. Значит, самопроизвольному процессу способствует уменьшение энтальпии и увеличение энтропии.
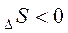 Возможны 2 случая:
Возможны 2 случая:
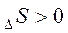 1. Н > 0
1. Н > 0
2. H < 0
Для оценки взаимного влияния 2-х этих функции введена функция G-свободная энергия Гиббса
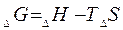
Если 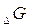 есть функция состояния системы, то она, так же как и
есть функция состояния системы, то она, так же как и 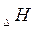
не зависит от пути перехода из одного состояния в другое, а зависит от природы веществ и физического состояния.
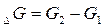
Величины изменения свободной энергии Гиббса для ряда соединений, образованных из простых веществ при стандартных условиях даны в таблице. Измеряется в кДж/моль; ккал/моль. G сильно зависит от температуры в отличии от 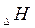 и
и 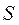 .
.
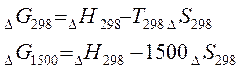
Величину G принято называть энергией Гиббса в честь американского
физика Д. У. Гиббса одного из основоположников современной химической
термодинамики.
Дата добавления: 2016-11-02; просмотров: 1532;
