Метод растирания порошков.
Присутствие ионов того или иного элемента обнаруживают по образованию соединений с характерным цветом или запахом. Так, при растирании смеси тиоцианата аммония NH4NCS или тиоцианата калия KNCS с солями Fe3+ появляется красно-бурое окрашивание, а с солями Со2+ -синее. Растирание проводят в фарфоровой ступке или на специальной фарфоровой пластинке.
Все «сухие» методы анализа используют только для вспомогательных или проверочных определений.
«Мокрый» метод анализа
Большинство аналитических реакций выполняют «мокрым» методом, т. е. проводят реакции с растворами. При анализе неорганических веществ реакции проходят между ионами, присутствующими в растворах анализируемых веществ и реактивов. Следовательно, механизм протекающих реакций может быть представлен только ионным уравнением. Например, для реакции
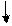 Pb (NO3)2 + 2KI — ► PbI2 + 2KNO3
Pb (NO3)2 + 2KI — ► PbI2 + 2KNO3
уравнение в ионной форме имеет вид:
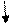

 РЬ2+ + 2I - PbI2
РЬ2+ + 2I - PbI2
Из ионного уравнения видно, что осадок РbI2 образуется при взаимодействии катионов РЬ2+ и анионов I-.
Рассмотрим еще один пример. Ион С1~ открывают действием иона Ag+ Осадок АgС1 может быть получен при взаимодействии любого растворимого соединения, содержащего ион С1~,слюбым растворимым соединением, содержащим ион Ag+
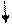 КCl + АgNO3— > AgCl + KNO3
КCl + АgNO3— > AgCl + KNO3
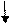 BaCl2 + 2AgCH3COO--------- ► 2AgCl + Ba(CH3COO)2.----------------------------
BaCl2 + 2AgCH3COO--------- ► 2AgCl + Ba(CH3COO)2.----------------------------
Объясняется это тем, что ионная форма приведенных уравнений одинакова:
 |
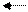
 Сl -+ Аg + AgCl.
Сl -+ Аg + AgCl.
Очевидно, этот осадок образуется добавлении растворимой соли серебра к соединениям хлора, не содержащим хлорид-ион, например к раствору хлората калия КС1О3. Один и тот же элемент может существовать в растворах в виде разных ионов: Fe 3+—Fe2+ ; Zn 2+—ZnO22- ; Mn 2+— MnO4-; Sn2+ - SnO32- и т. д. Каждый из этих ионовимеет свои характерные реакции. Так, ион Fe2+ в растворе можно открыть действием гексацианоферрата (III) калия K2[Fe(CN)6]:
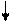
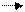
 3 F e2+ + 2Fe(CN)6 3- Fe3[Fe(CN) 6]2.
3 F e2+ + 2Fe(CN)6 3- Fe3[Fe(CN) 6]2.
Ион Fe3+ с этим реактивом осадка не дает. Открывают егодействием гексацианоферрата (II) калия K4[Fe(CN)e]:

 4Fe3+ + 3Fe(CN)64- Fe4[Fe(CN)6]3.
4Fe3+ + 3Fe(CN)64- Fe4[Fe(CN)6]3.
Выполняют реакции «мокрым» методом в химических илицентрифужных пробирках и на фильтровальной бумаге.
ПРИЛОЖЕНИЕ(см.отдельно)
Дата добавления: 2016-11-02; просмотров: 1344;
