Опасности объектов, содержащих горючие и взрывчатые вещества
В основе процессов горения лежат химические реакции молекул горючего и окислителя.
Энергия, необходимая для разрыва связей в молекулах горючего и окислителя, называется энергией активации. Разрушение или ослабление химических связей в молекулах происходит под действием теплового движения атомов. Чем выше температура, тем выше доля активных молекул, тем эффективнее соударения и больше их число. Для реакции горения, как и для многих других химических реакций, справедливо положение: повышение температуры на 10° С приводит к увеличению скорости горения в два раза (закон Аррениуса).
Кроме того, скорость реакции согласно закону действующих масс увеличивается с возрастанием концентрации реагентов. Скорость горения максимальна при стехиометрическом составе смеси - когда отношение реагентов соответствует коэффициентам в уравнении реакции.
Процесс горения как одна из форм химического взаимодействия атомов и молекул может быть по-настоящему понятен только на основе изучения молекулярно-кинетической теории строения материи.
Горению как химической реакции, идущей с большим выделением тепла, соответствует ряд физических явлений (рис. 7.4):
происходит перенос тепла реагирующих веществ и продуктов горения от объекта к объекту теплопроводностью за счет молекулярной и турбулентной диффузии;
за счет конвекции осуществляется тепломассообмен как внутри горящей системы (между объектами горения), так и между потоками;
происходит теплопередача от горящего объекта в окружающую среду.
Все перечисленные процессы взаимосвязаны. Скорость химической реакции горения определяется процессами теплопередачи, взаимной диффузией горючего, окислителя, продуктов горения. В свою очередь, температура, скорость горения зависят от интенсивности химической реакции. Важная особенность явления горения - способность к пространственному распространению (лесные и степные пожары).
Законами химической кинетики строго можно описать лишь один вид горения - гомогенное, кинетическое, когда горючее и окислитель находятся в одной фазе и предварительно перемешаны. В этом случае скорость химической реакции зависит только от природы реагирующих веществ, концентрации и температуры смеси. Кроме того, интенсивность процесса горения зависит от характера передачи вещества и тепла в зону реакции, т.е. от движения газа, пара, воздуха, диффузии и теплопроводности. Поэтому степень подготовленности и газодинамические условия горючей смеси определяют все параметры горения на пожаре.
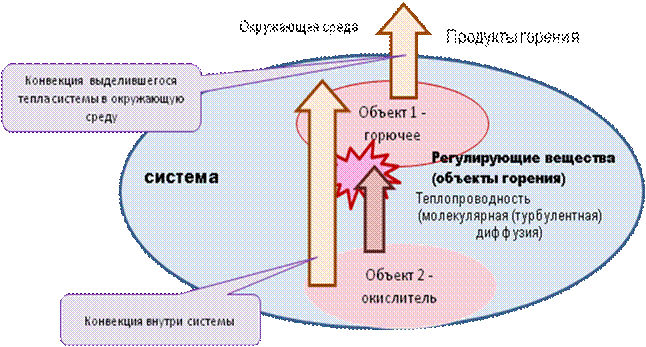
Рис. 7.4. Процесс взаимодействия окружающей среды и системы, подверженной горению
Различают диффузионное и кинетическое горение, гомогенное и гетерогенное, ламинарное и турбулентное. Степень турбулизации газового потока определяется числом Рейнольдса Re, плотностью среды ρ, скоростью потока V (рис. 7.5).
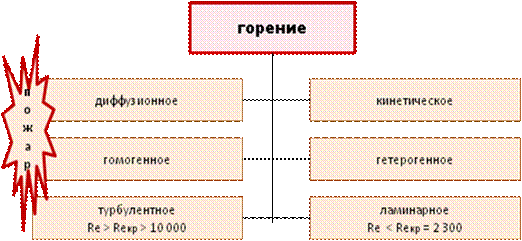
Рис. 7.5. Виды горения
При значениях Re < Reкр= 2300 движение носит ламинарный характер, при более высоких числах (Re > 10 000) - турбулентный.
В горении физические процессы и условия являются доминирующими и определяют вид горения, его параметры, но в основе горения лежит химическое превращение горючего и окислителя в продукты горения. На пожаре чаще всего наблюдается турбулентное, диффузионное, гомогенное горение.
Показатели пожаро- и взрывоопасных свойств материалов определяют на всех стадиях процесса горения: воспламенения, горения и тушения с учетом их агрегатного состояния.
Для оценки пожароопасных свойств веществ и материалов используют расчетные и экспериментальные методы. Большинство расчетных методов являются приближенными, носят характер эмпирических зависимостей. Таким примером являются формулы для определения температуры самовоспламенения по средней длине углеродной цепи, концентрационных пределов распространения пламени и другие.
Обобщенная запись брутто-уравнения материального и теплового баланса реакции горения имеет вид:
nг [г] + no [o] = nпгi [пг] + Q, (7.1)
где:
nг, no, nпгi-стехиометрические коэффициенты при соответствующих веществах ([г]- горючее, [o]-окислитель, [пг]- продукты горения);
Q - тепловой эффект химической реакции.
Для составления материального баланса процессов горения используют уравнения элементарных реакций окисления элементов, входящих в состав горючего, выражен в массовых процентах каждого химического элемента на единицу массы горючего.
Во время горения реакции между горючим, продуктами его термического разложения протекают в объеме пламени - в зоне горения.
Минимальное (теоретическое) количество воздуха, необходимое для полного сжигания 1 кг твердого или жидкого горючего материала или 1 м3 горючего газа, называется теоретическим количеством воздуха и обозначается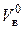 . Действительное количество воздуха
. Действительное количество воздуха 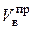 является произведением коэффициента избытка воздуха aи теоретического количества воздуха
является произведением коэффициента избытка воздуха aи теоретического количества воздуха 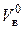 .
.
Коэффициент избытка воздуха aпоказывает, во сколько раз объем воздуха, поступивший на горение, больше теоретического объема воздуха, необходимого для полного сгорания единицы количества вещества в стехиометрической смеси.
Объем продуктов горения, образовавшихся при сжигании единицы горючего (1 кг, 1 м3, 1 кмоль) в теоретическом количестве воздуха, равен:
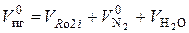 , (7.2)
, (7.2)
где:
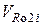 -объем продуктов полного окисления i-х химических элементов в горючем веществе, м3/кг, м3/м3 гор.газа, м3/кмоль, кмоль/кмоль;
-объем продуктов полного окисления i-х химических элементов в горючем веществе, м3/кг, м3/м3 гор.газа, м3/кмоль, кмоль/кмоль;
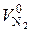 - объем азота;
- объем азота;
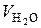 - объем паров воды.
- объем паров воды.
Полный, действительный объем продуктов горения находится с учетом избытка воздуха (a > 1):
 (7.3)
(7.3)
Расчет ведется на 1 кг (1 кмоль, 1 м3) твердого, жидкого или газообразного горючего.
Тепловой баланс процесса горения составляется и рассчитывается для определения температуры горения.
Адиабатической температурой горения называется температура, до которой нагреваются продукты горения, когда все тепло, выделившееся при горении, идет на их нагрев.
Действительная температура горения всегда ниже адиабатической, так как часть тепла теряется на излучение.
Температура горения не зависит от количества сгоревшего материала, так как количество тепла на единицу объема продуктов горения остается постоянным. Температура горения на пожаре зависит от скорости, полноты горения, величины избытка воздуха, температуры горючего материала и воздуха.
Теплота сгорания, используемая в расчетах температуры горения, - количество тепла, выделяемое при полном сгорании единицы количества горючего материала.
Различают низшую Qни высшую Qвтеплоту сгорания. Высшая теплота сгорания включает теплоту конденсации водяных паров, содержащихся в продуктах горения.
Смеси горючих газов и паров с воздухом способны воспламеняться и распространять пламя только тогда, когда концентрация горючего в них находится в определенных ограниченных пределах, которые называются нижним (НКПР) и верхним (ВКПР) пределами распространения пламени. Метан имеет область распространения пламени, равную 5-15 об. %.
В пределах одного гомологического ряда с увеличением относительной молекулярной массы пределы распространения пламени, выраженные в объемных процентах, уменьшаются. На нижнем пределе теплота сгорания большинства углеводородов соответствует примерно величине 1830-2050 кДж/м3, а адиабатическая температура горения равна 1500 К±110 К. Эти данные свидетельствуют о том, что для воспламенения горючих веществ и распространения пламени необходимы определенные условия.
С увеличением температуры область распространения пламени расширяется, а с уменьшением давления сужается. Концентрационные пределы распространения пламени изменяются и от ряда других причин: присутствия в смеси флегматизатора или ингибитора, мощности источника зажигания.
Концентрационные пределы распространения пламени (КПР) являются едва ли не основной характеристикой пожароопасных свойств веществ и материалов. Мощность зажигающей искры, температура самовоспламенения, температура горения имеют смысл только внутри концентрационной области распространения пламени (в горючей системе) (рис. 7.6).
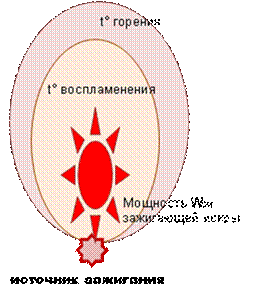
Рис. 7.6. Концентрационные пределы распространения пламени в горючей системе
Изменение предельных условий распространения пламени в таких горючих системах связано с тем, что пылевоздушные смеси являются гетерогенными системами, и при их горении главное место занимают поверхностные явления
Пределы распространения пламени веществ и материалов определяют расчетными и экспериментальными методами.
Наряду с принятой системой определения пределов по концентрации горючего в смеси, в последние годы для твердых горючих материалов стал довольно широко применяться предел распространения пламени по кислороду, который находится экспериментально и носит название кислородного индекса (КИ). Этот параметр также зависит от давления, температуры. Кислородный индекс характеризует то минимальное содержание кислорода в смеси с азотом, при котором возможно воспламенение горючего материала с его последующим горением.
Пределы распространения пламени применяются в практике для классификации производств по степени их пожарной опасности, при расчете предельно допустимых концентраций горючих паров и газов в помещениях при производстве огневых работ, для расчета взрывоопасных режимов работ в среде, содержащей горючие газы и пары.
К параметрам процесса самовоспламенения относится период индукции. Величина периода индукции зависит от начальной температуры, давления и химической природы горючего материала.
Условно, если температура начала процесса лежит в пределах 290-320º К, то говорят о самовозгорании, а если она выше, то процесс возникновения пламени называют самовоспламенением (рис. 7.7).
Рис. 7.7. Самовоспламенение и самовозгорание
Причиной самовозгорания могут быть:
микробиологические процессы;
адсорбция паров и газов, сопровождающаяся повышением температуры;
большая реакционная способность некоторых веществ, например щелочных металлов.
Самовозгоранию способствует развитая поверхность материала, термическая неустойчивость вещества и ряд других факторов.
Пожары, вызванные самовоспламенением пыли, чаще всего происходят в сушильном производстве, при складировании и транспортировке пылевидных материалов. В соответствии с тепловой теорией самовоспламенения Тсв аэрозоля зависит от формы и размеров частиц, природы пыли.
Самовозгорание бывает трех видов: тепловое, химическое, микробиологическое. Во всех случаях причиной загорания остается экзотермичность процесса окисления горючей системы. В наиболее общем виде характеристики воспламенения пыли являются функцией следующих факторов: концентрации, размера, формы частиц аэрозоля; состава, давления, температуры газовой среды.
Большинство пожаров возникают при действии на горючую смесь постороннего источника тепла: накаленного тела, электрической искры, пламени. Таким образом, воспламенение и горение чаще происходит не в результате самовозгорания и самовоспламенения, а при действии постороннего источника тепла. Этот процесс можно назвать вынужденным воспламенением.
Главным условием любого вида воспламенения горючей смеси остается превышение скорости тепловыделения над скоростью теплоотвода, так как условия самоускорения реакции окисления в горючей смеси после повышения температуры системы остаются теми же.
Различие в механизмах этих явлений заключается в том, что при самовоспламенении вся горючая смесь доводится до определенной температуры, а при зажигании весь объем может оставаться холодным, а до температуры воспламенения нагревается лишь его часть. Соответственно, в этом объеме температура должна быть выше, период индукции меньше, воспламенение протекает быстрее.
Природа воспламенения электрической искрой более сложна, чем тепловыми источниками. По Я.Б. Зельдовичу, возможность зажигания горючей смеси электрической искрой определяется соотношением времени охлаждения центра искрового промежутка до Тгmin (tохл) и временем начала химической реакции (tх.р). Если tохл  tх.р, то горение возможно, если же tохл
tх.р, то горение возможно, если же tохл 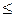 tх.р- воспламенение не происходит.
tх.р- воспламенение не происходит.
При искровом зажигании в качестве параметра, характеризующего пожароопасные свойства системы, принимают наименьшее предельное значение мощности искры, начиная с которого смесь способна воспламеняться с дальнейшим распространением пламени по всему объему. Мощность искры является функцией состава смеси, температуры, давления, теплопроводности, теплоемкости. Минимальная мощность искры при воспламенении движущейся горючей смеси больше, чем неподвижной. Эти вопросы имеют важность при оценке и выработке норм и требований пожарной безопасности производств, объектов, систем.
Пожары и взрывы зачастую представляют собой взаимосвязанные явления. Взрывы могут быть вторичными последствиями пожаров как результат сильного нагрева емкостей с горючими газами (ГГ), легковоспламеняющимися жидкостями (ЛВЖ), горючими жидкостями (ГЖ), а также пылевоздушных смесей (ГП), находящихся в закрытом пространстве помещений, зданий, сооружений (рис. 7.8.).
В свою очередь, взрывы, как правило, приводят к возникновению пожара на объекте, так как в результате взрыва образуется сильно нагретый газ (плазма) с очень высоким давлением, который оказывает не только ударное механическое, но и воспламеняющее воздействие на окружающие предметы, в том числе горючие вещества.
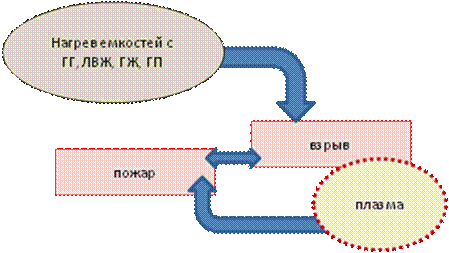
Рис. 7.8. Взаимосвязь взрыва и пожара
Минимальное количество воздуха, необходимое для полного сгорания единицы количества (кг, кмоль, м3) горючего вещества, называется теоретическим количеством воздуха 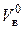 .
.
При горении на пожарах расход воздуха отличается от теоретически необходимого. Действительный расход воздуха на единицу горючего записывается как Vв = a 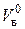 . Множитель aназывается коэффициентом избытка воздуха. Разность между действительным и теоретически необходимым количеством воздуха называется избытком воздуха:
. Множитель aназывается коэффициентом избытка воздуха. Разность между действительным и теоретически необходимым количеством воздуха называется избытком воздуха:
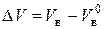 (7.4)
(7.4)
или:
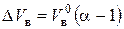 . (7.5)
. (7.5)
Определение количества воздуха и объема продуктов горения оказывается возможным на основании закона сохранения массы по уравнениям химических реакций.
При составлении уравнения материального баланса процессов горения принято учитывать не только кислород, принимающий участие в реакции окисления, но и азот, входящий в состав воздуха.
Так как на один кмоль кислорода в воздухе приходится 3,76 кмоля азота (состав воздуха: 21 % O2 и 79 % N2), то материальный баланс процесса горения, например, бензола в воздухе можно записать так:
C6H6 + 7,5O2 + 7,5×3,76N2 = 6CO2 + 3H2O + 28,2N2. (7.6)
Из этого уравнения видно, что для полного сгорания 1 кмоля бензола требуется (7,5+7,5·3,76) кмолей воздуха (7,5 кмолей O2 и 7,5×3,76 кмоля, не принимающего участия в горении N2). При сгорании образуется 6 кмолей СО2, 3 кмоля H2O и остается непрореагировавшим (7,5×3,76) = 28,2 кмоля N2.
В общем виде можно записать:
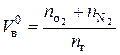 , (7.7)
, (7.7)
где:
n  ,n
,n 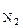 , nг- число кмолей кислорода, азота и горючего вещества в уравнении материального баланса, кмоль.
, nг- число кмолей кислорода, азота и горючего вещества в уравнении материального баланса, кмоль.
Аналогично объем продуктов горения:
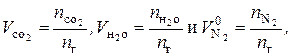 (7.8)
(7.8)
где:
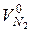 - объем азота, рассчитанный из уравнения материального баланса, кмоль/кмоль.
- объем азота, рассчитанный из уравнения материального баланса, кмоль/кмоль.
Объем продуктов горения:
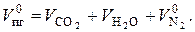 (7.9)
(7.9)
Если горение происходит с избытком воздуха (a > 1),то азота в продуктах горения будет больше:
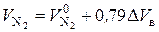 (7.10)
(7.10)
и в продуктах горения появится кислород:
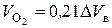 . (7.11)
. (7.11)
В этом случае полный объем продуктов горения:
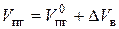 (7.12)
(7.12)
или:
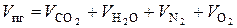 . (7.13)
. (7.13)
Иногда на практике приходится решать обратную задачу по известному содержанию кислорода (j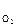 , об. %) в продуктах горения находить коэффициент избытка воздуха, с которым протекало горение вещества:
, об. %) в продуктах горения находить коэффициент избытка воздуха, с которым протекало горение вещества:
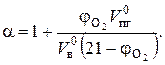 (7.14)
(7.14)
Для веществ, у которых объем продуктов горения равен объему израсходованного воздуха (например, горение углерода, серы), эта формула упрощается:
 .(7.15)
.(7.15)
Для газообразных горючих веществ расчет объемов воздуха и продуктов горения чаще всего проводят в м3/м3. Так как 1 кмоль любого газа в одинаковых условиях занимает один и тот же объем (при нормальных условиях 22,4 м3), то объем, рассчитанный в м3/м3, численно будет таким же, как и в кмоль/кмоль.
Под температурой горения понимают максимальную температуру, до которой нагреваются продукты горения. Принято различать адиабатическую температуру горения, рассчитываемую без учета потерь тепла в окружающее пространство, и действительную температуру горения, учитывающую эти теплопотери.
Температуру горения можно рассчитать, если известно количество теплоты, выделяемое при сгорании горючего вещества, состав и объем продуктов горения, их теплоемкость или теплосодержание. Тепловой эффект химической реакции горения (т.е. количество теплоты, выделяемое в ходе экзотермической реакции) называется низшей теплотой сгорания вещества Qн.
Если горючее имеет в своем составе водород, то при его сгорании образуется вода в газообразном состоянии, которая охлаждаясь, будет конденсироваться. Так как в процессе конденсации паров тепло выделяется, то общее количество теплоты, полученное при сгорании вещества, будет больше на величину теплоты испарения Qисп:
Qв = Qн + Qисп, (7.16)
где:
Qв - высшая теплота сгорания вещества.
При расчетах температуры горения пользуются величиной Qн,так как при температуре горения вода находится в газообразном состоянии.
Эта величина может быть рассчитана по закону Гесса:
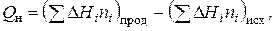 (7.17)
(7.17)
который говорит о том, что тепловой эффект химической реакции равен разности сумм теплоты образования продуктов реакции и теплоты образования исходных веществ.
В уравнении (7.17):
DHi- теплота образования i-того вещества;
ni - количество молей i-того вещества.
Для расчета температуры горения применяется уравнение теплового баланса, с учетом того, что выделившееся в результате сгорания тепло нагревает продукты горения (CO2, H2O, N2...) от начальной температуры T0 до температуры Tг:
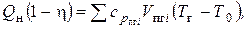 (7.18)
(7.18)
где:
h- коэффициент теплопотерь (доля потерь тепла на излучение, а также в результате неполноты сгорания); 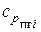 и Vпгi - теплоемкость и объем i-го продукта горения.
и Vпгi - теплоемкость и объем i-го продукта горения.
В уравнении теплового баланса записана теплоемкость газа при постоянном давлении (сp), так как именно в этих условиях чаще всего происходит горение.
Из уравнения теплового баланса:
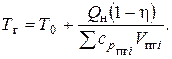 (7.19)
(7.19)
Трудность в определении Тг по этой формуле заключается в том, что теплоемкость газа зависит от температуры. Так как газы нагреваются от температуры Т0 доТг, то в формулу (7.19) необходимо подставить среднее значение теплоемкости именно в этом интервале температур. При отсутствии сведений о температуре горения Тгдля расчетов принимаются:
среднее значение температуры горения большинства веществ в воздухе составляет ~ 1500 К;
принимается среднее значение теплоемкости в интервале температур 273-1500 К.
Эти значения для основных продуктов горения приведены в табл.7.1.
Таблица 7.1
| Вещество | Удельная теплоемкость, 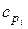
| |
| кДж(м3×К) | кДж/(моль×К) | |
| Диоксид углерода | 2,27 | 5,08×10-2 |
| Диоксид серы | 2,28 | 5,11×10-2 |
| Вода (пар) | 1,78 | 3,99×10-2 |
| Азот | 1,42 | 3,18×10-2 |
| Воздух | 1,44 | 3,23×10-2 |
В таблице 7.2 приведены значения низшей теплоты сгорания некоторых горючих веществ.
Таблица 7.2
| Наименование вещества | Низшая теплота сгорания, кДж/м3 | Наименование вещества | Низшая теплота сгорания, кДж/м3 |
| Метан | Пропилен | ||
| Этан | Бутилен | ||
| Пропан | Ацетилен | ||
| Бутан | Бензол | ||
| Этилен |
Если горючее представляет собой смесь индивидуальных веществ с известными концентрационными пределами распространения пламени, то для такой смеси можно установить значения нижнего и верхнего предела по формуле Ле-Шателье:
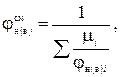 (7.20)
(7.20)
где:
mi - мольная доля i-го вещества в смеси;
jн(в)i - значение нижнего или верхнего концентрационного предела распространения пламени i-го вещества.
Эта формула справедлива для большинства смесей веществ, хотя в некоторых случаях могут наблюдаться значительные отклонения, связанные с химическим взаимодействием веществ (табл. 7.3).
Объекты, на которых производятся, хранятся или транспортируются вещества, приобретающие при некоторых условиях способность к возгоранию (взрыву), относятся соответственно к пожаро- или взрывоопасным объектам.
Процесс горения возможен при следующих основных условиях (рис. 7.9):
непрерывное поступление окислителя (кислорода воздуха);
наличие горючего вещества или его непрерывная подача в зону горения;
непрерывное выделение теплоты, необходимой для поддержания горения.
Зона наиболее интенсивного горения, в которой имеются все три условия, называется очагом пожара.
Процесс развития пожара состоит из следующих фаз:
распространение горения по площади и пространству;
активное пламенное горение с постоянной скоростью потери массы горючих веществ;
догорание тлеющих материалов и конструкций.
Таблица 7.3
Дата добавления: 2016-09-20; просмотров: 2201;
