СТРУКТУРНЫЕ СХЕМЫ ФОТОМЕТРОВ
Фотометр
Фотометр — оптический прибор, позволяющий измерять световой поток на фиксированных длинах (диапазонах) волн. Основные компоненты одноканального (однолучевого) фотометра показаны на рисунке 9.1.
Свет от источника излучения проходит через входную щель и попадает на светофильтр, который пропускает узкую область спектра, необходимую для измерения. Свет попадает на кювету с образцом, частично, в зависимости от количества исследуемого вещества, поглощается в кювете. Прошедший через кювету свет отделяется на выходной щели от рассеянного света. На фотоприемнике световой поток преобразуется в электрический сигнал, который измеряется микропроцессором. Величина прошедшего через кювету света зависит от состава и количества вещества в кювете. Как указывалось выше, в одноканальном фотометре измерение холостой пробы, калибратора, опытных проб и контролей проводится последовательно, в двухканальном фотометре измерение может проводиться по схеме компенсации, т. е. постоянного сравнения с бланком (холостой пробой).
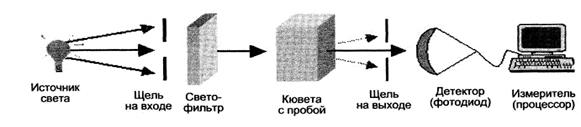
Рис. 9.1. Основные компоненты одноканального фотометра.
Особенности фотометрической
схемы биохимических анализаторов
Основой функционирования биохимического анализатора является получение избыточной информации, из которой компьютер с мощным программным обеспечением отбирает необходимые данные. Для получения многопараметрической информации биохимические анализаторы оснащены, как правило, полихроматорами (рис. 9.3), которые позволяют одновременно регистрировать оптическую плотность исследуемых растворов на нескольких длинах волн.
В биохимических анализаторах измеряются многократно многочисленные кюветы с пробами по нескольким спектральным характеристикам, а компьютер по заданной программе выбирает необходимые сигналы и на основе анализа их изменения рассчитывает концентрацию или активность аналитов.
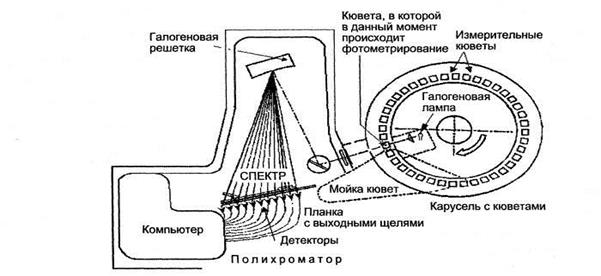
Рис. 9.3. Типичная схема основных узлов фотометрического блока биохимического анализатора.
Использование нескольких фотодиодов, регистрирующих одновременно сигналы разных частей спектра, является основным компонентом полихроматора.
Источник света (как правило, галогеновая лампа) находится внутри карусели с измерительными кюветами, в которых содержатся пробы для измерения. Карусель через фиксированные промежутки времени, примерно через 20 с, совершает оборот, при котором все кюветы освещаются белым светом, проходящим через входную щель. Таким образом, каждые 20 с все кюветы, находящиеся на карусели, фотометрируются белым светом, причем часть из кювет может быть пустой или моется в этот период, тем не менее, данные о них поступают в компьютер (но не анализируется). Прошедший через кювету свет разлагается на решетке в спектр и измеряется серией (до 12 штук) детекторов, каждый из которых настроен на определенную длину спектра, включая измерение в ультрафиолете и ближнем инфракрасном диапазоне (полихроматор). Компьютер анализирует результаты измерений всех детекторов, представляет результаты в конечном виде, кроме того, компьютер через соответствующие датчики контролирует работу практически всех узлов анализатора.
Спектрофотометр
Спектрофотометр — оптический прибор, который разлагает световой поток на непрерывный спектр и позволяет измерять его на любой длине волны в пределах оптического диапазона. В качестве диспергирующего устройства, разлагающего свет на монохроматический, используется диспергирующая призма или дифракционная решетка.
Последовательность и месторасположение отдельных оптических элементов и систем на пути следования светового потока от источника света до детектора излучения в том или ином спектрофотометре характерны для данного прибора. Существенным для спектрофотометра является возможность непрерывной регистрации спектра, разрешающая способность.
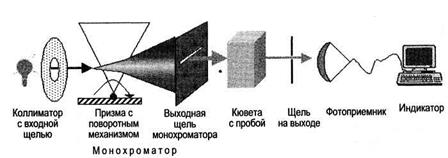
Рис. 9.2. Основные компоненты спектрофотометра.
Основные элементы спектрофотометра представлены на рис. 9.2. Свет пропускается через монохроматор, чтобы обеспечить выбор желательной области спектра, которую нужно использовать для измениий. Щели нужны, чтобы выделить узкий луч света и, тем самым, улучшить цветную чистоту. Свет затем проходит через поглощающую ячейку (кювету), где часть излучательной энергии поглощается, в зависимости от природы и концентрации раствора. Непоглощенный свет попадает на фотоприемник (фотоэлемент, фотоумножитель, фотодиод и др.), преобразующий энергию излучения в электрический сингнал, величина которого может быть зарегистрирована измерительным устройством и выведена на стрелочный или цифровой индикатор.
Таким образом, в фотометрах и спектрофотометрах происходит селекция светового сигнала, отражающего концентрацию субстрата или активность фермента в пробе.
СПЕКТРАЛЬНЫЙ АНАЛИЗ
Линейчатые спектры играют особо важную роль, так как их структура прямо связана со строением атома. Эти спектры создаются атомами, не испытывающими внешних воздействий.
Главное свойство линейчатых спектров состоит в том, что длины волн (или частоты) линейчатого спектра вещества зависят только от свойств атомов этого вещества и не зависят от способа возбуждения свечения атомов. Атомы любого химического элемента дают спектр, не похожий на спектры всех других элементов: они способны излучать строго определенный набор длин волн.
На этом основан спектральный анализ — метод определения химического состава вещества по его спектру. С помощью спектрального анализа можно обнаружить данный элемент в составе сложного вещества, если даже его масса не превышает 10 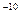 М. Это очень чувствительный метод. Изучают спектры с помощью спектрометров.
М. Это очень чувствительный метод. Изучают спектры с помощью спектрометров.
Количественный анализ состава вещества по его спектру затруднен, так как яркость спектральных линий зависит не только от массы вещества, но и от способа возбуждения свечения. Так, при низких температурах многие спектральные линии вообще не появляются. Однако при соблюдении стандартных условий возбуждения свечения можно проводить и количественный спектральный анализ.
В настоящее время определены спектры всех атомов и составлены таблицы спектров. Благодаря сравнительной простоте и универсальности спектральный анализ является основным методом анализа состава сложных, главным образом органических смесей. Спектральный анализ получил широкое распространение в токсикологии, криминалистической медицине, при исследовании микроэлементов в тканях и жидкостях организма.
ЭМИССИОННАЯ СПЕКТРОСКОПИЯ
Неповторимость спектров атомов позволяет изучать состав веществ методом эмиссионной спектроскопии. Этот метод заключается в энергетическом возбуждении атомов и наблюдении спектров их излучения с помощью спектрометров (приборов для определения длин волн излучения). Для испарения и возбуждения атомов, содержащихся в твердых телах, очень эффективными средствами являются электрические разряды — электродуговые и электроискровые. Когда в электрическую дугу вводят какое-либо вещество, составляющие его элементы под действием высокой температуры (3000-8000 °К) испаряются в плазму дуги и определяют спектр излучения плазмы.
Для определения легковозбудимых элементов используют возбуждение в пламени газовой горелки, а в качестве измерительного устройства служит фотометр.
Разработанные специально для этих целей приборы называются пламенными фотометрами.
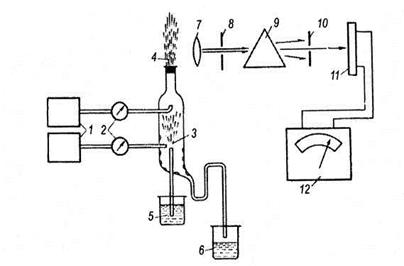
Рис. 6.49. Принципиальная схема пламенного фотометра.
1 — Цилиндры с топливом и воздухом или кислородом; 2 - клапаны, регулирующие давление, и устройства для измерения расхода газов; 3 — распылительная камера; 4 — горелка; 5 — исследуемый раствор; 6 — устройство для осушения распылительной камеры; 7 — фокусирующая линза; 8 — входная щель монохроматора (устройства для разделения сложного спектра на отдельные спектральные линии), 9 — призма, разделяющая свет по длине волны; 10 — выходная щель монохроматора; 11 — фотодетектор; регистрирующее устройство.
Пламя особенно удобно использовать для возбуждения металлов, обладающих низким потенциалом ионизации (то есть щелочных металлов). Процедура ввода образца сравнительно проста — растворы можно вводить в пламя в виде аэрозолей. Типичное устройство прибора для эмиссионной фотометрии пламени показано на рис. 6.39.
ЛЮМИНЕСЦЕНЦИЯ И ФЛУОРИСЦЕНЦИЯ
Излучение света молекулами — люминесценция — может происходить при передаче энергии им в различных процессах:
• воздействие потоком электронов (катодными лучами) — катодолюминесценция;
• тепловой нагрев — термолюминесценция;
• химические реакции — хемилюминесценция;
• воздействие электрическим током — электролюминесценция;
• ультразвуковое воздействие — сонолюминесценция;
• воздействие механическим трением — триболюминесценция;
• облучение ионизирующей радиацией — радиолюминесценция;
• облучение ультрафиолетовым и видимым светом — фотолюминесценция или флуоресценция.
Таким образом, флуоресценция является частным случаем люминесценции, когда вторичное свечение объекта вызвано возбуждением световой волной. Возбуждение происходит при большей энергии, к) есть при меньшей длине волны, чем вторичное свечение. Поэтому при флуоресценции длина волны свечения больше, чем длина волны возбуждения. Процесс флуоресценции можно представить выражением:
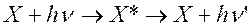 ,
,
где Х и X* стационарное и возбужденное состояние молекулы, 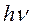 и
и 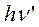 — квант возбуждающего и вторично излученного света.
— квант возбуждающего и вторично излученного света.
По характеру свечения различают фосфоресценцию — свечение, продолжающееся относительно долго после прекращения воздействия, и флуоресценцию — свечение, происходящее только во время воздействия.
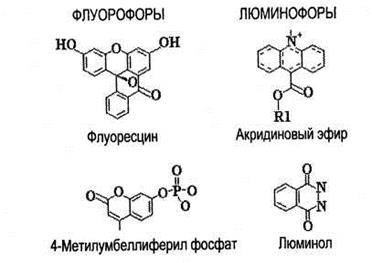
Рис. 6.40. Молекулярная структура 2 флуорофоров и 2 люминофоров, применяемых в клинической химии.
Явление флуоресценции (или флюоресценции) получило свое название от природного минерала — флюорита  , у которого оно впервые наблюдалось. Веществами, способными к свечению — флуорофорами — являются такие биологические соединения как триптофан, тирозин, фенилаланин, нуклеотиды (НАДН, НАДФ-Н), флавины, порфирины, хлорофиллы, каротиноиды, некоторые витамины, окисленные липиды, белки и другие. В качестве меток при проведении флуоресцентного и люминесцентного анализа часто используются флуорофоры и люминофоры, представленные на рис. 6.40.
, у которого оно впервые наблюдалось. Веществами, способными к свечению — флуорофорами — являются такие биологические соединения как триптофан, тирозин, фенилаланин, нуклеотиды (НАДН, НАДФ-Н), флавины, порфирины, хлорофиллы, каротиноиды, некоторые витамины, окисленные липиды, белки и другие. В качестве меток при проведении флуоресцентного и люминесцентного анализа часто используются флуорофоры и люминофоры, представленные на рис. 6.40.
Рис. 6.41. иллюстрирует явление флуоресценции.
На рис. 6.42. показаны схемы наблюдения флуоресценции. Для фотометрических исследований флуоресценции применяют специализированные фотометры — флуориметры, у которых выходная щель из кюветы смонтирована под углом к проходящему свету, согласно принципу, изображенному на рис. 6.42.
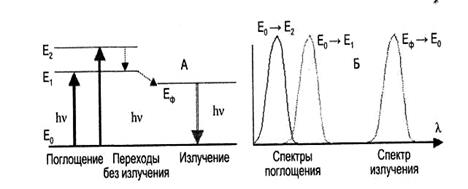
Рис. 6.41. Энергетические переходы в молекулах при флуоресценции.
А — электронные переходы, соответствующие поглощению света ( и ), безизлучателъным переходам на нижний возбужденный уровень и излучению ; Б — Спектральные кривые поглощения и флуоресценции в случае двух возбужденных уровней в молекуле. Излучение происходит с одного Е уровня.
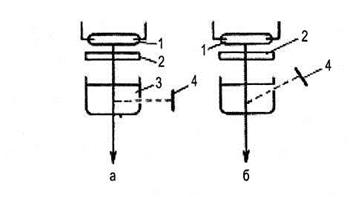
Рис. 6.42. Схемы наблюдения флуоресценции.
1 — ртутная лампа; 2 — светофильтр; 3 — кювета с раствором исследуемого вещества; 4 — приемник излучения, а — приемник принимает только флуоресцентное излучение. Такое расположение используется во многих фотометрах, б — такая схема применяется только для сильно флуоресцирующих растворов.
Часто флуориметры объединены в один прибор с фотометрами, так как блок облучения кюветы и система электронной регистрации у них одинаковые.
В люминометрах характерной особенностью является отсутствие источника света, свечение образца индуцируется химической реакцией (хемилюминометры) или любым другим способом передачи энергии веществу.
В клинической химии достаточно часто встает вопрос о выборе технологии для определения той или иной группы аналитов. Например, определение гормонов можно проводить методами фотометрирования, в том числе турбидиметрией и нефелометрией или ИФА-анализом, можно воспользоваться технологиями, основанными на использовании флюоресцентной или люминесцентной метки. Основным недостатком фотометрических методов является относительно узкий линейный диапазон измерения результатов. Даже лучшие фотометры позволяют регистрировать изменения аналитов (гормонов) не более чем в пределах 4 десятичных порядков. Флюоресцентные и люминесцентные технологии увеличивают линейный диапазон до 6—8 десятичных порядков, то есть позволяют работать без разведения. В таблице 6.6 представлены сравнительные данные о чувствительности фотометрических, флуоресцентных и люминесцентных методов определения гормонов (и других аналитов). Флуоресцентные и люминесцентные технологии позволяют существенно увеличить чувствительность определения веществ в биопробах, однако они используются, как правило, в закрытых технологиях, включающих прибор-реактивы-калибраторы-контрольные материалы и т. д.
Лекция №7
Дата добавления: 2016-08-08; просмотров: 5066;
