Внепродуктивные органы репродуктивной системы
Как отмечалось выше, к церебральным структурам, составляющим элементы репродуктивной системы, относятся аркуатные ядра гипоталамуса (у человека) и гонадотропные клетки аденогипофиза.
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
Гипоталамус — относительно небольшая область в основании мозга, расположенная над гипофизом и несколько сзади него (рис. 1.2). Границей гипоталамуса служит гипоталамическая бороздка, отделяющая его от таламуса и проходящая в вертикальной проекции непосредственно позади мамиллярных тел. Гипоталамус симметрично делится на левую и правую половины полостью — 3-м желудочком, содержащим цереброспинальную жидкость и расположенным по средней линии таким образом, что гипоталамус образует его потолок и латеральные стенки.
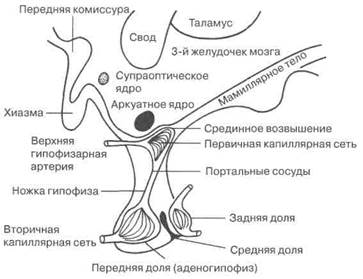
Рис. 1.2. Структура гипоталамуса и гипофиза
Несмотря на малые размеры, гипоталамус — крайне сложная структура с многообразными функциями, в число которых входят регуляция полового поведения, контроль за температурой тела, течением вегетососудистых реакций и многие другие. Каждая из этих функций ассоциирована преимущественно с одним или несколькими зонами гипоталамуса.
В гипоталамусе имеются структуры различного типа: клеточные тела гипоталамических нейронов с их аксонами и терминалями; аксоны и терминали других нейронов, клеточные тела которых лежат вне гипоталамуса; проходящие через гипоталамус аксоны экстраги-
1.2. Внепродуктивные органы репродуктивной системы
поталамических нейронов, а также глиальные клетки, выполняющие роль опорных элементов для нейронов. Клеточные тела гипота-ламических нейронов располагаются не диффузно среди глиальных клеток, а образуют группы или так называемые ядра гипоталамуса. Подобных ядер в гипоталамусе много, однако к репродуктивной функции имеют отношение только некоторые из них.
Гипоталамус тесно связан со многими областями мозга, в особенности со стволом мозга, ретикулярными структурами и такими областями лимбического переднего мозга, как миндалина (амигда-ла) и перегородка (септум).
Доказано наличие нейронной связи между сетчаткой глаза и супрахиазматическими ядрами. Именно этим путем гипоталамус получает информацию о световых циклах, которые оказывают влияние на состояние репродуктивной системы. От тел клеток гипотала-мических ядер аксоны направляются к другим ядрам гипоталамуса, различным отделам мозга, срединному возвышению, задней доле гипофиза. Такие проекции создают сложную сеть межнейронных связей и обеспечивают взаимодействие между нервными и эндокринными регулирующими центрами.
Отдельно следует остановиться на роли срединного возвышения, где происходит перекрест нервных и гуморальных сигналов, которые регулируют многообразные функции аденогипофиза. Структурно срединное возвышение представляет собой переход от основания гипоталамуса в ножку гипофиза. В срединном возвышении нервных клеток немного, но содержится значительное количество терминалей как гипоталамических, так и экстрагипоталами-ческих нейронов, глиальные клетки и специализированные клетки эпиндимы, называемые таницитами, которые выстилают дно 3-го желудочка и участвуют в переносе информации от спинномозговой жидкости к гипофизу. Гипоталамо-гипофизарные структуры репродуктивной системы имеют своеобразную сосудистую систему, получившую название гипоталамо-гипофизарной портальной системы. Первое капиллярное сплетение этой системы находится в срединном возвышении, откуда сосуды по ножке гипофиза направляются к аденогипофизу где образуют второе капиллярное сплетение (см. рис. 1.2). Основная часть крови, поступающей в аденогипофиз, идет из этой портальной системы, а это означает, что кровь, идущая к аденогипофизу, контактирует с внеклеточной жидкостью в капиллярном сплетении срединного возвышения, богатого терминалями
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
гипоталамических нейронов. Таким путем осуществляется передача информации от гипоталамуса к гипофизу. Однако кроме основного направления кровотока вниз по ножке гипофиза небольшой объем крови все же может поступать вверх по ножке гипофиза, обеспечивая прямую сосудистую связь аденогипофиза с гипоталамусом. Особенности анатомо-морфологического строения гипоталамуса, его близость к гипофизу делают гипоталамус высокоспециализированной структурой, связывающей центральную нервную и эндокринную системы. По существу, он подобен сложному коммутатору, преобразующему нервные сигналы в эндокринные.
В гипоталамусе присутствуют два типа эндокринных нейронов — крупноклеточные и мелкоклеточные. По своему строению эндокринные нейроны сходны с обычными: они имеют клеточное тело, дендриты, аксон с терминальным расширением и способны генерировать потенциалы действия. Их активность регулируется посредством нейромедиаторов, выделяемых нейронами в синапсах, лежащих на поверхности эндокринных нейронов. Большая часть гипоталамических нейронов выделяет нейромедиаторы не в область синапсов, а непосредственно в кровоток. Тела крупноклеточных нейронов находятся в супраоптическом и паравентрикулярных ядрах, а их аксоны идут к срединному возвышению, вниз по ножке гипофиза к терминалям в задней доле гипофиза. Эти нейроны синтезируют и секретируют гормоны задней доли гипофиза — оксито-цин и вазопрессин.
Тела мелкоклеточных нейронов образуют скопления во многих гипоталамических ядрах, а аксоны обычно заканчиваются в срединном возвышении. Мелкоклеточные эндокринные нейроны синтезируют нейрогормоны, которые стимулируют или ингибиру-ют выделение соответствующих гормонов передней доли гипофиза. Эти стимулирующие или ингибирующие нейрогормоны выделяются нервными терминалями срединного возвышения. Отсюда они проникают в капилляры гипоталамо-гипофизарной портальной системы, далее переносятся в сосудистое сплетение, окружающее ножку гипофиза, и распределяются по всей его передней доле.
Расшифровка структуры и синтез гипоталамических гормонов были начаты в 1970-е гг. независимыми группами исследователей, возглавляемыми Gu11lemin и Schally. В результате этих работ из ткани гипоталамуса животных был выделен в чистом виде, а затем получен путем химического синтеза нейрогормон, стимулирующий про-
1 2 Внепродуктивные органы репродуктивной системы
дукцию обоих гонадотропинов — ЛГ и ФСГ; он получил название гонадолиберина (ГЛ). Однако до настоящего времени обсуждается возможность существования других раздельных гипоталамических нейрогормонов, регулирующих продукцию гонадотропинов. Это получило отражение в эволюции термина «гонадолиберин»: прежние названия этого гормона — лютропин-рилизинг гормон и люлибе-рин — подчеркивали его избирательное действие на секрецию ЛГ.
Этот нейрогормон, регулирующий синтез и секрецию ФСГ и ЛГ, представляет собой декапептид [(пиро)Глу—Гис—Трп—Сер— Тир—Глии—Лей—Apг—Про—Глии—NH2], секретируемый из нейронов гипоталамуса в портальные сосуды. При введении ГЛ или его синтетического аналога человеку или животному возрастает секреция гонадотропинов. Напротив, если действие ГЛ нейтрализуется гормоноспецифическими антителами, секреция гонадотропинов уменьшается.
С помощью высокочувствительных радиоиммунологических и иммуноцитохимических методов была определена локализация в гипоталамусе нейронов, клеточные тела которых содержали ГЛ. Эти нейроны выявлены в медиобазальном отделе гипоталамуса (ар-куатные ядра), переднем гипоталамусе и преоптической области гипоталамуса. Аксоны нейронов этих областей гипоталамуса проецируются на срединное возвышение, где их терминали находятся в тесной связи с петлями портальных сосудов палисадной зоны; это позволяет думать, что нейросекреция ГЛ происходит именно здесь.
Имеются данные о видовых различиях в локализации зон гипоталамуса, специфически связанных с функцией репродуктивной системы. Эксперименты на Масаса rhesus (вид обезьян, близкий к человеку) показали, что у этого вида приматов специфические ГЛ-нейроны локализованы в основном в аркуатной области гипоталамуса. При избирательном разрушении этого отдела отмечалось падение уровня гонадотропинов в крови, сходное с тем, какое имело место у животных, пассивно иммунизированных к ГЛ, либо подвергнутых операции перерезки ножки гипофиза. В то же время разрушение медиобазальной области гипоталамуса при условии сохранения аркуатных ядер не меняло ритм секреции ГЛ [130, 149].
Согласно работе М. Ferin и соавт. [91], обнаружены нисходящие в ножку гипофиза аксоны ГЛ-нейронов. Эти наблюдения подкрепляются данными о значительной концентрации гормона в заднем
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
гипофизе обезьян. Обнаруженные факты дают основание предположить, что в нормальных физиологических условиях ГЛ может достигать переднего гипофиза не только по основным портальным сосудам, но также и по коротким сосудам, связывающим задний и передний гипофиз. Существует две гипотезы относительно транспорта ГЛ из синтезирующих ГЛ-нейронов к портальной системе срединного возвышения. Согласно первой, транспорт нейрогормона идет по аксонам, т.е. оба процесса — синтез и транспорт — происходят в одной и той же клетке. Согласно второй, аксоны некоторых ГЛ-нейронов проецируются своими терминалями на границу гипоталамуса и 3-го желудочка. По этому пути гипоталамические гормоны попадают в 3-й желудочек и переносятся со спинномозговой жидкостью в область срединного возвышения. Там их захватывают специфические клетки — танициты, отростки которых проходят через срединное возвышение к терминалям, расположенным вблизи портальных сосудов. Тем самым танициты служат промежуточным транспортным звеном между спинномозговой жидкостью и портальными сосудами. Хотя обе точки зрения не исключают друг друга, большая часть данных свидетельствует в пользу «аксонной» гипотезы.
Существует представление о двойном механизме гипоталами-ческой регуляции тропных функций гипофиза — стимулирующем и блокирующем. Однако до настоящего времени не удалось показать наличие нейрогормона, ингибирующего секрецию гонадо-тропинов.
Яркой иллюстрацией двойного механизма гипоталамической регуляции тропных функций служит контроль секреции одного из тропных гормонов гипофиза, участвующих в реализации генеративной функции, а именно пролактина (ПРЛ). Известно, что секрецию ПРЛ стимулирует тиролиберин, основная функция которого заключается в активации продукции тиреотропного гормона (тиротропи-на). Ингибитором секреции ПРЛ служит дофамин (ДА) — катехо-ламин, предшественник синтеза адреналина и норадреналина (НА).
Нейроны, содержащие ДА (дофаминергические нейроны (ДА-нейроны)), обнаружены в нескольких областях мозга, особенно в среднем мозге. Одна группа этих нейронов лежит в арку-атных ядрах и подобно ГЛ-нейронам проецируется непосредственно на палисадную зону срединного возвышения. Здесь терминали ДА-нейронов контактируют с портальными сосудами, благодаря
1.2. Внепродуктивные органы репродуктивной системы
чему ДА поступает в портальную кровь. В аденогипофизе ДА взаимодействует с лактотрофами, регулируя синтез и секрецию ПРЛ. Следует заметить, что ДА не только регулирует секрецию ПРЛ, но и является одним из нейромедиаторов ЦНС.
Гипофиз взрослого человека имеет массу около 500 мг, размеры 1,5 х 1,0 см и яйцевидную форму. Он лежит в гипофизарной ямке сфе-ноидной кости. Гипофиз покрыт круглой складкой твердой оболочки мозга и диафрагмой седла, которая имеет небольшое центральное отверстие. Через это отверстие проходит гипофизарная ножка, или инфундибулум. Гипофиз имеет богатое кровоснабжение, осуществляемое сосудами задних и нижних гипофизарных ветвей внутренней каротидной артерии. Венозная система представлена короткими сосудами, которые проходят над поверхностью железы. Гипофиз состоит из трех долей. Задняя доля гипофиза (нейрогипофиз) является производным эктодермы и непосредственно связана со срединным возвышением гипоталамуса посредством аксонов, проходящих через ножку гипофиза. Средняя доля гипофиза — небольшой отдел, лежащий между задней и передней долей гипофиза.
Передняя доля гипофиза (аденогипофиз) включает дистальную, промежуточную и туберальную части. Аденогипофиз, в отличие от задней доли, не имеет прямых нейронных связей с гипоталамусом. Передняя доля гипофиза содержит различные типы клеток, среди них гонадотрофы (базофильные клетки), секретирующие Л Г и ФСГ, и лактотрофы (ацидофильные клетки), секретирующие ПРЛ. Кроме трех гормонов, связанных с репродуктивной функцией (ЛГ, ФСГ, ПРЛ), аденогипофиз вырабатывает гормон роста (соматотропный гормон — СТГ) в соматотрофах, адренокортикотропный гормон (АКТГ) в кортикотрофах и тиреотропный гормон (ТТГ) в тирео-трофах. Как правило, синтез и секреция каждого тропного гормона осуществляются специализированным типом клеток. Исключение составляют клетки, продуцирующие гонадотропины. По мнению большинства исследователей, синтез обоих гонадотропинов происходит в клетках одного типа — гонадотрофах. Однако некоторые авторы считают, что отдельные гонадотрофы специализируются на синтезе только одного гонадотропина. Задняя доля гипофиза се-кретирует два пептидных гормона: вазопрессин (или антидиуретический гормон) и окситоцин.
Гонадотропины (ЛГ и ФСГ) — это гликопротеины, состоящие из двух пептидных цепей: а- и в-субъединиц. Альфа-цепи обеих
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
гонадотропинов практически идентичны; в-цепи различаются, что обеспечивает биологическую специфику их действия. В аминокислотной последовательности гонадотропных гормонов имеются видовые различия.
Рассмотрим основные принципы работы центральных гипота-ламо-гипофизарных структур репродуктивной системы.
При изучении секреции гонадотропинов у животных и человека путем взятия частых проб крови был обнаружен пульсирующий характер секреции с интервалом между отдельными импульсами около часа.
Импульсный характер секреции ЛГ у обезьян был идентифицирован в 1970 г. группой ученых под руководством Е. Knobil, а в 1971 г. группой Nankin и Тгоеп у здоровых мужчин. Пульсирующая секреция гонадотропинов у здоровых женщин была позднее описана Yen и соавт., Santen и Bardin [83].
В настоящее время пульсирующий характер секреции гипота-ламических факторов, стимулирующих выброс соответствующих тропных гормонов, показан практически для всех основных гормонов гипофиза. Установлено подобие природы гипоталамической регуляции тропных функций гипофиза. Об этом свидетельствует сходство характера секреции гонадотропинов и других тропных гормонов аденогипофиза [53].
При общем типе секреции тропных гормонов каждый из них имеет свои индивидуальные параметры пульсации. Наиболее высокочастотной является секреция гонадотропных гормонов, наименее частотной — секреция ТТГ и СТГ. К высокоамплитудной секреции следует отнести выброс гонадотропинов и АКТГ. Секреция ТТГ наиболее низкоамплитудная.
Частота импульсов секреции гормона роста у практически здоровых женщин составляет в среднем 1 импульс в течение 4 ч, амплитуда — 30 нг/мл. Импульсы секреции СТГ хорошо выражены в состоянии покоя, однако проявления жизненной повседневной активности женщины, такие как прием пищи, физические упражнения, стресс и сон, могут оказывать модулирующее действие на характер секреторного профиля гормона роста. Суточный ритм секреции СТГ так же, как и амплитуда его импульсов, и его дневной уровень зависят от уровня эстрадиола (Э2).
Общепризнанно, что на дневной профиль секреции гормона роста влияет как характер секреции его либерина, так и секреция со-
1.2. Внепродуктивные органы репродуктивной системы
матостатина. Возможно, что корреляция суточного ритма секреции этого тропного гормона с уровнем Э2 свидетельствует о действии последнего на нейроэндокринные механизмы регуляции сомато-тропина.
Секреция ПРЛ, как и большинства гормонов аденогипофиза, характеризуется наличием циркадианного ритма [91]. Более того, как и другие гормоны передней доли гипофиза, ПРЛ секретируется в импульсном режиме. Профиль изменения содержания в крови ПРЛ в течение суток показывает отчетливое увеличение его концентрации в ночное время. После пробуждения концентрация ПРЛ начинает снижаться.
Существует множество физиологических состояний, которые связаны с увеличением содержания ПРЛ в крови, например: прием пищи, физическая активность, стресс, коитус, беременность, кормление грудью и т.д. Циркадианный ритм секреции ПРЛ исчезает в течение беременности, когда уровень его повышен.
В 1970-е гг. в экспериментах на обезьянах был показан пульсирующий характер секреции ГЛ в портальную кровь ножки гипофиза [63]. В дальнейшем была разработана методика, при которой частично сохраняется гипофизарная функция; она позволила продемонстрировать синхронность импульсной секреции гонадотропинов и ГЛ [71]. В импульсном режиме секретируется в кровоток аденогипо-физом и ПРЛ. Однако частота импульсной секреции ПРЛ отличается от таковой гонадотропинов. При исследовании образцов крови, полученных с 15-минутными интервалами, показано, что за 6-часовой период проходит только 1 или 2 импульса секреции ПРЛ [53, 65].
Для секреции большинства гормонов гипофиза, в том числе ПРЛ, характерен циркадианный ритм. Уровень ПРЛ в периферической крови в течение суток испытывает четкое периодическое изменение: повышение в ночное время и последующее снижение. Было показано, что ночной подъем уровня гормона связан со сном. Представляет интерес наблюдение, что ритм секреции ПРЛ отличается в популяциях различных географических регионов. Так, у жительниц Японии отмечен более высокий уровень секреции гормона в зимний и весенний периоды в сравнении с жительницами Северной Америки [101]. Показано, что при ряде физиологических состояний (например, принятии пищи, мышечном напряжении, стрессе, половом акте, беременности, послеродовом периоде) уровень ПРЛ в крови возрастает. Циркадианный ритм секреции гормона исчезает
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
при значительном увеличении его секреции, например при беременности или развитии пролактиномы [153, 187].
Внимание разных исследователей привлек вопрос, что же является источником (генератором) пульсирующей секреции этих гормонов и какова локализация этого источника. Следующие факты свидетельствуют в пользу того, что генератор импульсной секреции гонадотропинов находится в гипоталамусе:
1) эпизодический выброс гонадолиберина в портальную кровь у нескольких видов животных и человека;
2) пульсирующая нейронная активность специфических зон гипоталамуса, сопровождающаяся выбросами ЛГ;
3) восстановление секреции гонадотропинов посредством экзогенного введения ГЛ при разрушениях специфических зон гипоталамуса, падение концентрации ЛГ в плазме при прекращении введения ГЛ в импульсном режиме [63, 83, 165].
Нейронная природа генератора импульсной секреции гормонов вызывает необходимость остановиться на двух проблемах:
1. Каковы нейронные механизмы генерации импульсных сигналов?
2. Каким образом аденогипофиз реализует импульсный гипо-таламический сигнал?
Опираясь на изложенное выше, следует рассмотреть организацию нейронной сети гипоталамического генератора — аркуатного осциллятора. Современный уровень исследований пока не позволяет получить окончательную информацию о структуре нейронных образований, продуцирующих ГЛ. Однако в литературе последних лет активно обсуждаются гипотетические представления о строении и принципах функционирования клеточных элементов, составляющих эти образования. Согласно современным представлениям, гипоталамический генератор пульсирующей секреции ГЛ представляет собой кольцевую структуру, объединяющую много сотен нейронов разных типов и функционирующую как замкнутая цепь. Это иллюстрируют рис. 1.3 и 1.4.
Генератор ритма секреции ГЛ — аркуатный осциллятор — расположен внутри гипоталамуса. Его функционирование обеспечивается синхронизацией активности отдельных нейронов, входящих в кольцевую структуру. Это нейроны различной природы, причем для импульсной секреции ГЛ необходимо участие нейромедиаторов, продуцируемых данными нейронами.
| 1.2. Внепродуктивные органы репродуктивной системы |
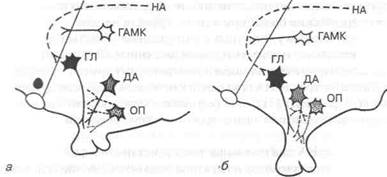
Рис. 1.3. Схема туберо-инфундибулярных дофаминергических (ДА),
В-эндорфиновых (ОП), у-аминомасляных (ГАМК), гонадолибериновых
(ГЛ) нейронов и их норадренергических (НА) афферентных путей у
грызунов (а) и приматов (б)
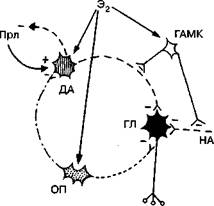
Рис. 1.4. Схема гипоталамической петли, представляющая собой генератор импульсной секреции гонадолиберина:
ПРЛ — пролактин; ГЛ — гонадолиберин; НА — норадреналин; ДА — дофамин; ГАМК— у-аминомасляная кислота; ОП — опиоиды; Э2 — эстрадиол
Основными нейромедиаторами, включенными в механизм секреции ГЛ, являются катехоламины [83,93,112,129]. Изучена стимулирующая роль НА в этом процессе. Так, а-адренергические блока-торы, вводимые овариэктомированным обезьянам, подавляли пуль-
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
сирующую секрецию гонадотропинов. В противоположность этому в-адренергические блокаторы такого эффекта не давали [83]. Действия а-блокаторов у животных с разрушенной областью аркуатных ядер гипоталамуса и заместительным введением ГЛ не наблюдалось [ 129]. В экспериментах на овариэктомированных крысах избирательное снижение уровня НА приводило к исчезновению пульсирующего режима секреции ЛГ [ 112]. Эти результаты позволяют считать, что НА является необходимым медиатором в системе регуляции секреции ГЛ[93, 112].
Наряду с НА значительная роль в механизме функционирования гипоталамического генератора отводится ДА, являющемуся пролактинингибирующим фактором (ПИФ). Было показано его блокирующее действие и на секрецию гонадотропинов [96]. Высказывалось предположение, что этот эффект реализуется на уровне синапсов между ДА-нейронами и нейронами, продуцирующими ГЛ. Более вероятно предположение о действии ДА на уровне аксонов срединного возвышения.
Кроме НА и ДА в регуляции секреции ГЛ участвуют еще несколько нейромедиаторов. Так, серотонин и гормон эпифиза мела-тонин способны ингибировать выброс гонадотропинов, в то время как у-аминомасляная кислота (ГАМК) и ацетилхолин оказывают противоположный эффект [148, 178].
Особую роль в регуляции секреции ГЛ отводят классу малых пептидов с морфиноподобной активностью — эндорфинам. Число доказательств их участия в этом процессе постоянно увеличивается.
Тот факт, что морфин и в-эндорфин стимулируют выброс ПРЛ только у интактных обезьян, но не вызывают аналогичного эффекта у животных с перерезанной ножкой гипофиза, позволяет предположить, что действие этих биологически активных веществ локализовано в гипоталамусе [181].
Такое предположение подтверждается наличием рецепторов эн-дорфинов в ДА-нейронах, способностью эндорфинов блокировать выброс ДА в портальную кровь, влиянием морфина на электрофизиологическую активность области локализации гипоталамического возбуждения импульсов секреции ГЛ [93, 114]. В исследованиях с применением блокатора опиатных рецепторов — налоксона — было продемонстрировано влияние эндорфинов на секрецию гонадотропинов. Результаты этих исследований позволяют предположить, что эндогенные опиатные пептиды могут снижать секрецию ГЛ путем
1.2. Внепродуктивные органы репродуктивной системы
непосредственного воздействия на соответствующие нейроны или опосредованного подавления активности катехоламинергических нейронов [93, 178].
Обсуждение роли нейромедиаторов в регуляции гипоталамо-гипофизарной активности было бы неполным без упоминания об участии в этом процессе особого класса соединений — катехолэ-строгенов. Известно, что ткань гипоталамуса содержит фермент, способный вводить ОН-группу во 2-е положение молекулы Э2. Образующееся соединение по своему строению обладает сходством со структурой как эстрогена, так и катехоламина. В результате сходства структур возникает конкуренция между катехоламинами и кате-холэстрогенами за основной фермент метаболизма катехолами-нов — катехол-ортометилтрансферазу. При этом катехолэстрогены обнаруживают большее сродство к ферменту, чем катехоламины. В качестве предпочтительного субстрата катехолэстрогены эффективно взаимодействуют с этим ферментом и в результате замедляют метаболизм катехоламинов. Вызывая временное увеличение содержания катехоламинов в гипоталамусе, катехолэстрогены могут изменить активность продукции ГЛ и тем самым модулировать уровень секреции гонадотропинов.
Имеются указания на прямо противоположный эффект кате-холэстрогенов — снижение уровня катехоламинов в гипоталамусе. Предполагается, что данный эффект обусловлен ингибирующим воздействием катехолэстрогенов на тирозингидроксилазу — ключевой фермент синтеза катехоламинов. Биологическая активность катехолэстрогенов не сводится только к упомянутым выше эффектам. Эти соединения могут непосредственно взаимодействовать с рецепторами как катехоламинов, так и эстрогенов, имитируя эти соединения [93, 181]. Такие уникальные структурные особенности катехолэстрогенов позволяют рассматривать их в качестве своеобразной буферной системы, модулирующей функциональную активность гипоталамуса.
Участие множества нейротрансмиттеров ЦНС и нейрогормонов гипоталамуса в регуляции различных эндокринных функций объясняется, по-видимому, не их полифункциональностью, а многообразными коммутационными связями между различными нервными центрами [94].
Подводя итог изложению данных о структуре и механизме функционирования гипоталамического генератора импульсов ГЛ
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
(аркуатного осциллятора), следует сказать, что стимуляция импульсов секреции ГЛ осуществляется специализированными структурами, образующими замкнутую цепь. Взаимодействие элементов этой цепи обеспечивает импульсную секрецию нейрогормона. В то же время характер импульсной секреции ГЛ может меняться под воздействием сигналов, поступающих из других структур мозга, что обусловлено особенностями строения нейронов. Основные нейроны мозга получают около 1000 афферентных нервных терминалей и посылают примерно такое же количество отростков к периферии. Лишь часть этих контактов замыкается внутри упомянутой выше цепи. Остальные осуществляют связь с другими гипоталамически-ми структурами, используя для синаптической передачи различные нейромедиаторы.
Согласно современным представлениям, кольцевая структура характерна не только для гипоталамического генератора секреции ГЛ, но и для других специфических регуляторных центров гипоталамуса [103].
Предполагается, что наличие межнейронных внутригипотала-мических контактов определяет возможность взаимовлияния гипо-таламических ядер. В результате резкая активация одного из гипо-таламических центров регуляции тропных функций аденогипофиза должна повлечь за собой изменение функционального состояния соседних центров.
Примером взаимовлияния гипоталамических центров регуляции тропных функций гипофиза может служить хорошо известное в клинической практике наличие реципрокной зависимости между адренокортикотропной и гонадотропной, тиреотропной и гонадо-тропной, гонадотропной и соматотропной функциями.
В 1979 г. Е. Knobil предложил модель нейроэндокринной регуляции менструального цикла. В основу модели положено представление о том, что аркуатные ядра медиобазального гипоталамуса генерируют специфический сигнал приблизительно с часовым интервалом (цирхоральный ритм), вызывая выброс ГЛ в гипофизар-ную портальную систему. Эта гипоталамическая структура получила название уже упоминавшегося аркуатного осциллятора. Часовые импульсы ГЛ стимулируют гонадотрофы к импульсам секреции ЛГ и ФСГ, которые в свою очередь вызывают морфологические и секреторные изменения в гонадах (яичниках). При этом Е. Knobil считал, что Э2 способен изменять гонадотропную реакцию на режим вы-
1.2. Внепродуктивные органы репродуктивной системы
броса ГЛ через систему обратных связей исключительно на уровне переднего гипофиза [83].
Правильность этой модели была подтверждена несколькими экспериментальными ситуациями: восстановлением нормального менструального цикла у обезьян с разрушенной медиобазаль-ной областью гипоталамуса или перерезкой ножки гипофиза при импульсном почасовом введении ГЛ [137, 158], индукцией нормального менструального цикла, включая созревание фолликулов, повышение концентрации гонадотропинов, овуляцию и наличие лютеиновой фазы у пациенток с гипогонадотропной аменореей при постоянном терапевтическом введении препарата ГЛ в импульсном почасовом режиме [105, 124].
Для расшифровки механизма цикличности функционирования репродуктивной системы необходимо располагать экспериментальными доказательствами того, что в течение менструального цикла импульсный характер секреции ГЛ меняется и овариальные стероиды действуют на секрецию гипоталамического ГЛ.
Начиная с 1970-х гг. накопилось достаточное количество экспериментальных и клинических данных, полученных на приматах и человеке, свидетельствующих о различиях в частоте и амплитуде импульсной секреции гонадотропинов при различных физиологических состояниях (в ходе менструального цикла) и при ряде патологий репродуктивной системы. Так, было продемонстрировано, что базальная секреция гонадотропинов различается по частоте и амплитуде у субъектов с наличием и отсутствием гонад. Частота и амплитуда импульсов ЛГ изменяется в соответствии с фазой менструального цикла. Во время ранней фолликулиновой фазы цикла частота импульсов ЛГ достаточно высока и сохраняется в такой форме в течение всей фолликулиновой фазы до преовуляторного периода, когда выброс гормона становится высокочастотным и высокоамплитудным. После овуляции и образования желтого тела частота импульсов ЛГ быстро уменьшается (примерно вдвое по сравнению с ранней фолликулиновой фазой). Величина амплитуды в лютеиновую фазу удваивается по сравнению с таковой в раннюю фолликулиновую фазу [91, 103, ПО].
Для ПРЛ, как и для гонадотропинов, показано изменение ритма секреции в менструальном цикле и при ряде физиологических и патологических состояний. Увеличение уровня гормона во время сна сопровождается увеличением амплитуды импульса секреции.
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
Уровень ПРЛ в циркуляции имеет тенденцию к увеличению в середине менструального цикла. Это происходит не за счет увеличения частоты импульсов секреции, а связано с возрастанием амплитуды каждого импульса [103].
Пульсирующий ритм секреции ПРЛ обнаружен и у овариэк-томированных женщин. У пациенток с гиперпролактинемией при нарушении циркадианного ритма секреции ПРЛ пульсирующий характер секреции гормона сохраняется [187].
Показано, что введение ГЛ вызывает усиление секреции ПРЛ. Однако у пациенток с гипоталамической гипогонадотропной аменореей при отсутствии эндогенного импульсного ритма секреции ГЛ сохраняется физиологический режим импульсной секреции ПРЛ. Это наблюдение наглядно продемонстрировало диссоциацию между импульсной секрецией ГЛ, синхронно меняющей секрецию гонадо-тропинов, и секрецией ПРЛ [103].
Механизмы, индуцирующие пульсирующую секрецию ПРЛ, до сегодняшнего дня неясны. Известно стимулирующее действие тиреолиберина и ингибирующее влияние ДА на этот процесс, что отмечалось выше.
Способность генерировать импульсы обычно связывается с нейронной активностью. Однако возможна и внутренняя способность эндокринных клеток к этому процессу. Путем перфузирования индивидуальных гипофизов удалось продемонстрировать пульсирующей выброс ПРЛ с интервалами между импульсами 8 мин [95]. Эти факты дают основание предположить наличие внутриклеточного механизма синхронизации секреции гормона, вероятно, в основном паракринной природы. Кроме того, следует обратить внимание на то, что импульсная секреция ПРЛ редка и, в противоположность хорошо известным нарушениям импульсного ритма секреции гонадо-тропинов, режим секреции при патофизиологических ситуациях не изменяется. По-видимому, характер секреции ПРЛ не играет определяющей роли в функционировании репродуктивной системы.
Ряд исследователей в эксперименте и в клинике убедительно продемонстрировали возможность изменения характера импульсной секреции гонадотропинов при действии овариальных стероидов.
В экспериментах Е. Knobil на овариэктомированных обезьянах, секреция гонадотропинов у которых характеризуется высокой частотой и большой амплитудой, введение прогестерона приводило к снижению частоты импульсов, а действие Э2 уменьшало их
1 2 Внепродуктивные органы репродуктивной системы
амплитуду [84]. Десятикратное уменьшение амплитуды импульсов ЛГ у овариэктомированных обезьян (т.е. возвращение к характеру секреции гормона в раннюю фолликулиновую фазу) при введении Э было получено в экспериментах М. Ferin и соавт. [91]. Введение прогестерона в фолликулиновую фазу цикла у женщин вызывало замедление частоты импульсов секреции ЛГ и увеличение их амплитуды [172].
Таким образом, влияние половых гормонов на харакгер пульсирующей секреции гонадотропинов, отражающей ритм поступления гипоталамического импульса, не вызывает сомнений. Предметом обсуждений является вопрос о локализации действия гормонов яичника и физиологическом смысле развивающихся при этом событий.
Локализация действия овариальных стероидов остается под вопросом до сих пор.
Исследования группы Knobil [83] дали доказательства преимущественного действия половых гормонов на уровне аденогипофиза.
В экспериментах на Масаса rhesus, подвергшихся разрушению медиобазальной области гипоталамуса или перерезке ножки гипофиза, секреция гонадотропинов восстанавливалась экзогенным введением ГЛ в импульсном режиме. Введение Э2 животным, у которых гипофиз был изолирован от влияния гипоталамуса, вызывало уменьшение импульсной секреции ЛГ [149, 158]. Аналогичное действие Э2 на гипофиз было обнаружено у интактных обезьян, у которых систематическое введение гормона угнетало повышение уровня ЛГ в крови, наблюдаемое после инфузии ГЛ [94]. Тот факт, что подобное явление было также обнаружено in vitro, подтверждает вывод, что указанный эффект является результатом прямого действия Э2 на аденогипофиз.
У обезьян с разрушенными аркуатными ядрами и интактным гипофизом и яичниками введение ГЛ в импульсном режиме приводило к появлению нормального овуляторного цикла [93]. Это дало основание авторам предположить, что гипоталамический фактор играет только Стимулирующую роль в контроле гонадотропной секреции, так что изменение уровня секреции гонадотропинов половыми гормонами за счет обратной связи осуществляется на уровне гипофиза, вызывая динамические изменения режима гонадотропной секреции, наблюдаемые в менструальном цикле. Эстрадиол осуществляет модифицирующее гонадотропную секрецию действие на уровне гонадотрофов гипофиза. Действительно, авторадиографиче-
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
скими исследованиями было продемонстрировано наличие эстро-генных рецепторов (ЭР) в аденогипофизе [48, 93].
Механизм включения системы положительной и отрицательной обратной связи и регуляция цикличности функционирования репродуктивной системы будут подробно рассмотрены в последующих главах.
Положение о том, что гипоталамус в регуляции функции репродуктивной системы осуществляет необходимую, но лишь активирующую роль, основывается на данных экспериментов, где гипотала-мическое влияние устраняется путем разрушения медиобазальной области гипоталамуса или аркуатных ядер гипоталамуса, перерезкой ножки гипофиза, помещением непроницаемого барьера между гипоталамусом и гипофизом (по месту перерезки ножки гипофиза).
Необходимо отметить, что при интерпретации перечисленных данных было высказано сомнение относительно полноты изоляции гипофиза в этих исследованиях.
В экспериментах на обезьянах при использовании тефлонового барьера по месту перерезки ножки гипофиза и заместительной гормональной терапии (ЗГТ) препаратом ГЛ, вводимого в импульсном режиме, была восстановлена секреция гонадотропинов и достигнут предовуляторный уровень Э2 в циркуляции. Однако в данном эксперименте, в противоположность аналогичным экспериментам с использованием силастикового барьера, не были воспроизведены предовуляторный пик секреции гонадотропинов и овуляция [94], что позволило предположить проницаемость силастикового барьера для гонадолиберина [94]. Эти эксперименты ставят под сомнение абсолютизацию гипофиза в качестве избирательного места приложения модулирующего действия половых гормонов.
Возможно, для предовуляторного подъема гонадотропинов необходим резкий выброс ГЛ. Это предположение подтверждается демонстрацией внезапного падения концентрации рецепторов ГЛ, которое совпадает с предовуляторным подъемом гонадотропинов [94]. Имеются доказательства и предовуляторного подъема ГЛ [93]. Последний был недавно продемонстрирован в периферической крови женщин [124]. Резкий выброс ГЛ может вызывать и столь же быстрое уменьшение концентрации рецепторов гормона, наблюдаемое в середине цикла [93]. Перечисленные данные заставляют усомниться в той пассивной роли, которая отводилась гипоталамусу рядом исследователей.
1 2. Внепродуктивные органы репродуктивной системы
Косвенным доказательством приложения модулирующего действия половых гормонов на уровне гипоталамуса являются факты обнаружения рецепторов Э2 и прогестерона в медиобазальной области гипоталамуса [43, 48].
В экспериментах группы Ferin [91] на обезьянах при однократном введении меченого Э2 с помощью вживленных канюль в специфические чувствительные точки медиобазальной области гипоталамуса, некоторые точки мамиллярного комплекса и пери-форниальные ядра обычно выявлялось снижение уровня ЛГ, аналогичное наблюдаемому при внутривенном введении Э2. Отсутствие реакции при таком же введении Э2 в точки, смежные со специфически чувствительными, или в другие зоны гипоталамуса является, во-первых, доказательством того, что именно специфические для регуляции системы зоны гипоталамуса являются местом локализации действия гонадальных стероидов, а во-вторых — отсутствия диффузии стероидов при их локальном введении.
При использовании метода одновременного определения ГЛ в жидкости 3-го желудочка и ЛГ в периферической крови у обезьян (Масаса rhesus) была продемонстрирована синхронность их секреции. Импульсы секреции ГЛ, определяемые в портальной крови, были выше, чем в жидкости 3-го желудочка [178].
Сравнение характера секреции ГЛ у обезьян в ранней фоллику-линовой фазе и у овариэктомированных обезьян до и после хронического введения Э2 показало, что овариэктомированные обезьяны имеют более высокий уровень гормона в портальной крови и в цереброспинальной жидкости, при этом амплитуда импульсов секреции гормона у них выше. Постоянное введение Э2 вызывает снижение амплитуды импульсов у обезьян в фолликулиновой фазе цикла, у овариэктомированных обезьян частота импульсов при этом не меняется.
Таким образом, Э2 ингибирует секрецию гонадотропинов, подавляя секрецию ГЛ гипоталамусом. Действие эстрогенов осуществляется на уровне гипофиза или гипоталамуса в зависимости от эндокринной ситуации при конкретном физиологическом состоянии организма.
Относительно прогестерона существует более четкое представление о включении гормона в модуляцию формы гипоталамическо-го сигнала на уровне гипоталамуса [91].
Пульсирующий режим поступления гипоталамического сигнала к гипофизу, усиление этих сигналов передним гипофизом и
| Глава 1. Структура и функция репродуктивной системы в возрастном аспекте |
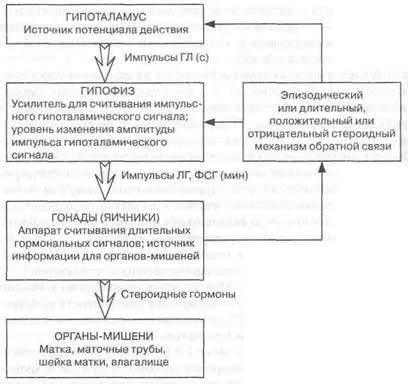
Рис. 1.5. Соподчинение и функциональная роль структурных элементов репродуктивной системы
перевод их в более длительные гормональные сигналы обеспечивают высокоэффективный метод трансляции нейронной активности мозга (гипоталамуса) в эндокринные сигналы. Пульсирующая форма гипоталамического сигнала богата информацией, которая дает возможность отделить истинные сигналы от шумов. Для передачи информации в сигнале может быть использовано несколько его параметров (амплитуда, частота, межимпульсный период, форма импульса).
Анатомо-морфологические и физиологические особенности структурных элементов репродуктивной системы позволяют построить схему их соподчинения и функциональных ролей (рис. 1.5).
1 з Репродуктивные органы репродуктивной системы
Дата добавления: 2016-07-09; просмотров: 934;
