МОНОКАРБИД УРАНА, КАРБИДНОЕ ТОПЛИВО
Физические свойства. Кристаллографические параметры урана установлены с высокой степенью точности. Однако некоторые физические и физико-металлургические свойства затрудняют применение металлического урана из-за фазовых превращений в трех аллотропических модификациях и их анизотропии. Тремя аллотропическими фазами и структурами являются α-фаза с орторомбической структурой, от комнатной температуры до 666 °С; b-фаза с тетрагональной структурой, 666-771 °С; γ -фаза с обьемноцентрированной кубической структурой, 771-1130 °С. Структура каждой ячейки аналогична структуре искаженной гексагональной плотноупакованной решетки.
КЕРАМИЧЕСКИЕ УРАНОВЫЕ СОЕДИНЕНИЯ
Керамические топлива (керамики) — твердые неорганические неметаллические материалы с высокой температурой плавления. Межатомные связи в керамиках преимущественно ионные или ковалентные. Поэтому керамику можно использовать при высоких температурах. Керамические урановые соединения, применяемые в качестве ядерных топлив, могут входить в системы уран—кислород, уран—углерод и уран—азот. В системе уран—кислород наинизший оксид UO образуется в виде тонкой пленки на поверхности металлического урана при кратковременных выдержках на воздухе. Диоксид урана UO2 может существовать в виде соединений, состав которых может изменяться в широких пределах в зависимости от температуры и окружающей среды.
МОНОКАРБИД УРАНА, КАРБИДНОЕ ТОПЛИВО
Существуют три карбида урана: UC, U2Сз, UC2, которые можно рассматривать как карбидное топливо. Среди них наибольший интерес представляет монокарбид урана UC. По сравнению с металлическим урановым топливом и оксидным урановым топливом, которые используются в настоящее время, UC часто считается идеальным потенциальным топливом для ядерных реакторов деления.
КОРРОЗИЯ
Уран химически активен и реагирует при комнатной температуре с воздухом, кислородом, водородом, водой, парами воды и другими реагентами. При взаимодействии с водой U образует стабильный оксид UO2, а при взаимодействии с водородом — гидрид урана UHз. Скорость взаимодействия между ураном и водородом при температурах, представляющих практический интерес, значительно выше скорости взаимодействия между ураном и водой. Если на поверхности урана образуется защитная пленка UO2, то имеет место один тип коррозии урана в воде, а если не образуется, то другой. По мере увеличения толщины пленка UO2 может растрескиваться, отслаиваться и обнажать свежую поверхность U. На рис. 18.1 показаны различные кривые коррозии U в аэрированной дистиллированной воде.
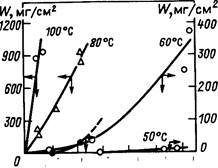
Рис. 18.1. Коррозия U в деаэрированной дистиллированной воде: зависимость потери массы W образца от времени испытания t
Когда защитная пленка не разрушается, экспериментальные кривые, полученные при температурах 50—70 0С, свидетельствуют о низкой скорости коррозии в течение длительных периодов времени. Растрескивание и разрушение пленки UO2 сопровождается повышением скорости коррозии. При температурах 80 и 100 °С защитная пленка образуется слабо и коррозия образцов происходит с постоянными скоростями.
В насыщенной водородом или обезгаженной воде коррозия при умеренных температурах протекает линейно со временем (в течение длительных периодов времени).
На рис. 18.2 представлены скорости коррозии при различных температурах.
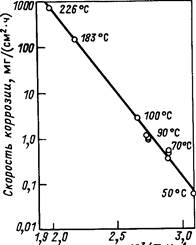
Рис. 18.2. Скорость коррозии U в насыщенной водородом воде
Основной механизм коррозии связывается в большинстве случаев с гидридной реакцией. Эта химическая реакция играет существенную роль в увеличении общей скорости коррозии (оксидной и гидридной), когда продукт оксидной коррозии защищает металлическую поверхность от доступа воды. Водород, образующийся в процессе коррозии в воде, может диффундировать через продукт оксидной коррозии и приводить к быстрому взаимодействию водорода с ураном. В результате образования гидрида UH3 скорость коррозии увеличивается.
Существуют три основных класса урановых сплавов, которые по-видимому, могут образовывать и сохранять защитную окисную пленку при таких высоких температурах, как 3500С. К этим сплавам относятся: 1) сплавы со структурой метастабильной γ-фазы;2) пересыщенные α-фазные сплавы и 3) интерметаллические соединения. Экспериментальные данные показывают, что скорости коррозии этих сплавов, например сплава U с 3% по массе молибдена или интерметаллических соединений UAl2, UAl3 и UAl4 , приемлемы в отношении эксплуатации твэлов в реакторах. Однако, как правило, скорость коррозии U и его сплавов увеличивается с ростом температуры, интенсивность облучения (радиационная коррозия) и времени пребывания в реакторной среде.
Керамические урановые топлива значительно более стойки к коррозии, чем металлические топлива. Такие соединения, как UO2 и U3S могут оказывать большое сопротивление коррозии. Из опыта эксплуатации известно, что UO2 стабилен в воде и паре легководных и тяжеловодных водных реакторов при температурах вплоть до 320 °С. Он корродирует на воздухе и в окислительном теплоносителе (в случае разгерметизации оболочки) при высоких температурах (выше 320 ° С) и интенсивном облучении. Монокарбид урана обладает плохой коррозионной стойкостью в воде, паре или содержащем кислород теплоносителе при относительно низких температурах (выше 55 С). Скоро коррозии UN очень сильно зависит от стехиометрии. Присутствие свободного урана или U2N3 отрицательно сказывается на коррозионной стойкости. В воде или паре при температурах около 100 ° С защитная пленка, которая образуется на поверхности UN, постепенно теряется по мере увеличения ее толщины и растрескивания. Такое коррозионное поведение аналогично наблюдаемому на поверхности метталического топлива.
Ссилицид урана U3 Si имеет высокую коррозионную стойкость. Сопротивление коррозии сульфида урана US и фосфида урана UP, по-видимому, сравнимо с сопротивлением коррозии силицида урана U3Si. Эти керамические топлива относительно стабильны на воздухе (100 — 200 °С), в воде (315 °С) и в паре (чуть ниже 3150С).
В данной химической и физической среде скорость коррозии керамических урановых топлив в общем случае зависит от температуры, интенсивности облучения и времени работы системы.
ПЛУТОНИЙ
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ
Хотя нуклид 239Ри и содержится в урановой руде (урановой смолке или ураните), его концентрация в руде не превышает 10-11. Поэтому плутоний следует рассматривать как искусственный нуклид, получаемый при облучении нейтронами в ядерном реакторе природного или обедненного урана. В результате реакций, происходящих в реакторах-наработчиках и энергетических реакторах, образуются высшие нуклиды плутония:
238U(n,γ) 239U (b--23,5 мин )——— 239Np(b--2,33 сут) ___239Pu
239Pu(n,γ) 240Pu(n,γ) 241Pu(n,γ) и т.д.
Плутоний, извлеченный из тепловыделяющих элементов, подверженных кратковременному облучению, почти полностью состоит из нуклида 239Pu. При более длительном облучении этот нуклид поглощает нейтроны и постепенно превращается в более или менее стабильные нуклиды с массовыми числами до 246.
Анализ физических, ядерных и термомеханических свойств аллотропного плутония, который меняет фазу 6 раз (от α, b, γ,d,h, до ε) в узком интервале температур (от комнатной температуры до точки плавления 640 °С), показывает, что плутоний в металлической форме нельзя использовать в чистом виде как топливо для быстрых реакторов. Кроме того, плутоний представляет собой сильно концентрированный делящийся материал, который должен быть разбавлен сырьевыми нуклидами перед его применением в бридерах и энергетических реакторах. По этой причине в настоящее время изучаются, испытываются и облучаются в ядерных реакторах сплавы металлического плутония и его керамические соединения
КЕРАМИЧЕСКИЕ СОЕДИНЕНИЯ ПЛУТОНИЯ
К керамическим соединениям плутония главным образом относятся оксидные, карбидные и нитридные плутониевые системы. При этом диоксид плутония РиО2 , монокарбид плутония РиС и нитрид плутония PuN в смеси с UO2 , UC и UN соответственно рассматриваются как перспективные виды топлива для быстрых энергетических реакторов. Другими словами, соединения плутония на основе РиО2 -UО2, PuC-UC и PuN-UN или (U,Pu)О2,(U, Pu)C и (U Pu)N являются перспективными типами топлива для жидкометаллических реакторов на быстрых нейтронах. Смешанное оксидное топливо (U, Pu) О2, разработанное, например, для экспериментального реактора на быстрых нейтронах (FFTF) или проектируемого быстрого энергетического реактора. Основаниями для такого выбора являются:
1) значительный опыт и отработанная технология для фабрикации твэлов из оксидного топлива; 2) хорошая изученность термических и радиационных характеристик оксидного топлива; 3) положительный опыт использования оксидного топлива в реакторах и эксплуатации оборудования. Единственным недостатком оксидного топлива является относительно низкий коэффициент воспроизводства и как следствие большие времена удвоения (около 15 лет).
Поэтому на последующих стадиях освоения быстрых реакторов представляется целесообразным использование топлива на основе смешанных карбидов и нитридов из-за лучших ядерно-физических и теплофизических свойств этих топлив по сравнению с оксидным топливом. Кроме того, карбидное и нитридное топливо имеют более высокую плотность делящихся нуклидов, чем оксидное топливо, и, следовательно, более короткие времена удвоения и больший коэффициент воспроизводства.
КОРРОЗИОННЫЕ ЭФФЕКТЫ
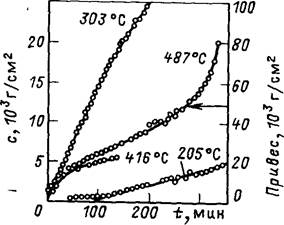
Окисная коррозия металлического плутония. Оказывается, что металлический плутоний химически более активен и более подвержен коррозионному износу, чем металлический уран при той же температуре. Он медленно окисляется в сухом воздухе при температуре 50 °С и образует защитную пленку из РиО, как и в случае с ураном, на котором при окислении образуется пленка UO. Во влажной атмосфере окисная пленка образуется быстро, а затем трескается и разрушается. При этом скорость коррозии увеличивается до предельного значения 1 мг/см2 за 1000 ч. На рис. 18.3 приведена временная зависимость скорости коррозии, получаемой как привес на 1 см2 образца за время пребывания плутония на воздухе при температуре в диапазоне 200-500 °С. При температуре приблизительно 480 °С наблюдается пирофорное воспламенение металлического плутония (в виде порошка).
Соединения РиО, Ри2О3 и РиО2 могут находиться в топливе одновременно. Кристаллическая структура РиО может быть стабилизирована присутствием в растворе изоморфных соединений РиС или PuN. Действительно, СО2 в контакте с металлическим плутонием может разлагаться в СО или C2, которые образуют РиС при наличии избытка металлического плутония. Плутоний медленно реагирует с азотом при температуре выше 250 °С с образованием нитрида PuN. Аналогично плутоний взаимодействует с водородом с образованием гидридов плутония РиН2 и РиН3 при температуре выше 200 °С. Эти два гидрида плутония могут существовать в твердом растворе одновременно.
|
Рис. 18.3. Окисление нелегированного плутония в воздухе
при высоких температурах.
Водная коррозия, как и атмосферная, о которой шла речь выше, влечет за собой диффузию оксидов, карбидов, нитридов в контакте с водой при повышении температуры.
Представляет особый интерес снижение коррозии плутония при его нагревании в области фазового перехода из b- в γ-фазу. Оксиды, образующиеся в стабильной d-фазе при температуре около 416 °С, также обладают пониженной скоростью коррозии по сравнению с α-фазой при температуре 50—75 °С.
Окисная коррозия смешанного керамического уран-плутониевого топлива. Рассматривается окисная коррозия смешанного керамического уран-плутониевого топлива (U,Pu)О2, (U,Pu)C и (U,Pu). Известно, что кислород, водяной пар, СО2, N2 и Н2 взаимодействуют со смешанным уран-плутониевым оксидным, карбидным и нитридным топливом при определенных условиях. Усовершенствованное топливо на основе (U, Ри)О2 обладает лучшим сопротивлением процессам коррозии и окисления в воде и кислороде по сравнению с (U, Pu)C и (U, Pu)N.
Лабораторное изготовление образцов усовершенствованного карбидного (U, Pu)C и нитридного (U, Pu)N топлив обычно производится в защитной среде. Изготовление, обращение с топливом и хранение усовершенствованного топлива, например (U, Pu)C, проводится в боксах с защитной аппаратурой из очищенного аргона или гелия, а для (U, Pu)N — в вакуумных камерах в атмосфере чистого аргона и азота.
Для разработки усовершенствованного топлива необходимо всестороннее изучение коррозии, в условиях которой смешанное карбидное и нитридное топливо взаимодействует с атмосферой или защитным газом, содержащих нормальную или повышенную концентрацию кислорода и водяного пара. Подобное изучение может дать важную информацию и оценку воздействия коррозии или окисления на свойства топливных материалов. Особый интерес при изучении коррозии и окисления представляют концентрация кислорода и водяного пара в защитном газе; концентрация кислорода в топливе; скорость внесения примесей в защитном газе; размеры частиц; удельная поверхность в процессах дробления и спекания топливного материала в чистой защитной среде;
скорости коррозии и окисления топливных материалов.
В экспериментальной работе использовались дифференциальные сканирующие калориметры для контроля за температурой образцов, а также для измерения теплоты реакции нескольких типов образцов топлива из (U, Pu)C в потоке защитного газа. Содержание воздуха в защитном газе находилось в пределах от 0,19% (4-10-4 О2) до 100% (20% О2) ]. Нагревание образцов проводилось с помощью калориметра со скоростью 10 °С в минуту от 25 до 600 °С. Смесь защитного газа состояла из высокочистого аргона, гелия и воздуха, содержащего меньше 10-2 % водяного пара. Смешивающий трубопровод для защитного газа предназначался для подачи либо 100% инертного газа, либо смеси воздуха с инертным газом, в которой количество воздуха колебалось от 0,19 до 100%. При этом предусмотрена возможность полного изменения состава защитного газа в камере калориметра за время от 5 с до 10 мин.
Изучение экспериментальных данных при окислении образцов топлива из (U, Pu)C или (U, Pu)N позволяет сделать следующие выводы.
1. Образцы топливных таблеток из карбида (U, Pu)C высокой плотности, нагретые до температуры выше температуры окружающего бокса, могут вызывать изменение концентрации кислорода в защитном газе.
2. Топливные таблетки с низкой плотностью, нагретые до 175 °С перед началом прокаливания образца, могут вызвать изменения защитного газа.
3. Мелкий порошок (U, Pu)C, типичный материал, используемый при фабрикации таблеток с высокой плотностью, нагретый до температуры выше 250 °С, может вызвать вспышку экзотермического и быстрого окисления при температуре окружающего бокса аналогично тому, как это происходит с UC и UN в атмосфере кислорода
ТОРИЙ
В отличие от уранового топлива торий не является делящимся материалом. Природный торий (по существу это чистый 232Th) является воспроизводящим материалом. Действительно, торий рассматривается как высокоэффективный воспроизводящий материал в уран-ториевом топливном цикле.
232Th(n,γ)----- 233U (b--23,3 мин )——— 235Pa(b--27,3 сут) ___233U
Торий-232, поглощая тепловые нейтроны в ядерном реакторе, превращается в 233Th, который через два b--распада переходит в Ра и затем в 233U. Искусственный изотоп урана 233U, производимый в уран-ториевом цикле, - делящийся, так же как и 235Pa, получаемый в уран-плутониевом топливном цикле или топливном цикле с рециркуляцией плутония.
Уран-плутониевый топливный цикл разработан и реализован в энергетических ядерных реакторах. Разработка технологии и реализация уран-ториевого топливного цикла, однако, затрудняется присутствием
232U, дочерние продукты распада которого являются сильнымиγ -излучателями. С точки зрения ядерных, физических, теплофизических и механических свойств торий можно использовать в качестве воспроизводящего материала или материала бланкета в тепловых и быстрых реакторах. Металлический торий стабилен при комнатной температуре и не взаимодействует с водой до 100 °С. Торий имеет хорошие металлургические характеристики, высокую термическую и радиационную стабильность при эксплуатации в реакторе. При рециркуляции уран-ториевого топлива, облученного в тепловых или быстрых реакторах, в нем накапливаются продукты радиоактивного распада 232U, являющиеся эмиттерами γ -излучения. Увеличение радиоактивного излучения может осложнить обращение с топливом, процессы переработки выгоревшего топлива и рефабрикации топливных элементов. Основные свойства тория как топлива ядерных реакторов похожи на аналогичные характеристики урана и плутония. Металлический торий имеет FCC-кристаллическую структуру при комнатной температуре и ВСС-кристаллическую структуру при температуре 1450 °С. Его фазовые модификации относительно стабильны. Торий имеет более высокую теплопроводность и более низкий коэффициент термического расширения. Оба эти фактора приводят к меньшим термическим и механическим напряжениям и деформациям ториевого топлива в работающем реакторе. Свежий металлический торий имеет серебристо-белый цвет, но после пребывания на воздухе становится темно-серым. Торий имеет плотность свинца и твердость меди. Плотность тория значительно меньше плотности урана и плутония.
Дата добавления: 2016-06-02; просмотров: 2505;
