Производство и применение антибиотиков.
Можно считать, что клиническая биотехнология зародилась с начала промышленного производства пенициллина в 40-х годах ХХ века и его использования в терапии. Применение этого природного пенициллина повлияло на снижение заболеваемости и смертности больше, чем какого-либо другого препарата, но, с другой стороны, поставило ряд новых проблем, которые удалось решить опять таки с помощью биотехнологии.
Во-первых, успешное применение пенициллина вызвало большую потребность в этом лекарственном препарате, и для ее удовлетворения нужно было резко повысить выход пенициллина при его производстве.
Во-вторых, первый пенициллин действовал главным образом на грамположительные бактерии, а нужно было получить антибиотики с более широким спектром действия, поражающие и грамотрицательные бактерии.
В-третьих, поскольку антибиотики вызывают аллергические реакции, необходимо было иметь целый набор антибактериальных средств, с тем чтобы можно было выбрать из равноэффективных препаратов такой, который не вызывал бы у больных аллергию.
В-четвертых, пенициллин нестабилен в кислой среде желудка и его нельзя назначать для приема внутрь.
Наконец, многие бактерии приобретают устойчивость к антибиотикам. Классический пример тому – образование стафилококками фермента пенициллиназы, который образует фармакологически неактивную пенициллоиновую кислоту.
Антибиотики продуцируются плесневыми грибами, актиноми-цетами, эубактериями и другими микроорганизмами. Некоторые из них способны продуцировать большое количество антибиотиков. Тем не менее, большинство известных в настоящее время высокопродуктивных штаммов продуцентов антибиотиков получено традиционными методами мутагенеза и селекции. Так, увеличить выход пенициллина при его производстве удалось в основном благодаря последовательному использованию серии мутантов исходного штамма Penicillium chrysogenum, а также путем изменения условий выращивания.
Биосинтез антибиотиков, как и любых других вторичных метаболитов, возрастает в фазе замедленного роста клеточной популяции (конец трофофазы) и достигает максимума в стационарной фазе (идиофазе). Считают, что в конце трофофазы изменяется энзи-матический статус клеток, появляются индукторы вторичного метаболизма, освобождающие гены вторичного метаболизма из-под влияния катаболитной репрессии. Поэтому любые механизмы, тормозящие клеточную пролиферацию и активный рост, стрессовые ситуации, активируют процесс образования антибиотиков.
Процесс культивирования продуцентов антибиотиков проходит две фазы (двухступенчатое культивирование). На первой фазе происходит накопление достаточного количества биомассы, которая выращивается на среде для роста микроорганизма. Эта фаза должна быть быстрой, а питательная среда дешевой. На второй фазе осуществляются запуск и активный синтез антибиотика. На этой фазе ферментацию ведут на продуктивной среде. Образование антибиотика контролируется условиями культивирования микроорганизмов. Поэтому оптимизация питательной среды является главным фактором в повышении выхода продукта.
К настоящему времени выделены антибиотики, эффективные в отношении грамотрицательных бактерий: стрептомицин, цефалоспорин. Получено также множество полусинтетических антибиотиков с новыми свойствами: с широким спектром действия, чувствительностью к пенициллиназе и содержимому желудочно-кишечного тракта. Так, ампициллин является полусинтетическим производным бензилпенициллина, отличающимся наличием добавочной аминогруппы в боковой цепи (рис. 5). Он активен при пероральном введении и действует на широкий круг бактерий, в том числе на некоторые грамотрицательные, вызывающие заболевания органов дыхания, пищеварения и выделения.
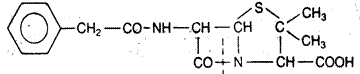 |
Бензилпенициллин
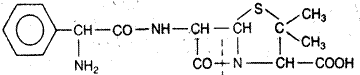 |
Ампициллин
Рис. 5. Структурные формулы антибиотиков.
Устойчив к кислоте и клоксациллин, и к тому же он не разрушается β-лактамазами. Его часто назначают вместе с ампициллином тем больным, у которых обнаружены стафилококки, синтезирующие пенициллиназу.
Дата добавления: 2016-06-02; просмотров: 1469;
