Распределение Максвелла
Как известно, молекулы газа совершают беспрерывное хаотическое движение, испытывая столкновения друг с другом. При столкновениях молекул изменяются как величина, так и направление их скоростей. Ввиду хаотичности движения молекул и их столкновений следует, что в газе возможны молекулы с любыми значениями скорости как по величине, так и по направлению. В результате в газе возникает некоторое распределение молекул по скоростям движения. Это распределение можно характеризовать непрерывной функцией.
Впервые задачу нахождения такой функции для идеального газа решил Максвелл, и эта функция получила название распределения молекул по скоростям Максвелла.
Остановимся на основных этапах вывода распределения Максвелла. Пусть в некотором объеме в стационарном равновесном состоянии находится идеальный газ, состоящий из одинаковых молекул с массой т. Температура газа одинакова во всех точках объема. Предположим, что на молекулы газa не действуют какие-либо внешние силовые поля. Молекулы газа могут взаимодействовать друг с другом только путем упругих соударений. При этих условиях, очевидно, молекулы будут равномерно распределены по всему объему, и плотность газа ρ будет одинакова в любой точке объема. Обозначим абсолютную величину скорости хаотического движения молекулы υ.
Газ, содержащий огромное число частиц (молекул), является системой, подчиненной статистическим закономерностям.
Вероятность dw того, что значение скорости молекулы будет находиться в интервале от υдо υ + dυ, где dυ— элементарное изменение скорости, будет
dw = f(υ)dυ, (18.1)
где f (υ) — плотность вероятности. Из (18.1) вытекает, что
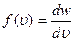 (18.2)
(18.2)
определяет вероятность обладания молекулой скоростью υи в единичном интервале скоростей, т. е. по существу является функцией распределения молекул по скоростям. Действительно, если газ содержит N молекул, то, зная f(υ), а, следовательно, и dw, можно найти число молекул dN газа, обладающих скоростями, в заданном интервале от υдо υ + dυ:
dN = Ndw = Nf(υ)dυ. (18.3)
Наряду с распределением молекул по величине скорости υ, можно ввести также функцию распределения молекул 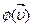 по направлению вектора скорости
по направлению вектора скорости 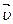 или, что тоже самое, по значениям проекции вектора скорости на оси φ(υx, υy, υz) Распределение φ(υx, υy, υz) позволяет определить число молекул dNXyZ, у которых проекции скорости соответствуют интервалам от υx до υx + dυx, от υy до υy + dυy,от υz до υz + dυz:
или, что тоже самое, по значениям проекции вектора скорости на оси φ(υx, υy, υz) Распределение φ(υx, υy, υz) позволяет определить число молекул dNXyZ, у которых проекции скорости соответствуют интервалам от υx до υx + dυx, от υy до υy + dυy,от υz до υz + dυz:
dNXYZ = Nφ(υx, υy, υz)dυxdυydυz. (18.4)
Так как движение молекул хаотично и на газ не действуют внешние силовые поля, то все направления движения молекул разновероятны, и функция распределения 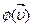 не может зависеть от направления скорости
не может зависеть от направления скорости 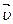 . Это означает, что φ(υx,υy,υz) зависит только от абсолютной величины скорости υ, т. е. φ(υx,υy,υz) = φ(υ). Учитывая это обстоятельство, найдем связь между функциями f(υ) и φ(υ). Очевидно, что число dN молекул со скоростями в интервале от υдо υ + dυ (18.3) можно найти также путем сложения dNxyz всех молекул с проекциями скоростей в интервалах от υx до υx + dυx, от υy до υy + dυy, от υz до υz + dυz. Тогда, с учетом (18.4) получим:
. Это означает, что φ(υx,υy,υz) зависит только от абсолютной величины скорости υ, т. е. φ(υx,υy,υz) = φ(υ). Учитывая это обстоятельство, найдем связь между функциями f(υ) и φ(υ). Очевидно, что число dN молекул со скоростями в интервале от υдо υ + dυ (18.3) можно найти также путем сложения dNxyz всех молекул с проекциями скоростей в интервалах от υx до υx + dυx, от υy до υy + dυy, от υz до υz + dυz. Тогда, с учетом (18.4) получим:
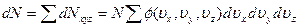 (18.5)
(18.5)
Далее, так как φ(υx,υy,υz) = φ(υ) является функцией абсолютной величины скорости υ, то выражение (18.5) представится в виде
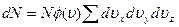 (18.6)
(18.6)
Для нахождения суммы, стоящей в качестве множителя в правой части формулы (18.6), воспользуемся графическим методом. С этой целью рассмотрим векторное пространство скоростей молекул (рис. 19.1). В этом пространстве с тремя взаимно перпендикулярными осями υx, υy,υz заданные интервалы проекций скорости 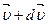 на эти оси, т. е. интервалы от υx до υx + dυx, от υy до υy + dυy, от υz до υz + dυz, изображаются в форме кубика со сторонами dυx, υy, υz (рис. 19.1, а), объем которого равен произведению dυxυyυz. Сумма же
на эти оси, т. е. интервалы от υx до υx + dυx, от υy до υy + dυy, от υz до υz + dυz, изображаются в форме кубика со сторонами dυx, υy, υz (рис. 19.1, а), объем которого равен произведению dυxυyυz. Сумма же
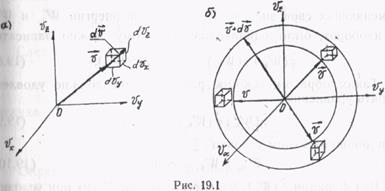
этихобъемов, стоящая в (18.6), в векторном пространстве скоростей представляется объемом шарового слоя, радиусом υ и толщиной dυ(рис. 19.1, б), который равен
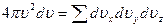 .
.
Таким образом, формула (18.6) представится в виде
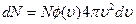 . (18.7)
. (18.7)
Сравнивая (18.3) и (18.7), получим
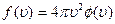 . (18.7′)
. (18.7′)
Перейдем теперь к установлению явного вида функции φ(υ).
Как уже отмечалось выше, распределение φ(υ) должно быть изотропно, т. е. функция φ(υ) зависит только от абсолютной величины скорости молекул газа.
Функция φ является также однозначной функцией кинетической энергии молекулы. Так как кинетическая энергия
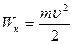 , то
, то 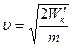
и 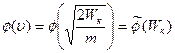 .
.
Рассмотрим столкновение двух молекул с энергиями Wк1 и Wк2. В идеальном газе столкновения абсолютно упругие, следовательно, в соответствии с законом сохранения энергии
Wк1 + Wк2 = W′к1+ W′к2,
где W′к1 и W′к2 — энергии молекул после столкновения. Число столкновений, в результате которых молекулы вместо энергий Wк1 и Wк2 приобретают энергии W′к1 и W′к2,пропорционально произведению 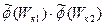 . Для того чтобы распределение было стационарным, необходимо, чтобы число молекул, изменяющих свои энергии Wк1 и Wк2 на энергии W′к1 и W′к2 и наоборот, было одинаковыми. Поэтому можно записать:
. Для того чтобы распределение было стационарным, необходимо, чтобы число молекул, изменяющих свои энергии Wк1 и Wк2 на энергии W′к1 и W′к2 и наоборот, было одинаковыми. Поэтому можно записать:
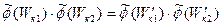 . (18.8)
. (18.8)
Таким образом, искомое распределение должно удовлетворять уравнению
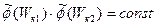 ; (18.9)
; (18.9)
при дополнительном условии
Wкl + Wк2 = const. (18.10)
Вид функции 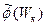 ,удовлетворяющей (18.9) при условии (18.10), легко найти
,удовлетворяющей (18.9) при условии (18.10), легко найти
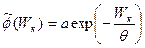 (18.11)
(18.11)
где а и θ — константы, не зависящие от υ.
Действительно, при умножении двух функций вида (18.11) показатели экспонент складываются и произведение функций 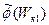 ,
, 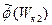 будет постоянно, если постоянная сумма энергий Wк1 + Wк2.
будет постоянно, если постоянная сумма энергий Wк1 + Wк2.
Таким образом, функции распределения по скоростям φ(υ) и f(υ) имеют вид
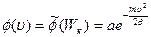 ; (18.12)
; (18.12)
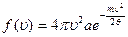 . (18.13)
. (18.13)
Для определения константы а воспользуемся свойством нормированной вероятности. Очевидно, что для молекулы вероятность иметь произвольную скорость есть вероятность достоверного события и поэтому она должна быть равна единице. Эту вероятность получим, проинтегрировав плотность f(υ) вероятности по всему интервалу изменения скорости, т. е.
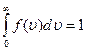 (18.14)
(18.14)
Подставляя в (18.14) функцию (18.12), получим
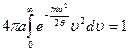
Из таблицы интегралов следует, что
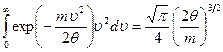 .
.
Следовательно,
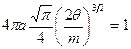
откуда
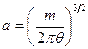 . (18.15)
. (18.15)
Определим теперь вторую постоянную θ. Для этого воспользуемся формулой (15.7) для средней кинетической энергии поступательного движения молекулы газа
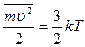 ,
,
из которой вытекает, что среднее значение квадрата скорости молекулы равно:
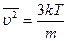 . (18.16)
. (18.16)
Сдругой стороны, согласно теории вероятностей величину υ2 можно вычислить, проинтегрировав произведение υ2f(υ) по всему интервалу изменения скорости:
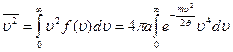 . (18.17)
. (18.17)
Из таблицы интегралов следует, что
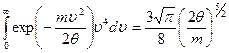 . (18.18)
. (18.18)
Следовательно, учитывая (18.16), (18.15), (18.17) и (18.18), имеем:
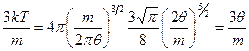 или
или 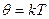 . (18.19)
. (18.19)
Итак, Максвелловское распределение молекул по скоростям (18.13) примет вид
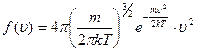 . (18.20)
. (18.20)
Распределение молекул по проекции скоростей (18.12) запишется в виде
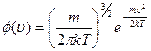 . (18.21)
. (18.21)
На рис. 19.2 представлены графики функции f(υ) при трех различных температурах. Исходя из геометрического толкования определенного интеграла и учитывая вероятностный смысл функции f(υ), приходим к выводу, что площадь, ограниченная любой из этих кривых и осью абцисс, постоянна и равна единице. Каждая кривая имеет максимум. С увеличением температуры газа максимум смещается в сторону больших скоростей, но его абсолютная величина уменьшается, так что площадь под кривой оказывается неизменной. Сама кривая при увеличении температуры становится более размытой, следовательно, при нагревании газа число молекул с более высокими скоростями увеличивается, а молекул с малыми скоростями уменьшается.
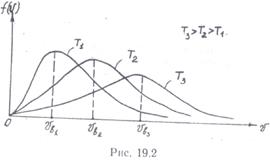
Скорость υb, соответствующая максимуму функции f(υ), называется наиболее вероятной скоростью. Для каждой температуры газа Т1, Т2, Т3 имеется своя наиболее вероятная скорость υb1, υb2, υb3 (рис. 19.2). Смысл υb очевиден — это скорость, которой при данной температуре газа обладает наибольшее число молекул. С ростом температуры υb увеличивается.
Наиболее вероятную скорость можно определить, исследовав функцию f(υ) на экстремум. Для этого нужно, продифференцировав f(υ) по переменной, приравнять производную нулю, при υ = υb:
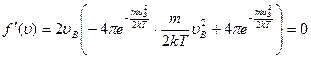
или
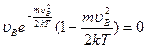 . (18.22)
. (18.22)
Выбирая корень этого уравнения, не равный нулю, имеем
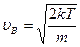 . (18.23)
. (18.23)
Закон распределения молекул по скоростям (18.20) позволяет вычислить среднее значение любой величины F(υ), зависящей от скорости молекул. Согласно теории вероятности, среднее значение или математическое ожидание функции F(υ) равно
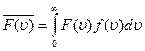 . (18.24)
. (18.24)
Отметим, что мы уже воспользовались этой формулой при определении константы θ. Найдем теперь, используя свойство распределения (18.20), значение абсолютной величины средней скорости 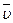
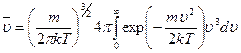 (18.25)
(18.25)
Из таблицы интегралов вытекает, что
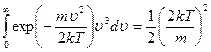 .
.
Следовательно, средняя скорость равна
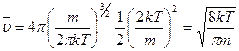 . (18.26)
. (18.26)
Важное значение в теории имеет также средняя квадратичная скорость 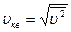 . Учитывая (18.16), имеем
. Учитывая (18.16), имеем
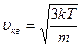 . (18.27)
. (18.27)
Таким образом, три характерных скорости 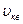 ,
, 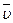 и
и 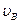 отличаются друг от друга множителями порядка единицы, причем, как видно из (18.23), (18.26) и (18.27),
отличаются друг от друга множителями порядка единицы, причем, как видно из (18.23), (18.26) и (18.27),
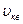 >
> 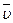 >
> 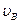
Дата добавления: 2016-05-25; просмотров: 2487;
