Барометрическая формула.
Распределение Больцмана для частиц во внешнем потенциальном поле
 Газ, на который не действует внешнее силовое поле, равномерно заполняет объем, в котором он находится, благодаря хаотичности теплового движения молекул. Если на молекулы газа действуют внешние силы, то концентрация газа не будет одинаковой во всех точках объема. Рассмотрим в качестве примера атмосферный газ, находящийся в поле земного тяготения. Если бы отсутствовало тепловое движение, то все молекулы атмосферы опустились бы на поверхность Земли под действием сил тяжести и земная атмосфера не могла бы существовать. Однако этому препятствует хаотическое движение молекул, которое способствует обратному процессу — стремлению атмосферного газа рассеяться и заполнить равномерно всю Вселенную. Следовательно, атмосфера Земли может существовать за счет этих двух факторов в некотором равновесном состоянии, при котором ее плотность, концентрация молекул и давление будут зависеть от пространственных координат.
Газ, на который не действует внешнее силовое поле, равномерно заполняет объем, в котором он находится, благодаря хаотичности теплового движения молекул. Если на молекулы газа действуют внешние силы, то концентрация газа не будет одинаковой во всех точках объема. Рассмотрим в качестве примера атмосферный газ, находящийся в поле земного тяготения. Если бы отсутствовало тепловое движение, то все молекулы атмосферы опустились бы на поверхность Земли под действием сил тяжести и земная атмосфера не могла бы существовать. Однако этому препятствует хаотическое движение молекул, которое способствует обратному процессу — стремлению атмосферного газа рассеяться и заполнить равномерно всю Вселенную. Следовательно, атмосфера Земли может существовать за счет этих двух факторов в некотором равновесном состоянии, при котором ее плотность, концентрация молекул и давление будут зависеть от пространственных координат.
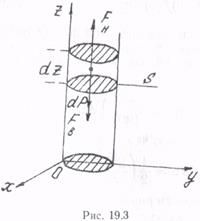
Найдем закон изменения этих величин в зависимости от высоты над поверхностью Земли. Будем считать, что газ находится в состоянии термодинамического равновесия и его температура всюду одинакова. Выделим некоторый столб газа, имеющий форму цилиндра, площадью поперечного сечения s, и направим ось z вдоль столба по направлению от поверхности Земли. Установим начало отсчета координаты z на поверхности Земли (рис. 19.3).
Выделим на высоте z элементарный слой столба газа толщиной dz и воспользуемся тем, что этот слой, как и весь столб, находится в состоянии механического равновесия. Это значит, что равнодействующая всех сил, действующих на слой, равна нулю. Из рис. 19.3 видно, что равнодействующая складывается из трех сил: две силы давления FH и FB, действующие на нижнее и верхнее основание слоя, и сила тяжести dP самого слоя. Обозначим давление газа в точках нижнего основания p, а в точках верхнего основания р+ dp. Тогда
FH = pS; FB = (p + dp)S; dP = ρgSdz,
где ρ — плотность слоя воздуха.
С учетом направления сил условие равновесия слоя запишется в виде
FB+ dP = FH(18.28)
или
(р + dp) S + ρgSdz = pS. (18.29)
Раскрыв в (18.29) скобки, получим дифференциальное уравнение
dp = —ρgdz. (18.30)
Из уравнения Клапейрона — Менделеева следует, что плотность газа связана с давлением формулой
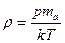 , (18.31)
, (18.31)
где та — масса молекулы газа.
Используя (18.31), преобразуем дифференциальное уравнение (18.30) к виду
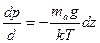 . (18.32)
. (18.32)
Интегрируя это уравнение по высоте от 0 до z, получаем
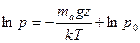 , (18.33)
, (18.33)
где ln p0 — постоянная интегрирования.
Потенциируя (18.33), имеем
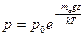 . (18.34)
. (18.34)
Из (18.34) видно, что р0 имеет смысл давления атмосферы на поверхности Земли, где z = 0.
Полученное уравнение определяет зависимость давления атмосферы вблизи Земли от высоты над уровнем моря. Как и следовало ожидать, при увеличении высоты давление уменьшается. В соответствии с формулой (18.34), которая называется барометрической, это уменьшение подчиняется экспоненциальному закону. Измеряя давление по барометру, проградуированному в соответствии с барометрической формулой, можно определить высоту объекта над поверхностью Земли. Такой прибор называется альтиметром и широко применяется в авиации.
Используя барометрическую формулу, легко установить закон распределения концентрации молекул по высоте h над поверхностью Земли. С этой целью воспользуемся уравнением состояния идеального газа p= nkT. В этой формуле давление р и концентрация молекул п зависят от высоты, в то время как температура Т постоянная в соответствии с предположением, что газ находится в состоянии термодинамического равновесия. Из уравнения состояния и барометрической формулы для концентрации п на высоте h вытекает:
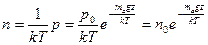 , (18.35)
, (18.35)
где n0 — концентрация молекул воздуха при h = 0.
Обратив внимание на то, что в показатель экспоненты в правой части (18.35) входит потенциальная энергия молекулы в поле силы тяжести WПОТ = magh, перепишем (18.35) в виде
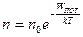 . (18.36)
. (18.36)
Оказывается, что выражение (18.36) для распределения молекул имеет общий характер и справедливо для частиц, находящихся во внешнем потенциальном поле любого вида. Это распределение называется распределением Больцмана.
В распределении Больцмана (18.36) под n0 следует понимать концентрацию молекул в точке поля, где их потенциальная энергия равна нулю, WПОТ = 0, а п представляет собой концентрацию молекул в точке, где их потенциальная энергия равна WПОТ.
Как известно, плотность газа ρ прямо пропорциональна концентрации молекул п. Поэтому, используя (18.35), нетрудно показать, что распределение плотности воздуха в атмосфере Земли будет описываться выражением:
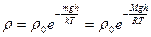 , (18.37)
, (18.37)
где М — молярная масса газа.
Из (18.34), (18.35) и (18.37) следует, что в атмосфере Земли р, п и ρ воздуха уменьшаются единообразно с увеличением высоты.
Учитывая, что концентрация п по определению равна 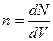 , где dN — число молекул в элементарном объеме dV, можно представить распределение Больцмана в форме
, где dN — число молекул в элементарном объеме dV, можно представить распределение Больцмана в форме
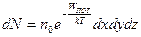 .
.
Здесь под dN следует понимать число молекул, находящихся в элементарном объеме dV = dxdydz с координатами х, у, z и обладающих произвольными скоростями.
Учтем теперь, что молекулы газа, находящегося в состоянии термодинамического равновесия, распределены по скоростям в соответствии с (18.21) (распределение Максвелла). Это значит, что для того, чтобы определить число молекул dN газа в объеме dV со скоростями, попадающими в интервал dυx, dυy, dυz, следует учесть оба распределения. Мы приходим к формуле, которая называется распределением Максвелла — Больцмана:
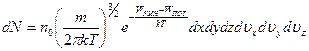 .
.
Следует отметить, что распределение Максвелла — Больцмана и сама его формулировка имеют смысл только в том случае, когда движение молекул подчиняется законам классической физики. Если движение частиц носит квантовый характер, то имеют место другие распределения, о которых пойдет речь ниже.
Дата добавления: 2016-05-25; просмотров: 2176;
