Равновесие при абсорбции. Закон Генри.
Система состоит из трёх компонентов (распределяемое вещество А и два распределяющих вещества) и двух фаз – жидкой и газовой. Такая система по правилу фаз имеет три степени свободы:  .
.
Для абсорбции переменными являются Т, Р, концентрация компонента А в газовой и жидкой фазах. Следовательно, в состоянии равновесия при Т=const и постоянном общем давлении Р зависимость между парциальным давлением газа 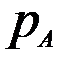 или его концентрацией и составом жидкой фазы однозначна.
или его концентрацией и составом жидкой фазы однозначна.
Эта зависимость выражается законом Генри (связана с равновесной линией): парциальное давление 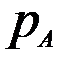 растворённого газа пропорционально его мольной доле
растворённого газа пропорционально его мольной доле 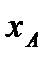 в растворе:
в растворе:
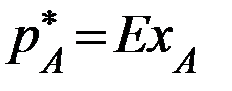 (2.1)
(2.1)
где 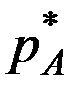 - парциальное давление поглощаемого газа над раствором, находящегося в равновесии, при концентрации раствора
- парциальное давление поглощаемого газа над раствором, находящегося в равновесии, при концентрации раствора  , Е – константа Генри. Е не зависит от общего давления в системе, но зависит от природы абсорбента и поглощаемого газа, а также от Т.
, Е – константа Генри. Е не зависит от общего давления в системе, но зависит от природы абсорбента и поглощаемого газа, а также от Т.
Растворимость газа в жидкости при данной температуре пропорционально его парциальному давлению над жидкостью:
 (2.2)
(2.2)
Здесь  - концентрация газа в растворе, равновесная с газовой фазой, в которой парциальное давление поглощаемого компонента равна
- концентрация газа в растворе, равновесная с газовой фазой, в которой парциальное давление поглощаемого компонента равна 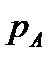 .
.
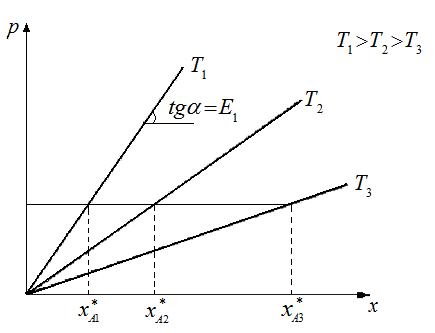
Рис.2.1 Растворимость газа в жидкость от Т.

Для идеальных растворов на диаграмме р–х (рис.2.1) зависимость равновесных концентраций от давления изображается прямой, с наклоном, равным Е.
Как видно из рис.2.1,чем больше Т, тем меньше растворимость.
Если 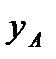 – молярная доля извлекаемого компонента А в газовой смеси и Р – общее давление в системе, то парциальное давление
– молярная доля извлекаемого компонента А в газовой смеси и Р – общее давление в системе, то парциальное давление 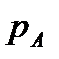 , по закону Дальтона, можно записать:
, по закону Дальтона, можно записать:
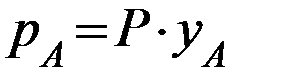 (2.3)
(2.3)
Тогда, из уравнений (2.1) и (2.3) получим:

Итак для закона Генри имеем:
 (2.4)
(2.4)
Здесь 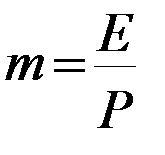 - коэффициент распределения, или константа фазового равновесия.
- коэффициент распределения, или константа фазового равновесия.
Величина m уменьшается с увеличением Р и снижения Т. См Рис.2.1
Таким образом, растворимость газа в жидкости растёт с ростом давления и снижения Т.
Когда в равновесии с жидкостью находятся смесь газов, закону Генри может следовать каждый из компонентов смеси в отдельности.
Закон Генри справедлив только для идеальных газов, а также к сильно разбавленным реальным растворам.
Для хорошо растворимых газов, при больших концентрациях их в растворе, растворимость меньше, чем по закону Генри.
Для систем, не подчиняющихся закону Генри, m является величиной переменной и линия равновесия представляет собой кривую, которую строят обычно по опытным данным.
При больших давлениях (1 МПа и выше) изменение объёма жидкости вследствие растворения в ней газа соизмеримо с изменением объёма газа и равновесие в этом случае не следует закону Генри. При этих условиях константу фазового равновесия можно определить как:
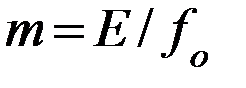 (2.5)
(2.5)
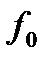 - фугитивность (летучесть) поглощаемого газа, выраженная в единицах давления.
- фугитивность (летучесть) поглощаемого газа, выраженная в единицах давления.
При записи уравнений материального баланса и рабочих линий целесообразно выбрать единицы измерения расходов таковыми, чтобы эти величины не менялись по высоте аппарата. Это сделает рабочие линии прямыми.
При выражении состава фаз не в абсолютных, а в относительных концентрациях видоизменяется и запись закона Генри.
Общая масса фазы, состоящей из распределяемого компонента и 1 кг носителя равна (1+Х) кг (жидкая фаза) и (1+У) кг (газовая фаза). Тогда весовые концентрации х и у распределяемого компонента в фазах:
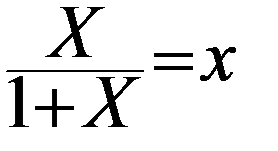

Тогда закон Генри запишется:
 (2.6)
(2.6)
Следовательно, линия равновесия в системе газ – жидкость в координатах Х и У изображается кривой. При малых концентрациях Х в жидкости (2.6) упрощается и принимает вид:
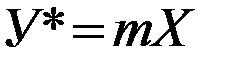
В случае абсорбции многокомпонентных смесей парциальное давление каждого компонента в газовой смеси зависит не только от его концентрации в растворе, но и от концентрации в растворе других компонентов, т.е. является функцией большого числа переменных. Поэтому в подобных случаях, равновесные зависимости основываются на опытных данных.
Дата добавления: 2016-05-25; просмотров: 2800;
