Раскисление алюминием.
Алюминий — более сильный раскислитель, чем кремний (см. рис. 21). При введении алюминия в металле остается ничтожно малое количество растворенного кислорода. Алюминий, введенный в избытке, может взаимодействовать не только с растворенным в металле кислородом, но и с оксидами более слабых раскислителей (МnО, SiO2). При введении алюминия в железо, содержащее
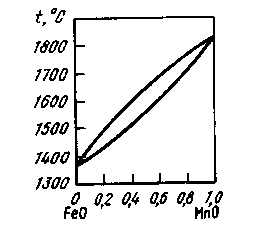
Рис. 22.Диаграмма состояния FeO-MnO
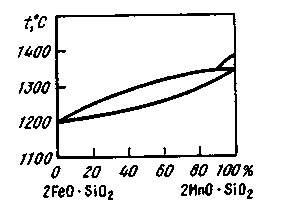
Рис. 23. Диаграмма состояния файялит-тефроит 2FeO·SiO2 – 2MnO·SiO2
диаграмме FeO – А12О3 может образоваться либо чистый глинозем (при большом содержании А12О3), либо шпинель FeO·А12О3 (герценит). Температура плавления чистого глинозема составляет ~ 2050 °С. Высокие значения межфазного натяжения на границе металл—включение глинозема, т. е. малая смачиваемость таких включений, металлом, облегчают процесс их отделения от металла. Образование в стали при раскислении алюминием мелких включений глинозема и нитрида алюминия влияет на протекание процесса кристаллизации, в частности на размер зерна. Обычно размер зерна регулируют, изменяя расход алюминия: чем больше введено алюминия, тем мельче зерно. Введенный в металл алюминий взаимодействует с серой (при большом расходе алюминия) и азотом. Образование в процессе кристаллизации нитрида алюминия A1N способствует снижению вредного влияния азота и уменьшению эффекта старения стали. Раскисление металла алюминием широко распространено. Алюминий вводят в металл в виде брусков (чушек) алюминия или в виде проволоки (см. далее на рис. 25).
1.5. особенности использования щелочноземельных и редкоземельных металлов
Современная техника позволяет использовать в металлургической технологии ЩЗМ и РЗМ. ЩЗМ (кальций и др.) образуют очень прочные оксиды, более прочные, чем кремнезем и даже глинозем. Изменение энергии Гиббса ΔG º при 1900 К для реакции образования оксидов из чистых элементов составляет:
Si + О2 → SiO2, ΔGº= –540 Дж,
4/3Аl + О2 → 2/3А12О3, ΔGº=–712 кДж,
2Са + О2 2СаО, ΔG°=–846 кДж,
поэтому кальций, введенный в металл, взаимодействует не только с FeO и МnО, но и с SiO2 и даже с А12О3, восстанавливая кремний и алюминий не только из образовавшихся ранее оксидных включений, но и из футеровки ковша. Из ЩЗМ в качестве раскислителя чаще других используют кальций. При введении кальция в металл необходимо учитывать давление испарения кальция и его малую растворимость в жидком железе (< 0,032 %). Эффективность раскисления кальцием возрастает при сплавлении его с другими металлами. Обычно кальций используют в виде сплава с кремнием ( 30 % Са, 60 % Si), с кремнием и алюминием ( 20 % Са, 50 % Si, 20 % А1) или в виде соединений (карбид кальция СаС2). Кальций при введении в расплавленную сталь испаряется и взаимодействует с металлом в парообразном состоянии.
При раскислении металла кальцием возрастает скорость удаления включений и уменьшается время, необходимое для получения стали с очень малым числом невсплывших включений. Поднимающиеся пузыри кальция взаимодействуют с находящимися в жидкой стали включениями глинозема. Образующиеся при этом алюминаты кальция имеют низкую температуру плавления, поэтому данные оксиды находятся в стали в жидком виде, что облегчает процесс их всплывания и удаления. Та небольшая часть этих включений, которая остается в стали, имеет вид равномерно распределенных мелких включений СаО·А12О3 округлой формы. Очень важно, что форма этих включений при обработке полученного слитка давлением (при прокатке или ковке) не изменяется, что, в свою очередь, положительно влияет на свойства стали.
Очень сильными раскислителями являются РЗМ (лантан, церий, празеодим, неодим, иттрий и др.). Эти элементы имеют значительные атомные массы, плотность, сравнимую с плотностью стали, высокие температуры кипения при относительно невысоком давлении пара. Таким образом, РЗМ можно вводить в сталь без опасения интенсивного их испарения в отличие от ЩЗМ.
Современная технология обеспечивает получение и поставку на металлургические заводы лигатуры, содержащей до 30—50 % РЗМ. Химическое сродство РЗМ к кислороду очень высокое. Так, например, теплота образования оксида церия Се2О3 ΔH0298 =2240кДж (для FеО ΔH0298=268, для А12О3 ΔH0298=1680кДж), поэтому, будучи введенным в металл в составе лигатуры, церий взаимодействует со всеми включениями, находящимися в жидкой стали, в том числе и с твердыми включениями глинозема:
2Се + А12O3(тв) = Се2O3(тв)+2А1, ΔG º=193858+86,54·Т.
РЗМ интенсивно взаимодействуют с футеровкой агрегата или ковша, восстанавливая, например, кремний и алюминий из шамота.
Активность кислорода при введении в металл РЗМ резко снижается, однако содержание кислорода (в виде включений) изменяется незначительно. Это объясняется тем, что образующиеся оксиды РЗМ представляют собой мелкие, тугоплавкие и очень плотные включения. Плотность образующихся включений сравнима с плотностью жидкой стали, поэтому они не всплывают (иногда в нижней части слитка обнаруживаются скопления тяжелых оксидов РЗМ). Наблюдаются случаи, когда содержание кислорода при введении РЗМ в больших количествах не только не уменьшается, но и возрастает за счет взаимодействия избыточных РЗМ с оксидами, входящими в состав футеровки. Важным моментом является то, что мелкие тугоплавкие включения оксидов РЗМ, более или менее равномерно «плавающие» в жидком металле, становятся при затвердевании слитка или отливки центрами кристаллизации; в результате получается плотный металл с мелкокристаллической структурой и с почти одинаковыми свойствами во всех направлениях относительно направления прокатки слитка. Лигатура, содержащая РЗМ, относительно дорогая, поэтому РЗМ применяют тогда, когда безрезультатными оказались более дешевые методы.
ЩЗМ и РЗМ очень активно взаимодействуют со всеми примесями металла, в том числе с углеродом, серой и растворенными в металле газами (кислородом, азотом, водородом). При использовании ЩЗМ и РЗМ учитывают их высокое химическое сродство к кислороду и сере, в частности то, что химическое сродство к кислороду ЩЗМ и РЗМ выше, чем к сере. Однако даже в недостаточно раскисленном металле часть РЗМ и ЩЗМ взаимодействует с серой и вводимые РЗМ и ЩЗМ частично взаимодействуют с кислородом, находящимся в составе ранее образовавшихся включений, а частично с серой, образуя сульфиды CaS, LaS, La2S3, CeS, Ce2S3 и т. д. Температура плавления сульфидов РЗМ около 2000 0С, и они, так же как оксиды РЗМ, располагаются при кристаллизации не по краям зерна, а сами являются центрами кристаллизации и располагаются в центре зерна. Тем самым их отрицательное влияние на свойства стали сводится к минимуму. Возможно также образование оксисульфидов РЗМ типа La2O2S, Ce2O2S, Y2O2S и т. д.
Дата добавления: 2016-04-22; просмотров: 2988;
