Тверді розчини на основі заліза
У сталях і сплавах можливі три випадки розчинності:
– компоненти практично не розчиняються. При цьому утворюється гетерогенна суміш і кожний елемент кристалізується у своїй гратці .
– компоненти мають необмежену повну розчинність. В цьому випадку атоми різних елементів утворюють спільну кристалічну гратку – неперервний твердий розчин. Залізо з легуючими елементами утворює неперервні тверді розчини у системах Fe – Cr; Fe – V ( 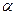 -тверді розчини) і Fe-Mn: Fe-Ni; Fe-Co (
-тверді розчини) і Fe-Mn: Fe-Ni; Fe-Co (  - тверді розчини). Однак в деяких із цих сплавів при певних концентраціях легуючого елемента і температурах утворюються проміжні фази – інтерметаліди .
- тверді розчини). Однак в деяких із цих сплавів при певних концентраціях легуючого елемента і температурах утворюються проміжні фази – інтерметаліди .
– компоненти обмежено розчинні, тобто на діаграмі стану з боку «чистого елемента» утворюється обмежений твердий розчин, який має кристалічну гратку розчинника. Величина розчинності буде різноманітною у кожній системі, тобто обмежені тверді розчини будуть мати неоднакову область гомогенності (концентраційні межі існування твердого розчину).
У більшості систем на основі заліза утворюються саме обмежені тверді розчини. В залежності від величини області гомогенності будемо класифікувати такі розчини як обмежені з широкою областю гомогенності ( в залізі розчиняється більше 2% елемента) і з вузькою областю гомогенності ( від 0,2 до 2%).
Таким чином, по розчинності легуючих елементів у залізі, тверді розчини підрозділяються на неперервні, обмежені з широкою областю гомогенності, обмежені з вузькою областю гомогенності, з незначною розчинністю.
Розчинення легуючих елементів у залізі може проходити по типу заміщення і проникнення.
Тверді розчини заміщення на основі заліза утворюються у відповідності з законами утворення твердих розчинів такого типу (умови Юм- Розері).
Умовами, які визначають розчинність компонентів в розчинах заміщення, є: ізоморфізм, тобто однотипність граток, компонентів, які складають розчин; співвідношення атомних розмірів компонентів («розмірний фактор»); електронна структура компонентів, тобто відносне розташування компонентів у періодичній системі Д. І. Менделеєва.
Необмежені тверді розчини з залізом утворюють Ni, Co, Mn, Cr , V. Причому Ni, Co, Mn утворюють неперервні тверді розчини на основі  -заліза, а Cr і V на основі
-заліза, а Cr і V на основі 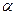 -заліза.
-заліза.
Тверді розчини проникнення утворюють елементи проникнення з малими атомними номерами. Тверді розчини проникнення являються окремим випадком фаз проникнення (до останніх відносяться карбіди, нітриди, бориди, оксиди, гідриди і інші хімічні сполуки перехідних металів з елементами проникнення). Тверді розчини проникнення завжди обмежені, а розчинність у них залежить від кристалічної структури металу – розчинника і розмірів атома елемента проникнення. Найбільш сприятливими позиціями розташування атомів проникнення у твердому розчині будуть октаедричні пори в 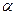 -залізі і окта- і тетраедричні пори у
-залізі і окта- і тетраедричні пори у  -залізі.
-залізі.
Ферит – одна з основних фаз у багатьох сталях. Легований ферит представляє собою багатокомпонентний твердий розчин по типу заміщення і проникнення легуючих елементів і домішок у 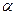 -залізі.
-залізі.
У залізо-вуглецевих сталях аустеніт, як стабільна структурна складова, існує лише при температурах вище  . У легованих сталях завдяки впливу легуючих елементів на розширення
. У легованих сталях завдяки впливу легуючих елементів на розширення  - області, збільшенню стійкості переохолодженного аустеніту і зниження мартенситної точки, аустеніт може бути одною з головних структурних складових сталей у стані їх експлуатації.
- області, збільшенню стійкості переохолодженного аустеніту і зниження мартенситної точки, аустеніт може бути одною з головних структурних складових сталей у стані їх експлуатації.
Основними фазами – зміцнювачами у сталях являються карбіди, нітриди і комплексні сполуки на їх основі – карбонітриди. Фізична природа і властивості цих фаз в більшості визначають їх поведінку у сталі.
Карбіди і нітриди відносяться до фаз проникнення і утворюються між d- перехідними металами і відповідно вуглецем і азотом.
Карбіди заліза відносяться до найменш стійких у порівнянні з карбідами легуючих елементів. Основним карбідом заліза є 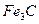 , проміжним карбідом у сталях
, проміжним карбідом у сталях  -карбід, а в деяких високовуглецевих сплавах
-карбід, а в деяких високовуглецевих сплавах 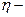 і
і 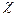 - карбіди. Хром і марганець підвищують стійкість цементиту у сталі.
- карбіди. Хром і марганець підвищують стійкість цементиту у сталі.
Інтерметаліди. Фази, які утворюються в результаті взаємодії основного компоненту сплава з легуючими елементами або легуючих елементів між собою, називаються інтерметалідами.
Відмінною ознакою інтерметалічних сполук є наявність у них нової кристалічної гратки, відмінної від граток, які складають фазу компонентів. Структура, стійкість, температурні і концентраційні області існування інтерметалідів визначаються сукупною дією електронної структури, електрохімічного і розмірного фактору.
Інтерметаліди виявляють певний вплив на зміцнення в аустенітних і мартенситостаріючих сталях, багатьох жароміцних сплавів на нікелевій і кобальтовій основах, а також на властивості жаростійких захисних покриттів. У ряді жароміцних сплавів вміст інтерметалічних фаз може досягати 55-65%.
Розрізняють наступні групи інтерметалічних сполук: електронні сполуки, 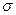 - фази, фази Лавеса, геометрично щільноупаковані фази.
- фази, фази Лавеса, геометрично щільноупаковані фази.
Електронні сполуки. Мають характерні для металічних елементів структури типу о.ц.к., г.ц.к, гк. У цих сполуках структура фаз, яка утворюється в основному визначається електронною концентрацією. При утворенні цих сполук метали перехідних груп виявляють змінну валентність, що обумовлена перекриттям d- і s- рівнів.
При відношенні числа валентних електронів до числа атомів у гратці, яка дорівнює 3/2, інтерметалідні сполуки утворюють 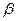 - фази з о.ц.к. структурою. До них відносяться, наприклад алюмініди перехідних металів – FeAl, CoAl і NiAl. Ці інтерметаліди володіють металічними властивостями, однак участь d-електронів у міжатомному зв’язку предвизначає появлення ковалентної складової.
- фази з о.ц.к. структурою. До них відносяться, наприклад алюмініди перехідних металів – FeAl, CoAl і NiAl. Ці інтерметаліди володіють металічними властивостями, однак участь d-електронів у міжатомному зв’язку предвизначає появлення ковалентної складової.
Сигма-фази. 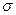 -фази і споріднені їм сполуки утворюються перехідними металами і мають тетрагональні або складні ромбоедричні елементарні комірки, структура яких характеризується наявністю щільно упакованих шарів атомів, які зміщені по відношенню один до одного і розташованих на відносно великих відстанях. Такі фази і споріднені їм сполуки іноді називають топологічно щільноупаковані. Вперше
-фази і споріднені їм сполуки утворюються перехідними металами і мають тетрагональні або складні ромбоедричні елементарні комірки, структура яких характеризується наявністю щільно упакованих шарів атомів, які зміщені по відношенню один до одного і розташованих на відносно великих відстанях. Такі фази і споріднені їм сполуки іноді називають топологічно щільноупаковані. Вперше 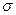 -фаза типу FeCr була виявлена у залізо-хромистих сплаваях як крихка складова.
-фаза типу FeCr була виявлена у залізо-хромистих сплаваях як крихка складова.
Виділення 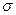 -фази виникає при тривалих витримках в інтервалі температур 500-900
-фази виникає при тривалих витримках в інтервалі температур 500-900  і являється причиною сильного окрихчування сталей і сплавів, зменшує їх пластичність і міцність.
і являється причиною сильного окрихчування сталей і сплавів, зменшує їх пластичність і міцність.
Фази Лавеса.Інтерметалічні сполуки складу  називають фазами Лавеса. Ці фази звичайно мають кубічну або гексагональну структуру. Вони можуть утворюватися компонентами, розташованими в будь-якому місці періодичної системи.
називають фазами Лавеса. Ці фази звичайно мають кубічну або гексагональну структуру. Вони можуть утворюватися компонентами, розташованими в будь-якому місці періодичної системи.
Основним фактором, який визначає їх утворення, є співвідношення атомних розмірів компонентів.
Найбільш часто утворюються в сталях інтерметілічні фази Лавеса: 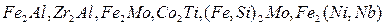 . Їх наявність часто супроводжується окрихчуванням при кімнатній температурі, але менш шкідливе при підвищенних температурах.
. Їх наявність часто супроводжується окрихчуванням при кімнатній температурі, але менш шкідливе при підвищенних температурах.
Більш того, в багатьох теплостійких і жароміцних сплавах вдається використовуввати фази Лавеса для зміцнення без суттєвого зниження в’язкості і крихкої міцності.
Дата добавления: 2016-04-22; просмотров: 821;
