Вещество состоит из атомов
Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это — атомная гипотеза (можете называть ее не гипотезой, а фактом, но это ничего не меняет): все тела состоят из атомов — маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. В одной этой фразе, как вы убедились, содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения.
Чтобы показать силу идеи атома, представим себе капельку воды размером 0,5 см. Если мы будем пристально разглядывать ее, то ничего, кроме воды, спокойной, сплошной воды, мы не увидим. Даже под лучшим оптическим микроскопом при 2000-кратном увеличении, когда капля примет размеры большой комнаты, и то мы все еще увидим относительно спокойную воду, разве что по ней начнут шнырять какие-то «футбольные мячи». Это парамеция — очень интересная штука. На этом вы можете задержаться и заняться парамецией, ее ресничками, смотреть, как она сжимается и разжимается, и на дальнейшее увеличение махнуть рукой (если только вам не захочется рассмотреть ее изнутри). Парамециями занимается биология, а мы прошествуем мимо них и, чтобы еще лучше разглядеть воду, увеличим ее опять в 2000 раз. Теперь капля вырастет до 20 км, и мы увидим, как в ней что-то кишит; теперь она уже не такая спокойная и сплошная, теперь она напоминает толпу на стадионе в день футбольного состязания с высоты птичьего полета. Что же это кишит? Чтобы рассмотреть получше, увеличим еще в 250 раз. Нашему взору представится что-то похожее на фиг. 1.
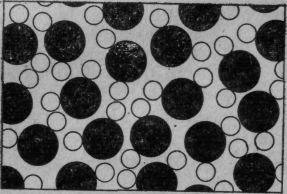
Фиг. 1. Капля воды (увеличенная в миллиард раз).
Это капля воды, увеличенная в миллиард раз, но, конечно, картина эта условная. Прежде всего частицы изображены здесь упрощенно, с резкими краями — это первая неточность. Для простоты они расположены на плоскости, на самом же деле они блуждают во всех трех измерениях — вторая неточность. На рисунке видны «кляксы» (или кружочки) двух сортов — черные (кислород) и белые (водород); видно, что к каждому кислороду пристроились два водорода. (Такая группа из атома кислорода и двух атомов водорода называется молекулой.) Наконец, третье упрощение заключается в том, что настоящие частицы в природе беспрерывно дрожат и подпрыгивают, крутясь и вертясь одна вокруг другой. Вы должны представить себе на картинке не покой, а движение. На рисунке нельзя также показать, как частицы «липнут друг к другу», притягиваются, пристают одна к одной и т. д. Можно сказать, что целые их группы чем-то «склеены». Однако ни одно из телец не способно протиснуться сквозь другое. Если вы попробуете насильно прижать одно к другому, они оттолкнутся.
Радиус атомов примерно равен 1 или 2 на 10-8 см. Величина 10-8 см это ангстрем, так что радиус атома равен 1 или 2 ангстремам (А°). А вот другой способ запомнить размер атома: если яблоко увеличить до размеров Земли, то атомы яблока сами станут размером с яблоко.
Представьте теперь себе эту каплю воды с ее частичками, которые приплясывают, играют в пятнашки и льнут одна к другой. Вода сохраняет свой объем и не распадается на части именно из-за взаимного притяжения молекул. Даже катясь по стеклу, капля не растекается, опять-таки из-за притяжения. И все вещества не улетучиваются по той же причине. Движение частиц в теле мы воспринимаем как теплоту; чем выше температура, тем сильнее движение. При нагреве воды толчея среди частиц усиливается, промежутки между ними растут, и наступает миг, когда притяжения между молекулами уже не хватает, чтобы удержать их вместе, вот тогда они и улетучиваются, удаляются друг от друга. Так получают водяной пар: при повышении температуры усиливается движение и частицы воспаряют.
На фиг. 2 показан пар. Рисунок этот плох в одном — при выбранном нами увеличении на комнату придется всего несколько молекул, поэтому сомнительно, чтобы целых 2,5 молекулы оказались на таком маленьком рисунке. На такой площадке скорее всего не окажется ни одной частицы. Но ведь надо что-то нарисовать, чтоб рисунок не был совсем пустым.
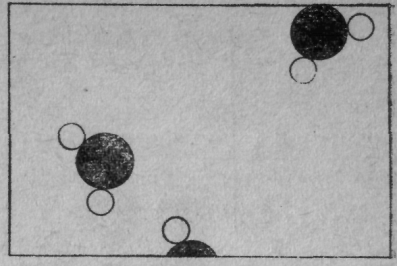
Фиг. 2. Пар под микроскопом
Глядя на пар, легче увидеть характерные черты молекул воды. Для простоты на рисунке угол между атомами водорода взят 120°. На самом же деле он равен 105°3', а промежуток между центрами атомов кислорода и водорода равен 0,957 А°. Как видите, мы довольно хорошо представляем себе эту молекулу.
Давайте рассмотрим некоторые свойства водяного пара или других газов. Разрозненные молекулы пара то и дело ударяются о стенки сосуда. Представьте себе комнату, в которой множество теннисных мячей (порядка сотни) беспорядочно и беспрерывно прыгают повсюду. Под градом ударов стенки расходятся (так что их надо придерживать). Эту неумолкаемую дробь ударов атомов наши грубые органы чувств (их-то чувствительность не возросла в миллиард раз) воспринимают как постоянный напор. Чтобы сдержать газ в его пределах, к нему нужно приложить давление. На фиг. 3 показан обычный сосуд с газом (без него не обходится ни один учебник) — цилиндр с поршнем. Молекулы для простоты изображены теннисными мячиками, или точечками, потому что форма их не имеет значения. Они движутся беспорядочно и непрерывно.
Множество молекул беспрерывно колотит о поршень. Их непрекращаемые удары вытолкнут его из цилиндра, если не приложить к поршню некоторую силу — давление (сила, собственно, — это давление, умноженное на площадь). Ясно, что сила пропорциональна площади поршня, потому что если увеличить его площадь, сохранив то же количество молекул в каждом кубическом сантиметре, то и число ударов о поршень возрастет во столько же раз, во сколько расширилась площадь.
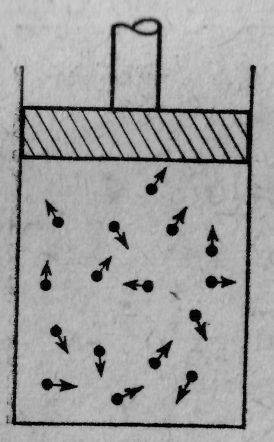
Фиг. 3. Цилиндр с поршнем
А если в сосуде число молекул удвоится (и соответственно возрастет их плотность), а скорости их (и соответственно температура) останутся прежними? Тогда довольно точно удвоится и число ударов, а так как каждый из них столь же «энергичен», как и раньше, то выйдет, что давление пропорционально плотности. Если принять во внимание истинный характер сил взаимодействия атомов, то следует ожидать и небольшого спада давления из-за увеличения притяжения между атомами и легкого роста давления из-за увеличения доли общего объема, занятого самими атомами. И все же в хорошем приближении, когда атомов сравнительно немного (т. е. при невысоких давлениях), давление пропорционально плотности.
Легко понять и нечто другое. Если повысить температуру газа (скорость атомов), не меняя его плотности, что произойдет с давлением? Двигаясь быстрей, атомы начнут бить по поршню сильней; к тому же удары посыплются чаще — и давление возрастет. Вы видите, до чего просты идеи атомной теории.
А теперь рассмотрим другое явление. Пускай поршень медленно двинулся вперед, заставляя атомы тесниться в меньшем объеме. Что бывает, когда атом ударяет по ползущему поршню? Ясно, что после удара его скорость повышается. Можете это проверить, играя в пинг-понг: после удара ракеткой шарик отлетает от ракетки быстрей, чем подлетал к ней. (Частный пример: неподвижный атом после удара поршня приобретает скорость.) Стало быть, атомы, отлетев от поршня, становятся «горячее», чем были до толчка. Поэтому все атомы в сосуде наберут скорость. Это означает, что при медленном сжатии газа его температура растет. Когда медленно сжимаешь газ, его температура повышается, а когда медленно расширяешь, температура падает.
Вернемся к нашей капельке воды и посмотрим, что с ней будет, когда температура понизится. Положим, что толчея среди молекул воды постепенно утихает. Меж ними, как мы знаем, существуют силы притяжения; притянувшимся друг к другу молекулам уже нелегко покачиваться и прыгать На фиг. 4 показано, что бывает при низких температурах; мы видим уже нечто новое. Образовался лед. Конечно, картинка эта опять условна — у льда не два измерения, как здесь изображено, но в общих чертах она справедлива.

Фиг. 4. Молекулы льда
Интересно, что в этом веществе у каждого атома есть свое место, и если каким-то образом мы расставим атомы на одном конце капли каждый на свое место, то за многие километры от него на другом конце (в нашем увеличенном масштабе) из-за жесткой структуры атомных связей тоже возникнет определенная правильная расстановка. Поэтому если потянуть за один конец ледяного кристалла, то за ним, противясь разрыву, потянется и другой — в отличие от воды, в которой эта правильная расстановка разрушена интенсивными движениями атомов. Разница между твердыми и жидкими телами состоит в том, что в твердых телах атомы расставлены в особом порядке, называемом кристаллической структурой, и даже в том случае, когда они находятся далеко друг от друга, ничего случайного в их размещении не наблюдается — положение атома на одном конце кристалла определяется положением атомов на другом конце, пусть между ними находятся хоть миллионы атомов. В жидкостях же атомы на дальних расстояниях сдвинуты как попало. На фиг. 4 расстановка молекул льда мною выдумана, и хотя кое-какие свойства льда здесь отражены, но в общем она неправильна. Верно схвачена, например, часть шестигранной симметрии кристаллов льда. Посмотрите: если повернуть картинку на 120°, получится то же самое расположение. Таким образом, лед имеет симметрию, вследствие которой снежинки все шестигранны. Из фиг. 4 можно еще понять, отчего, растаяв, лед занимает меньший объем. Смотрите, как много «пустот» на рисунке; у настоящего льда их тоже много. Когда система разрушается, все эти пустоты заполняются молекулами. Большинство простых веществ, за исключением льда и гарта (типографского сплава), при плавлении расширяется, потому что в твердых кристаллах атомы упакованы плотнее, а после плавления им понадобится место, чтобы колебаться; сквозные же структуры, наподобие льда, разрушаясь, становятся компактнее.
Но хотя лед обладает «жесткой» кристаллической структурой, его температура может тоже меняться, в нем есть запас тепла. Этот запас можно менять по своему желанию. Что же это за тепло? Атомы льда все равно не находятся в покое. Они дрожат и колеблются. Даже когда существует определенный порядок в кристалле (структура), все атомы все же колеблются «на одном месте». С повышением температуры размах их колебаний все растет, пока они не стронутся с места. Это называется плавлением. Наоборот, с падением температуры колебания все замирают, пока при абсолютном нуле температуры они не станут наименьшими из возможных (хотя полной остановки не наступит).
Этого минимального количества движения не хватает, чтобы растопить тело. Но есть одно исключение — гелий. Гелий при охлаждении тоже уменьшает движение своих атомов до предела, но даже при абсолютном нуле в них оказывается достаточный запас движения, чтобы предохранить гелий от замерзания. Гелий не замерзает и при абсолютном нуле, если только не сжимать его под высоким давлением. Повышая давление, можно добиться затвердения гелия.
Атомные процессы
Так с атомной точки зрения описываются твердые, жидкие и газообразные тела. Но атомная гипотеза описывает и процессы, и мы теперь рассмотрим некоторые процессы с атомных позиций. Первым делом речь пойдет о процессах, происходящих на поверхности воды. Что здесь происходит? Мы усложним себе задачу, приблизим ее к реальной действительности, предположив, что над поверхностью находится воздух. Взгляните на фиг. 5. Мы по-прежнему видим молекулы, образующие толщу воды, но, кроме того, здесь изображена и ее поверхность, а над нею — различные молекулы: прежде всего молекулы воды в виде водяного пара, который всегда возникает над водной поверхностью (пар и вода находятся в равновесии, о чем мы вскоре будем говорить). Кроме того, над водой витают и другие молекулы — то скрепленные воедино два атома кислорода, образующие молекулу кислорода, то два атома азота тоже слипшиеся в молекулу азота. Воздух почти весь состоит из азота, кислорода, водяного пара и меньших количеств углекислого газа, аргона и прочих примесей.
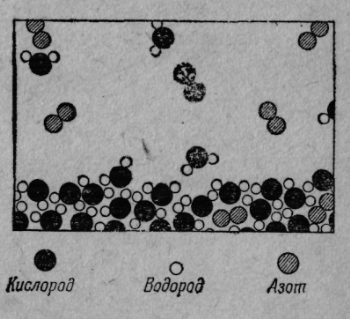
Фиг. 5. Молекулы воды, испаряющейся в воздух.
Итак, над поверхностью воды, находится воздух — газ, содержащий некоторое количество водяного пара. Что происходит на этом рисунке? Молекулы воды непрерывно движутся. Время от времени какая-нибудь из молекул близ поверхности получает толчок сильнее остальных и выскакивает вверх. На рисунке этого, конечно, не видно, потому что здесь все неподвижно. Но попробуйте просто представить себе, как одна из молекул только что испытала удар и взлетает вверх, с другой случилось то же самое и т. д. Так, молекула за молекулой, вода исчезает — она испаряется. Если закрыть сосуд, мы обнаружим среди молекул находящегося в нем воздуха множество молекул воды. То и дело некоторые из них снова попадают в воду и остаются там. То, что казалось нам мертвым и неинтересным (скажем, прикрытый чем-нибудь стакан воды, который, может быть, 20 лет простоял на своем месте), на самом деле таит в себе сложный и интересный, беспрерывно идущий динамический процесс. Для нашего грубого глаза в нем ничего не происходит, но стань мы в миллиард раз зорче, мы бы увидали, как все меняется: одни молекулы взлетают, другие оседают.
Почему же мы не видим этих изменений? Да потому, что сколько взлетает молекул, столько же и оседает! В общем-то там «ничего не происходит». Если раскрыть стакан и сдуть влажный воздух, на смену ему притечет уже сухой; число молекул, покидающих воду, останется прежним (оно ведь зависит только от движения в воде), а число возвращающихся молекул сильно уменьшится, потому что их уже над водой почти не будет. Число улетающих молекул превысит число оседающих, вода начнет испаряться. Мораль: если вам нужно испарять воду, включайте вентилятор!
Но это еще не все. Давайте подумаем, какие молекулы вылетают из воды? Если уж молекула выскочила, то это значит, что она случайно вобрала в себя излишек энергии; он ей понадобился, чтобы разорвать путы притяжения соседей. Энергия вылетающих молекул превосходит среднюю энергию молекул в воде, поэтому энергия остающихся молекул ниже той, которая была до испарения. Движение их уменьшается. Вода от испарения постепенно остывает. Конечно, когда молекула пара опять оказывается у поверхности воды, она испытывает сильное притяжение и может снова попасть в воду. Притяжение разгоняет ее, и в итоге возникает тепло. Итак, уходя, молекулы уносят тепло; возвращаясь — приносят. Когда стакан закрыт, баланс сходится, температура воды не меняется. Если же дуть на воду, чтобы испарение превысило оседание молекул, то вода охлаждается. Мораль: чтобы остудить суп, дуйте на него!
Вы понимаете, конечно, что на самом деле все происходит гораздо сложнее, чем здесь описано. Не только вода переходит в воздух, но молекулы кислорода или азота время от времени переходят в воду и «теряются» в массе молекул воды. Попадание атомов кислорода и азота в воду означает растворение воздуха в воде; если внезапно из сосуда воздух выкачать, то молекулы воздуха начнут из воды выделяться быстрее, чем проникают в нее; мы увидим, как наверх подымаются пузырьки. Вы, наверно, слышали, что это явление очень вредно для ныряльщиков.
Перейдем теперь к другому процессу. На фиг. 6 мы видим, как (с атомной точки зрения) соль растворяется в воде. Что получается, если в воду бросить кристаллик соли?
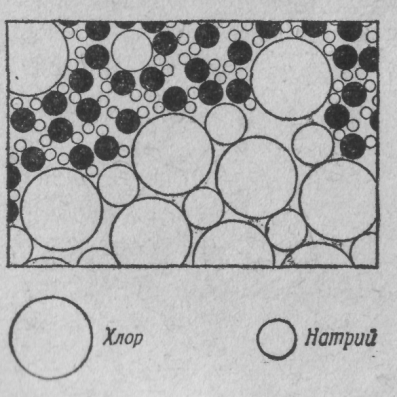
Фиг. 6. Молекулы соли, растворяющейся в воде.
Строго говоря, кристалл состоит не из атомов, а из ионов. Ионы — это атомы с излишком или с нехваткой электронов. В кристалле соли мы находим ионы хлора (атомы хлора с лишним электроном) и ионы натрия (атомы натрия, лишенные одного электрона). Ионы в твердой соли скреплены друг с другом электрическим притяжением, но в воде некоторые из них, притянувшись к положительному водороду или отрицательному кислороду, начинают свободно двигаться. На фиг. 6 виден освободившийся ион хлора и другие атомы, плавающие в воде в виде ионов. На рисунке нарочно подчеркнуты некоторые детали процесса. Заметьте, например, что водородные концы молекул воды обычно обступают ион хлора, а возле иона натрия чаще оказывается кислород (ион натрия положителен, а атом кислорода в молекуле воды отрицателен, поэтому они притягиваются). Можно ли из рисунка понять, растворяется ли здесь в воде или же выкристаллизовывается из воды? Ясно, что нельзя; часть атомов уходит из кристалла, часть присоединяется к нему. Процесс этот динамический, подобный испарению; все зависит от того, много или мало соли в воде, в какую сторону нарушено равновесие. Под равновесным понимается такое состояние, когда количество уходящих атомов равно количеству приходящих. Если в воде почти нет соли, то больше атомов уходит в воду, чем возвращается из воды: соль растворяется. Если же «атомов соли» слишком много, то приход превышает уход, и соль выпадает в кристаллы.
Мы мимоходом упомянули, что понятие молекулы вещества не совсем точно и имеет смысл только для некоторых видов веществ. Оно применимо к воде, в ней действительно три атома всегда скреплены между собой, но оно не очень подходит к твердому хлористому натрию. Хлористый натрий - это ионы хлора и натрия, образующие кубическую структуру. Нельзя естественным путем сгруппировать их в «молекулы соли».
Вернемся к вопросу о растворении и осаждении соли. Если повысить температуру раствора соли, то возрастет и число растворяемых атомов и число осаждаемых. Оказывается, что в общем случае трудно предсказать, в какую сторону сдвинется процесс, быстрей или медленней пойдет растворение. С ростом температуры большинство веществ начинает растворяться сильней, а у некоторых растворимость падает.
Химические реакции
Во всех описанных процессах атомы и ионы не меняли своих напарников. Но, конечно, возможны обстоятельства, в которых сочетания атомов меняются, образуя новые молекулы. Это показано на фиг. 7. Процесс, в котором атомные партнеры меняются местами, называется химической реакцией.
Описанные нами прежде процессы называются физическими, но трудно указать резкую границу между теми и другими. (Природе все равно, как мы это назовем, она просто делает свое дело.) На картинке мы хотели показать, как уголь горит в кислороде. Молекула кислорода состоит из двух атомов, сцепленных очень крепко. (А почему не из трех или даже не из четырех? Такова одна из характерных черт атомных процессов: атомы очень разборчивы, им нравятся определенные партнеры, определенные направления и т. д. Одна из обязанностей физики — разобраться, почему они хотят именно то, что хотят. Во всяком случае два атома кислорода, довольные и насыщенные, образуют молекулу.)
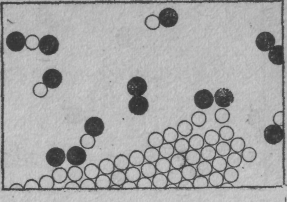
Фиг. 7. Уголь, горящий в кислороде
Предположим, что атомы углерода образуют твердый кристалл (графит или алмаз). Одна из молекул кислорода может пробраться к углероду, каждый ее атом подхватит по атому углерода и улетит в новом сочетании углерод — кислород. Такие молекулы образуют газ, называемый угарным. Его химическое имя СО. Что это значит? Буквы СО — это фактически картинка такой молекулы: С — углерод, О — кислород. Но углерод притягивает к себе кислород намного сильнее, чем кислород притягивает кислород или углерод — углерод. Поэтому кислород для этого процесса может поступать с малой энергией, но, схватываясь с неимоверной жадностью и страстью с углеродом, высвобождает энергию, поглощаемую всеми соседними атомами. Образуется большое количество энергии движения (кинетической энергии). Это, конечно, и есть горение; мы получаем тепло от сочетания кислорода и углерода. Теплота в обычных условиях проявляется в виде движения молекул нагретого газа, но иногда ее может быть так много, что она вызывает и свет. Так получается пламя.
Вдобавок молекулы СО могут не удовольствоваться достигнутым. У них есть возможность подсоединить еще один атом кислорода; возникает более сложная реакция: кислород в паре с углеродом столкнется с другой молекулой СО. Атом кислорода присоединится к СО и в конечном счете образуется молекула из одного углерода и двух кислородов. Ее обозначают СО2 и называют углекислым газом. Когда углерод сжигают очень быстро (скажем, в моторе автомашины, где взрывы столь часты, что углекислота не успевает образоваться), то возникает много угарного газа. Во многих таких перестановках атомов выделяется огромное количество энергии, наблюдаются взрывы, вспыхивает пламя и т. д.; все зависит от реакции.
Химики изучили эти расположения атомов и установили, что любое вещество — это свой тип расположения атомов.
Чтобы объяснить эту мысль, рассмотрим новый пример. У клумбы фиалок вы сразу чувствуете их «запах». Это значит, что в ваш нос попали молекулы, или расположения атомов особого рода. Как они туда попали? Ну, это просто. Раз запах — это молекулы особого рода, то, двигаясь и сталкиваясь повсюду, они случайно могли попасть и в нос. Конечно, они не стремились попасть туда. Это просто беспомощные толпы молекул, и в своих бесцельных блужданиях эти осколки вещества, случается, оказываются и в носу.
И вот химики могут взять даже такие необычные молекулы, как молекулы запаха фиалок, проанализировать их строение и описать нам точное расположение их атомов в пространстве. Мы, например, знаем, что молекула углекислого газа пряма и симметрична: О—С—О (это легко обнаружить и физическими методами). Но и для безмерно более сложных, чем те, с которыми имеет дело химия, расположений атомов можно после долгих увлекательных поисков понять, как выглядит это расположение. На фиг. 8 изображен воздух над фиалками. Снова мы находим здесь азот, кислород, водяной пар... (А он-то откуда здесь? От влажных фиалок. Все растения испаряют воду.)
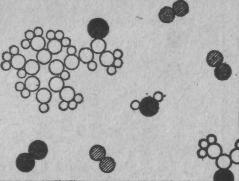
Фиг. 8. Запах фиалки
Среди них, однако, витает «чудовище», сложенное из атомов углерода, водорода и кислорода, облюбовавших для себя особого вида расположение. Это расположение намного сложнее, чем у углекислоты. К сожалению, мы не можем его нарисовать: хотя оно известно химикам очень точно, но оно ведь трехмерное, как его изобразить в двух измерениях?! Как нарисовать шесть углеродов, которые образуют кольцо, но не плоское, а «гармошкой»? Все углы, все расстояния в ней известны. Так вот, химическая формула — это просто картина такой молекулы. Когда химик пишет формулу на доске, он, грубо говоря, пытается нарисовать молекулу в двух измерениях. Например, мы видим кольцо из шести углеродов; углеродную цепочку, Свисающую с одного конца; кислород, торчащий на конце цепочки; три водорода, привязанные вон к тому углероду; два углерода и три водорода, прилепленные вот здесь, и т. д.
Как же химик узнает, что это за расположение? Возьмет он две пробирки с веществом, сольет их содержимое и смотрит: если смесь покраснела, значит, к такому-то месту молекулы прикреплен один водород и два углерода; если посинела, то... то это ничего не значит. Органическая химия может поспорить с самыми фантастическими страницами детективных романов. Чтобы узнать, как расположены атомы в какой-нибудь невероятно сложной молекуле, химик смотрит, что будет, если смешать два разных вещества! Да физик нипочем не поверит, что химик, описывая расположение атомов, понимает, о чем говорит. Но вот уже больше 20 лет, как появился физический метод, который позволяет разглядывать молекулы (не такие сложные, но, по крайней мере, родственные) и описывать расположение атомов не по цвету раствора, а по измерению расстояний между атомами. И что же? Оказалось, что химики почти никогда не ошибаются!
Оказывается, что действительно в запахе фиалок присутствуют три слегка различные молекулы, они отличаются только расстановкой атомов водорода.
Одна из проблем в химии — это придумать такое название для вещества, чтобы по нему можно было бы узнать, какое оно. Найти имя для его формы! Но оно должно описывать не только форму, а указывать еще, что здесь стоит кислород, а вон там — водород, чтобы было точно отмечено, где что стоит. Теперь вы понимаете, почему химические названия так сложны. Это не сложность, а полнота. Название молекулы запаха фиалок поэтому таково: 4-(2,2,3,6-тетраметил-5-циклогексан)-3-бутен-2-ОН. Оно полностью описывает строение молекулы (изображенной на фиг. 9), а его длина объясняется сложностью молекулы. Дело, значит, вовсе не в том, что химики хотят затуманить мозги, просто им приходится решать сложнейшую задачу описания молекулы словами!
Но откуда мы все-таки знаем, что атомы существуют? А здесь идет в ход уже описанный прием: мы предполагаем их существование, и все результаты один за другим оказываются такими, как мы предскажем, — какими они должны быть, если все состоит из атомов. Существуют и более прямые доказательства. Вот одно из них. Атомы так малы, что ни в какой микроскоп их не увидишь (даже в электронный, а уж в световой и подавно). Но атомы все время движутся, и если бросить в воду большой шарик (большой по сравнению с атомами), то и он начнет подрагивать. Все равно как в игре в пушбол, где большущий мяч толкают с разных сторон две команды. Толкают в разных направлениях, и куда мяч покатится, не угадаешь. Точно так же будет двигаться и «большой мяч» в воде: в разные моменты времени с разных сторон на него будут сыпаться неодинаковые удары. Поэтому когда мы глядим в хороший микроскоп на мельчайшие частички в воде, то видим их непрерывное метание — итог бомбардировки их атомами. Называется это броуновским движением.
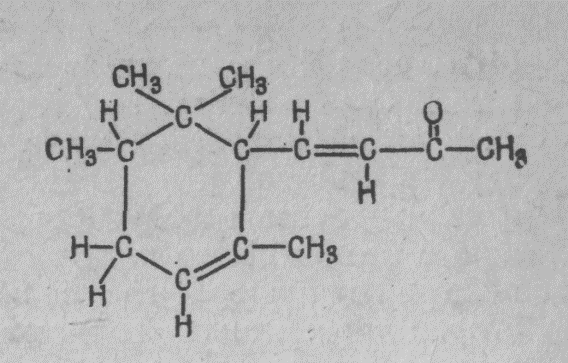
Фиг. 9. Структурная формула запаха фиалки
Другие доказательства существования атомов можно извлечь из строения кристаллов. Во многих случаях их строение, определенное из .опытов по прохождению рентгеновских лучей через кристаллы, согласуется по своему пространственному расположению с формой самого природного кристалла. Углы между разными гранями кристалла согласуются с точностью не до градусов, а до секунд дуги с углами, высчитанными в предположении, что кристалл сложен из множества «слоев» атомов.
Все состоит из атомов. Это самое основное утверждение. В биологии, например, самое важное предположение состоит в том, что все, что делает животное, совершают атомы. Иными словами, в живых существах нет ничего, что не могло бы быть понято с той точки зрения, что они состоят из атомов, действующих по законам физики. Когда-то это не было еще ясно. Потребовалось немало опытов и размышлений, прежде чем высказать это предположение, но теперь оно повсеместно принято и приносит огромную пользу, порождая новые идеи в области биологии.
Да посудите сами! Если уж стальной кубик или кристаллик соли, сложенный из одинаковых рядов одинаковых атомов, может обнаруживать такие интересные свойства; если вода — простые капельки, неотличимые друг от друга и покрывающие миля за милей поверхность Земли, — способна порождать волны и пену, гром прибоя и странные узоры на граните набережной; если все это, все богатство жизни вод — всего лишь свойство сгустков атомов, то сколько же еще в них скрыто возможностей? Если вместо того, чтобы выстраивать атомы по ранжиру, строй за строем, колонну за колонной, даже вместо того, чтобы сооружать из них замысловатые молекулы запаха фиалок, если вместо этого располагать их каждый раз по-новому, разнообразя их мозаику, не повторяя того, что уже было, — представляете, сколько необыкновенного, неожиданного может возникнуть в их поведении. Разве не может быть, что те «тела», которые разгуливают по улице и беседуют с вами, тоже не что иное, как сгустки атомов, но такие сложные, что уже не хватает фантазии предугадывать по их виду их поведение. Когда мы называем себя сгустками атомов, это не значит, что мы — только собрание атомов, потому что такой сгусток, который никогда не повторяется, прекрасно может оказаться способным и на то, чтобы сидеть у стола и читать эти строки.
Материя - объективная реальность, данная нам в ощущениях! Справедливо и на уровне органов чувств и с помощью приборов. Попробуйте закрыть пальцем конец трубки и отсосать воздух. Почувствуете боль. Тогда и вакуум - материя?
Вернемся к кристаллу соли. Соль — твердое тело, кристалл, в котором «атомы соли» расставлены правильными рядами. На фиг. 10 показано трехмерное строение обычной соли (хлористого натрия). Но и некоторые другие вещества имеют сходное строения (см. таблицу).
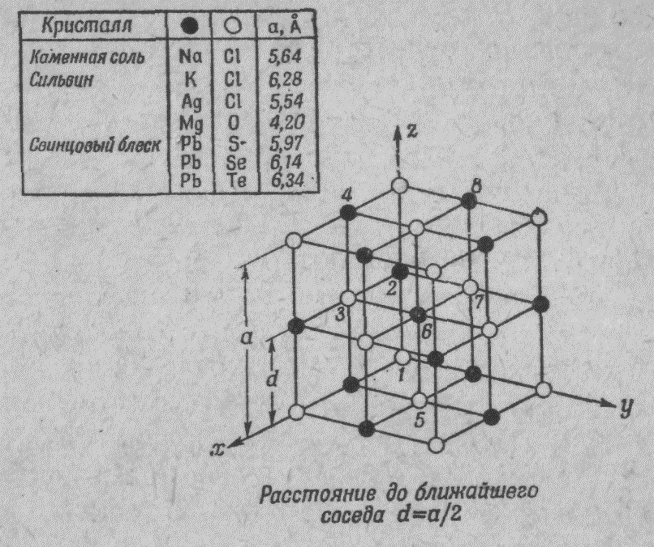
Фиг. 10. Структура кристалла соли
А что находится между атомами натрия и хлора. И если диаметр атома 1А, и а = 4-6 А, то пустоты в кристалле в 125 раз больше, чем материи??
| <== предыдущая лекция | | | следующая лекция ==> |
| Компенсатор постійного струму | | | Классификация методов исследования |
Дата добавления: 2016-04-19; просмотров: 1160;
