Причиной возникновения этого явления является наличие градиента скорости, а механизм столкновения молекул.
Для жидкостей механизм отличается тем, что характер теплового движения молекул жидкости другой по сравнению с молекулами газа. Молекулы жидкости достаточно долго колеблются около некоторых положений равновесия, но могут сменить положение равновесия, что и обеспечивает текучесть жидкости, поэтому, если представить себе, что вместо газа течет жидкость, то смена положений равновесия отдельных молекул жидкости происходит, именно вдоль направления течения, то есть обмен молекул жидкости между слоями незначителен. Зато на условной границе раздела слоев молекулы из слоя А взаимодействуют с молекулами из слоя В, оно и обеспечивает вязкость текучести жидкости.
На границе раздела твердого тела и жидкости возникает межмолекулярный слой молекул, которые неподвижны относительно твердого тела. Количественно явление вязкости описывается несколько иначе, чем явление теплопроводности диффузии, то есть не вводится понятие потока, а роль потока играет сила внутреннего трения приходится на единицу площади.
 .
.

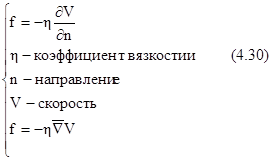

Сила, приходящаяся на единицу площади, линейно связана с градиентом скорости.

Формулы 4.30 выражают закон Ньютона для сил внутреннего трения. Приравнивая правые части 4.30 и 4.29 , получим:

(аналог интегральных уравнений для диффузии и теплопрово-дности.
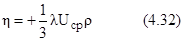 Коэффициент вязкости выражается :
Коэффициент вязкости выражается :
r-плотность жидкости объема газа.
Если подставить в эту формулу выражение для всех величин туда входящих, то получим:
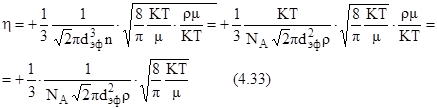 Эта формула дает правильную зависимость коэффициента вязкости от параметров газа объема жидкости в том случае если учесть зависимость от температуры эффективного диаметра молекулы.
Эта формула дает правильную зависимость коэффициента вязкости от параметров газа объема жидкости в том случае если учесть зависимость от температуры эффективного диаметра молекулы.
Глава5. Фазовое превращение и фаза равновесия.
§5.1Силы взаимодействия потенциальной энергии .Взаимодействие молекул реального газа.
 С развитием техники высокого вакуума и сверхвысоких давлений было замечено, что сжатие газа возможно до вполне определенного объема. Первоначально считали, что взаимодействие между молекулами определяется:
С развитием техники высокого вакуума и сверхвысоких давлений было замечено, что сжатие газа возможно до вполне определенного объема. Первоначально считали, что взаимодействие между молекулами определяется:
 Был построен график:
Был построен график:
…График по которому изменяются силы взаимодействия между молекулами в зависимости от расстояния.
r0-при котором силы взаимного притяжения и отталкивания равны нулю.
r= r0 соответствует тому расстоянию, когда молекулы реального газа находятся в равновесии .
 Для сближения или удаления молекул друг ото друга требуется произвести работу, при этом происходит убыль Wp системы газа. Если работу совершает сама система, то потенциальная энергия :
Для сближения или удаления молекул друг ото друга требуется произвести работу, при этом происходит убыль Wp системы газа. Если работу совершает сама система, то потенциальная энергия :

Если работу производят над системой, то в этом случае:
Wp взаимодействия между молекулами в состоянии равновесия обладает min, поэтому если рассмотреть термодинамическую систему состоящую из большого числа молекул , то в этой системе сила свободной энергии молекул будет минимальна.

 |
Устойчивым будет такое положение молекул, при котором энергия потенциального взаимодействия соответствует минимуму, то есть:
 1) -сохраняет устойчивое равновесие
1) -сохраняет устойчивое равновесие
2) при r=r0 есть равенство сил взаимодействия между молекул.
Глубина потенциальной ямы определяет ту работу, которую необходимо совершить против сил взаимного притяжения для того чтобы оторвать молекулы , оказавшиеся в равновесии друг от друга и развести на бесконечное расстояние .
§5.2Уравнение Ван-дер-Ваальса.(уравнение реального газа).
Уравнение Менделеева-Клапейрона не отвечало практическим задачам, поэтому Ван-дер-Ваальс решил преобразовать:
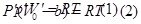 |
P/ иV/ новые значения давления и объема для реальных газов , где V/ =(V-b), где V/ -объем моля газа с учетом собственного объема молекул, b-собственный объем молекул и поправка Ван-дер-Ваальса, поэтому уравнение (1) можно записать так:
Вторая поправка Ван-дер-Ваальса учитывает давление произведенное на стенки сосудов, обусловленное взаимодействием молекул со стенками сосуда.
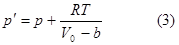
 “Взаимодействуют” только молекулы, которые “прилипли” к стенкам. Величина их взаимодействия есть величина пропорциональная квадрату первоначального объема .
“Взаимодействуют” только молекулы, которые “прилипли” к стенкам. Величина их взаимодействия есть величина пропорциональная квадрату первоначального объема .
a-вторая поправка Ван-дер-Ваальса. Если записать:
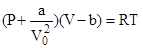
-уравнение Ван-дер-Ваальса для моля газа.
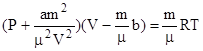
-Уравнение Менделеева- Клапейрона для
любой массы газа, уравнение Ван-дер-Ваальса для реального газа.
§5.3Экспериментальные изотермы реальных газов .Опыты Эндрюса.
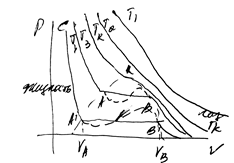
значение VA-VB увеличиваясь с понижением температуры и достигал минимального значения в критической .Если объем уменьшится, то количество жидкости увеличится.
Любую до критическую изотерму можно разбить на 3 участка:
1) С-А газ находится в жидком состоянии
2) А-В влажный пар, давление постоянно при любом изменении
объема.
3)B-F –состояние сухого пара –давление монотонно возрастает при уменьшении объема.
Опыты показали, что эти изотермы Эндрюса есть в режимах Ван-дер-Ваальса
4)А-Р -задерживает кипение.
5)B-E – если проводить нагревание сосуда с гладкими стенками и удаление примесей(перегретый пар, перенасыщенный).
§5.4Уравнение Клапейрона-Клаудиуса. Уравнение перехода.
§5.5Фазовые переходы первого и второго рода.
1)Кипение жидкости, плавление .
Особенность:1)постоянство одновременно температуры и давления .
Изменение объема между жидкостью и газом.
2) Необходимо подводить или отнимать фазового перехода.[l].
2. не связаны с поглощением тепла или выделением. Примером является переход парамагнетика в ферромагнетика и наоборот.
§6.1Исследование кристаллизации структур методами рентгено-, электро-,нейтропографии.
Вещество может находится в 3 агрегатных состояниях:твердом ,жидком и газообразном. Первые два состояния твердое и жидкое называются конденсированными состояниями.
Все твердые тела делятся на аморфные и кристаллические. В кристаллических твердых кристаллах-телах, частицы вещества (атомы, ионы, молекулы) расположены упорядоченно относительно друг друга в пределах всего тела. Такое расположение частиц называется дальним порядком. В аморфных телах “атомы” (частицы) расположены упорядоченно только в небольшой области пространства в целом внутри тела расположение атомов хаотично. Такое расположение атомов называют ближним порядком.
Периодически расположенные атомы в кристаллах образуют пространственную структуру, которая называется кристаллической решеткой. Кристаллическая решетка обладает симметрией. Симметрия кристаллической решетки –ее свойства совмещаться с собой при различных пространственных перемещениях.(сдвиги, повороты, зеркальные отражения).Всякая кристаллическая решетка
может быть составлена перемещением в 3 различных направлениях некоторого структурного элемента, который называется элементарной ячейкой. Все элементарные ячейки в кристаллах являются параллелограммами.
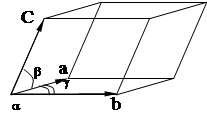 |
a,b,c- ,базисные векторы элементарной ячейки. Модули этих векторов a,b,c-основные периоды элементарной ячейки.
Элементарные ячейки содержат атомы только в вершинах параллелепипеда и называются примитивными. В таких ячейках отсутствуют атомы внутри параллелепипеда и на его гранях. Существуют семь типов примитивных ячеек, которые называются кристаллографными системами.
| Сингония | Характеристика Элементарной ячейки | Форма элементарной ячейки | ||||||||
 1) Мриклеенная 1) Мриклеенная
| a<>b<>c a<>b<>g | |||||||||
 2) Моноклеенная 2) Моноклеенная
| a<>b<>c a=b=900<>g | |||||||||
 3)Ромбическая 3)Ромбическая
| a<>b<>c a=b==g | |||||||||
 4)Тетроганальная 4)Тетроганальная
| a=b<>c a=b==g=900 | |||||||||
 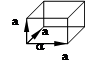 5)Ромбоэндрическая 5)Ромбоэндрическая
| a=b=c a=b==g<>900 | |||||||||
   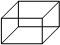 6)Гексагональная 6)Гексагональная
| a=b<>c a=b=900g=600 | |||||||||
| 7)Кубическая | a=b=c a=b=900g=900 |
Примитивные ячейки отражают набор различных видов симметрии.
Атомы, встроенные во внутрь примитивной ячейки или на ее грань не меняют форму ячейки. Если атом расположен внутри элементарной ячейки то такая ячейка называется объемно-центрированной. Если атом расположен на грани элементарной ячейки, то такая ячейка называется гранецентрированной.
Центрирование объема граней примитивных ячеек добавляет еще 7 типов элементарных ячеек. Всего получается 14 типов элементарных ячеек, которые называются решетками Брове.
§6.2Точечные эффекты в кристаллах. Вакансия, примеси внедрения, примеси замещения.
Идеальная структура в реальных газах может наблюдаться только в очень небольших объемах кристаллов. Любые нарушения в упорядоченном расположении атомов в кристаллической решетке называется дефектом. Все дефекты делятся на 2 типа: макроскопические (трещины, поры, макроскопические инородные примеси) и микроскопические. В свою очередь микроскопические дефекты делятся на точечные и линейные. Точечные дефекты бывают 3 видов: вакансии - отсутствие атома в узле кристаллической решетки.
2)Межузельный атом – атом основного вещества, внедрившийся в межузельное пространство.
 |
3)Примесной атом- атом примеси, либо замещающий атом основного вещества в узле кристаллической решетки(примесь замещения)либо внедрившийся в межузельное пространство.
 Концентрация вакансий:
Концентрация вакансий:
Eв- энергия вакансий, которую необходимо сообщить атому, находящемуся в узле, чтобы он покинул этот узел.
К- константа Больцмана.
Т- абсолютная температура.

Еу- энергия образованная межузельными атомами. Для меди, если температура плавления 1270 К, то Cв=104см-3, а Су=10-11cм-3
§6.3§6.4 Краевые и винтовые дислокации и пластичность.
Линейные микроскопические дефекты нарушают дальний порядок в расположении атомов. Особый вид линейных дефектов –дислокации. Дислокации– нарушение связей с правильным чередованием атомных плоскостей. Дислокации бывают двух видов:
краевые и винтовые, если некоторая атомная плоскость в кристалле обрывается, то ее край образует краевую дислокацию.
Полу плоская краевая дислокация:
 |
Краевая дислокация:

В случае винтовой дислокации ни одна из атомных плоскостей внутри кристалла не обрывается, а сами плоскости лишь приближенно параллельны и смыкаются друг с другом, таким образом, что образуют единую винтообразную поверхность.

Все виды дефектов влияют на механические, электрические, оптические свойства кристаллов.
Механические свойства кристаллов определяются макроскопи-ческими дефектами (трещинами, порами) и разрушение кристалла идет по макроскопическому дефекту, при этом прочностные характеристики тела уменьшаются во много раз.
Упрочнение тел можно осуществить двумя путями. Первый –создание бездефектных кристаллов, второй - разрушение макроскопических дефектов и созданием сложности для их распространения. В настоящее время чаще используют второй способ, при этом структура кристаллического вещества не меняется.
Пластичность связана с наличием краевых дислокаций.
§6.5 Понятие о фаналах, теплоемкость кристаллов при низких и высоких температурах.
| <== предыдущая лекция | | | следующая лекция ==> |
| Польові транзистори з ізольованим затвором. | | | Методика проведения анализа экономических результатов деятельности и оценка эффективности операционной деятельности предприятия |
Дата добавления: 2016-04-19; просмотров: 640;
