Ингибиторы синтеза белка и клеточного деления
Процессы синтеза белка и клеточного деления необыкновенно сложны. Механизмы, посредством которых токсиканты способны воздействовать на них - многообразны (см. раздел “Общая токсикология. Общие механизмы цитотоксичности”). При этом условно вещества, нарушающие процессы, можно подразделить на две группы. Представители первой группы взаимодействуют с нуклеиновыми кислотами ядра клетки (образуют аддукты), повреждая ее генетический код и нарушая механизмы репликации. Поражение такими веществами сопровождается повреждением преимущественно делящихся клеток, нарушением пролиферации клеточных элементов. Соединения другой группы действуют на этапах транскрипции и трансляции генетической информации. Поэтому основным видом нарушения является угнетение синтеза белка. Наиболее чувствительными к этим ядам являются органы с высокой интенсивностью пластического обмена.
11.1.1. Ингибиторы синтеза белка и клеточного деления,
образующие аддукты ДНК и РНК
К числу веществ рассматриваемой группы относятся яды, образующие при интоксикациях прочные ковалентные связи с азотистыми основаниями нуклеиновых кислот. Среди ОВТВ это, прежде всего, сернистый и азотистый иприты и их аналоги. При изучении нуклеиновых кислот, выделяемых из поврежденных этими токсикантами клеток, в пробах выявляются комплексы остатка молекулы токсиканта и пуриновых (пиримидиновых) оснований. Такие комплексы получили название аддуктов. При взаимодействии с нуклеиновыми кислотами ипритов (сернистого, азотистого) и их аналогов, образуются аддукты, содержащие алкильные радикалы (фрагменты молекулы яда, представляющие собой алкильную группу). По этой причине вещества называют также алкилирующими агентами. Помимо нуклеиновых кислот алкилирующие агенты способны взаимодействовать с белками, пептидами и молекулами иного строения. В этой связи механизм их токсического действия сложен и не ограничиваются повреждением только генетического аппарата клеток.
Иприты
Один из первых представителей галогенированных тиоэфиров, 2,2-дихлордиэтилсульфид, был впервые синтезирован в 1822 г. Депре. В чистом виде соединение было выделено и изучено в 1886 г. Виктором Мейером в Геттингене. Им же дано и первое описание некоторых сторон пагубного действия этого вещества на человека и животных, выявившегося в процессе работы с соединением. Опыты проводились при непосредственном участии практиканта, русского химика Н.Д. Зелинского, который получил сильное поражение токсикантом, что послужило поводом для более детального изучения его токсических свойств.
В ходе 1-й Мировой войны, в июле 1917 г. возле города Ипр английские войска были обстреляны немецкими минами, содержащими 2,2-дихлордиэтилсульфид. ОВ, названное “ипритом”, заражало местность, быстро проникало через одежду, вызывало поражение кожи. Так в историю войны вошел еще один тип отравляющих веществ, получивших название ОВ “кожно-нарывного действия”. Позже ОВ использовали итальянцы в ходе итало-абиссинской войны (1936 г.). Во время второй мировой войны (1943) его применяла в Китае японская армия. В 80-е годы 20-го века вещество вновь использовалось в качестве ОВ в ходе Ирако-Иранского военного конфликта. Из изученных галогенированных тиоэфиров иприт является самым токсичным агентом.
В 1934-35 гг. Уорд исследовал хлорированные этиламины и среди третичных производных этого ряда обнаружил новый вид веществ, вызывающих воспалительные процессы в коже. В результате исследований были получены данные, указывающие на возможность создания на основе органических соединений азота новой группы ОВ. Во время второй мировой войны в Германии третичные хлорэтиламины синтезировали в производственном масштабе и сохраняли в автоцистернах, предполагая использовать для заражения местности. Обнаруженные в 1945 году в Германии запасы 2,2,2-трихлортриэтиламина составляли около 2000 тонн. Из-за сходства молекулярной структуры трихлортриэтиламина с ипритом (рис. 35) и аналогичного физиологического действия вещество получило название “азотистый иприт”.
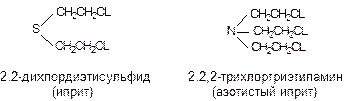
Рисунок 35. Структура сернистого и азотистого ипритов
Позже были изучены и аналоги азотистого иприта: метил-дихлорэтиламин, этил-дихлорэтиламин и т.д. Эти соединения обладали токсичностью близкой токсичности исходного вещества. В качестве ОВ в ходе боевых действий трихлорэтиламин и его аналоги не использовались.
В соответствии с Конвенцией о запрещении химического оружия (1993) запасы сернистого и азотистого иприта, странами, имеющими вещества на снабжении армий, должны быть уничтожены. Однако опасность поражения людей этими соединениями или их аналогами сохраняется. Так, на основе хлорэтиламинов созданы высокоэффективные цитостатики - лекарственные препараты, применяемые для лечения опухолей (циклофосфамид, мехлорэтамин, хлорамбуцил, мелфалан) и других форм патологии. В настоящее время эти вещества производятся в большом количестве и достаточно широко применяются в клинической практике. Многочисленные серу-, азот- и кислородсодержащие органические соединения с близким механизмом токсического действия широко используют в промышленности (этиленимин, этиленоксид и т.д. Широкое применение алкилирующих агентов в хозяйственной деятельности, их доступность, делают возможным применение веществ с террористическими целями.
Поскольку свойства, биологическая активность сернистого и азотистого ипритов и их аналогов во многом совпадают, токсикологическую характеристику веществ целесообразно представить на примере табельного ОВ - сернистого иприта, с указанием особенностей свойств наиболее токсичного представителя галогеналкиламинов - азотистого иприта.
Физико-химические свойства. Токсичность
Основные свойства сернистого и азотистого ипритов представлены в таблицах 32 и 33.
Таблица 32.
Дата добавления: 2016-04-14; просмотров: 682;
