Выход продуктов нитрования многопроизводных бензола
| Заместитель Х | Процент ориентации | ||
| орто- | мета- | пара- | |
| СН3 С(СН3)3 Сl NO2 | 56,5 12,0 29,6 6,4 | 3,5 8,5 0,9 93,2 | 79,5 68,9 0,3 |
В порядке возрастания ориентирующего влияния группы ориентантов располагаются так:
1-го рода: Hal < CH3 < CH2R < CR3 < OR < OH < NH2 < NHR;
2-го рода: COOR < COOH < CHO < SO3H < CN < NO2.
6.2.2. Химические свойства
1. Реакции электрофильного замещения
 HONO2
HONO2
 C6H5 – NO2 (нитрование)
C6H5 – NO2 (нитрование)
(H2SO4)(–H2O)
HOSO3H
C6H5 – SO2H (сульфирование)
(SO3)(–H2O)
Сl2
C6H5 – Cl (хлорирование)
(FeCl3)(–HCl)
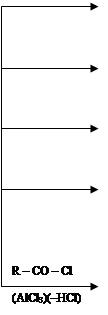
R – Сl
C6H5 – R (алкилирование
(AlCl3)(–HCl) по Фриделю–
Крафтсу)
|
|
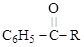
Реакции с производными бензола идут легче, чем с самим бензолом. Место вхождения второго заместителя в бензольное ядро определяется типом ориентирующего влияния уже имеющегося заместителя.
Реакции протекают в несколько стадий. Сначала молекула реагента превращается в электрофильную (ЭФ+) атакующую частицу (нитроний – катион 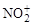 ; гидросульфоний – катион
; гидросульфоний – катион 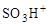 ; хлор – катион Cl+; карбкатион R+; ацил – катион R–CO+), например:
; хлор – катион Cl+; карбкатион R+; ацил – катион R–CO+), например:
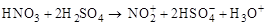 ;
;
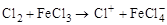 .
.
Образовавшийся катион притягивается секстетом p-электронов молекулы бензола с образованием p-комплекса. Затем происходит разрушение секстета, два из шести электронов, локализуясь у одного из С-атомов, образуют s-связь с заместителем. Этот атом углерода переходит из sp2- в sp3-состояние. Оставшиеся 4 электрона распределяются между пятью углеродами бензольного ядра. Образуется фенониевый катион (s-комплекс) – реально существующее соединение, образование которого доказано:
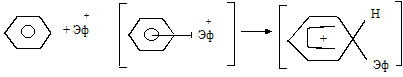
|
Далее образовавшийся s-комплекс легко теряет протон (при участии основания), переходя в ароматическое состояние:
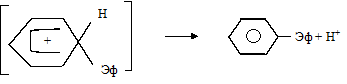
s-комплекс бензол-производное
Отщепившийся протон связывается основанием:
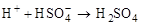 ;
;  .
.
В реакциях галогенирования, алкилирования и ацилирования роль создателя атакующего катиона берет на себя катализатор (FeCl3; AlCl3; AlBr3 и др.).
В присутствии кислот H2SО4; H3PO4; HF; BF3 бензол и его гомологи алкируются алкенами (или алкены фенилируются):
 |
Н

бензол пропилен кумол
Механизм может быть представлен так:
а) 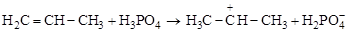 ;
;
карбокатион
 |
б) 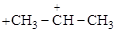
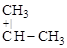
p-комплекс
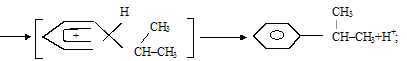
s-комплекс кумол
в) 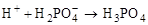 .
.
2. Реакции присоединения
а) Каталитическое гидрирование:
 R R
R R
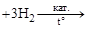
алкил-бензол алкил-циклогексан
В качестве катализатора – Ni, Pt, Pd. Температура – в зависимости от катализатора и вида гидрируемого арена.
б) Галогенирование
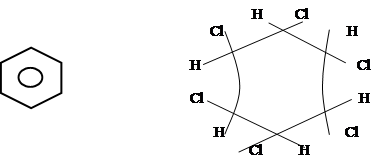 |
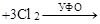
[1,2,3,4,5,6-гексахлорциклогексан] (гексахлоран)
3. Реакции окисления
Сам бензол весьма устойчив к окислению: в стандартных услових не взаимодействует с Н2О2, с хромовой смесью, с KMnO4 в кислой среде. При жестком окислении происходит разрушение бензольного кольца.
 а) Озонолиз бензола:
а) Озонолиз бензола:






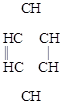
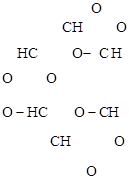
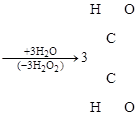
бензол триозонид бензола глиоксаль
б) Окисление гомологов бензола
При действии окислителей на алкилзамещенные бензолы образуются ароматические кислоты с карбоксилами по местам нахождения алкилов. Если алкил более длинный, чем метил, из второй части образуется карбоновая кислота с соответствующим числом углеродов в цепи.


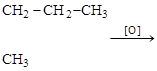
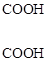 +CH3COOH.
+CH3COOH.
орто-пропилтолуол (орто)фталевая этановая
кислота кислота
Если в a-положении боковой цепи есть ответвление, образуется ароматический кетон:
 | |||
 | |||
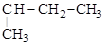
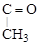 + CH3COOH.
+ CH3COOH.
(втор-бутилбензол) (метилфенилкетон) (уксусная
кислота)
в) Горит бензол коптящим пламенем:
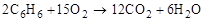 .
.
4. Галогенирование бензол-производных в зависимости от условий проведения реакции
Вариантов реагирования производных бензола – три:
а) замещение в бензольном ядре происходит в присутствии катализатора (AlCl3; FeCl3; H3PO4 и др.);
б) реакции боковой цепи идут при нагревании в отсутствие катализатора;
в) при УФО происходит присоединение галогена с образованием производных циклогексана
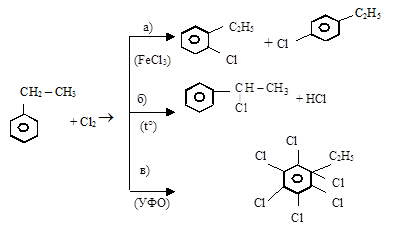
5. Дегидрирование алкилбензолов широко применяется для получения стирола и изопропенилбензола:

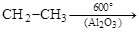
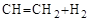 .
.
этилбензол винилбензол (стирол)
6.3. Многоядерные арены
Многоядерными ароматическими соединениями называются вещества, содержащие два или большее число связанных между собой бензольных ядер. Различают изолированные и конденсированные многоядерные арены.
6.3.1. Многоядерные арены с изолированными ядрами
В этих молекулах бензольные ядра не имеют общих атомов углерода. Наибольшее практическое значение имеют дифенил, дифенилметан, трифенилметан и их производные
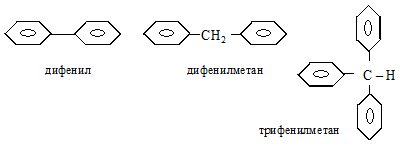
Это низкоплавкие (27…92ºС) и высококипящие (250…360ºС) кристаллические вещества, по химическим свойствам схожие с бензолом и его гомологами. Дифенил получают дегидрированием бензола при пропускании его паров через расплавленный свинец:
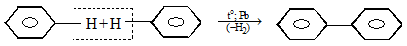
Применяется в производстве красителей и как высококипящий теплоноситель.
Ди- и трифенилметаны получаются по Фриделю–Крафтсу:
 |
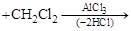 СН2
СН2
Оба широко используются в производстве красителей. Красители трифенилметанового ряда: фуксин, фенолфталеин и др. Дифенилметан (Т пл. = 27 ºС) еще используется как растворитель в лако-красочной промышленности и для отдушки мыла.
6.3.2. Многоядерные арены с конденсированными
ядрами
В этих молекулах бензольные ядра имеют общие атомы углерода. Важнейшими являются нафталин, антрацен, фенантрен.
НАФТАЛИН – бесцветные кристаллы с характерным запахом, Т пл. = 80 ºС; Т кип. = 218 ºС.
Состав установлен А.А. Воскресенским (1858), строение –
Р. Эрленмейером (1866). Молекула имеет плоское строение, а
p-электронное облако распределено в ней менее равномерно, чем в бензоле. Поэтому нафталин имеет два монозамещенных изомера (a и b):
 |
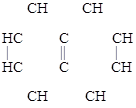
Гидрируется легче, чем бензол:
 |
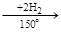
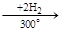 °
°
нафталин (С10Н8) тетралин (С10Н12) декалин (С10Н18)
Тетралин и декалин используются как органические растворители.
Окисляется нафталин с образованием фталевого ангидрида:



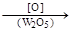
 + H2O + CO2
+ H2O + CO2
нафталин фталевый ангидрид
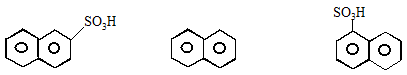 Хлорирование и нитрование дают соответственно a-хлорнафталин и a-нитронафталин. Сульфирование, в зависимости от условий, дает разные продукты:
Хлорирование и нитрование дают соответственно a-хлорнафталин и a-нитронафталин. Сульфирование, в зависимости от условий, дает разные продукты:
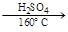
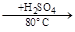
b-нафталинсуль- нафталин a-нафталинсуль-
фокислота фокислота
АНТРАЦЕН – бесцветные пластинчатые кристаллы. Т пл. = 216 ºС, Т кип. = 351 ºС, мало растворим в большинстве органических растворителей.
|
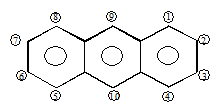
По химическим свойствам антрацен значительно отличается от бензола и нафталина. Здесь наиболее реакционноспособны
g-положения, где не только легко идет замещение, но и присоединение, совсем не характерное для аренов:
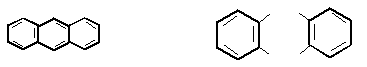
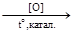

антрацен антрахинон
Антрахинон и его производные используются в качестве кубовых красителей.
Получают нафталин и антрацен из каменноугольной смолы после коксования. То же и ФЕНАНТРЕН (изомер антрацена):
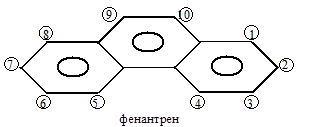
Это бесцветные кристаллы c Т пл. = 100 ºС. Фенантреновая структура входит в состав молекул многих биологически активных соединений: стероидов, витаминов, гормонов, – циклопентаногидрофенантрен – стероидное ядро.
Существуют также арены с бльшим (чем три) числом конденсированных бензольных ядер:
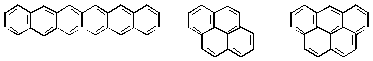
гексацен пирен 1,2-бензпирен
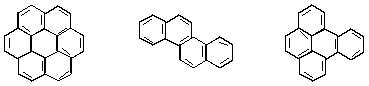
коронен хризен 4,5-бензпирен
Основной источник получения этих соединений – каменноугольная смола. Кроме того, они часто образуются как побочные продукты при пиролизе нефти и содержатся в выхлопах ДВС (особенно дизельных).
Входят в состав некоторых лекарств и используются как сырье для получения красителей.
Некоторые (в частности, бензопирены) являются канцерогенами (от cancer – рак).
6.4. Получение и применение аренов
Основные источники получения – нефть и продукты сухой перегонки (коксования) каменного угля. Выделение ароматических углеводородов из каменноугольной смолы – наиболее старый и до 50-х годов основной способ их получения. При нагревании выше 1000 ºС без доступа воздуха уголь разлагается с образованием твердых (кокс), жидких (каменноугольная смола, аммиачная вода) и газообразных (коксовые газы) продуктов перегонки.
Кокс – в основном углерод; применяется в металлургии.
Газы коксования – H2, CH4, CO, CO2, N2, этиленовые углеводороды.
Каменноугольная смола – содержит большое количество органических соединений различной природы. Выход смолы около 3 %. На первом этапе ее перегоняют на 4 фракции (табл. 11).
Т а б л и ц а 11
Дата добавления: 2016-04-14; просмотров: 1624;
