И ИЗМЕНЧИВОСТИ У ЧЕЛОВЕКА
Человек как вид является продуктом биологической эволюции. Процесс возникновения вида Homo sapiens и длительное существование его на Земле, так же как и других видов, обусловлены реализацией таких свойств живого, как наследственность и изменчивость. Важнейшим доказательством родства Человека с другими живыми организмами, населяющими Землю, является в первую очередь сходство химической и морфологической организации их наследственного материала, способа записи наследственной информации и ее использования. Большое сходство наблюдается также в спектре белков, образуемых в организме человека и высших животных, например человекообразных обезьян.
Как у большинства видов, наследственная программа развития, записанная в молекулах ДНК с помощью универсального триплетного кода, организована у человека главным образом в его кариотипе. Хромосомный набор вида Homo sapiens состоит из 23 пар хромосом, содержащих 30—40 тыс. генов. Изучение структуры кариотипа и отдельных хромосом с использованием методик дифференциального (избирательного) окрашивания показало, что характер распределения красителя в разных хромосомах сходен у человека и человекообразных обезьян — шимпанзе и гориллы, имеющих 24 пары хромосом. Это сходство позволило сделать вывод, что одна из крупных хромосом человеческого кариотипа, очевидно, появилась в результате слияния двух акроцентрических хромосом обезьяноподобного предка (см. разд. 3.5.3.3).
Изучение процессов мутагенеза обнаружило, что отдельные гены человека могут изменять свою структуру с частотой, соизмеримой с таковой у других живых организмов (10-5—10-6 на один ген на поколение). Правда, в силу социальности человек создает в ходе своей деятельности новую среду с более высокими дозами и более широким спектром мутагенов, что не может не сказываться на интенсивности мутационного процесса в наследственном материале не только человечества, но и других видов живых организмов.
Таким образом, молекулярно-генетические механизмы обеспечения наследственности и изменчивости у человека имеют много общего с таковыми у других видов. Это делает возможным использование сведений, получаемых в ходе экспериментов на животных, для изучения наследственности и изменчивости у человека.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ НАСЛЕДСТВЕННОСТИ И ИЗМЕНЧИВОСТИ
У ЧЕЛОВЕКА
Благодаря большому объему человеческого генома и более низкому давлению естественного отбора, связанному с социальной природой человека (см. § 1,9), в генофонде человечества за тысячелетия его существования в результате постоянно идущего мутационного процесса накоплено большое число аллелей многих генов. Это является причиной формирования у людей разнообразных вариантов признаков и свойств как на структурном, так и на биохимическом уровнях. В основе индивидуальных различий по многим белкам лежат изменения соответствующих генов. Изучение аминокислотного состава вариантов белков человеческого организма, интенсивности их синтеза, функциональной активности дает ценные сведения об организации и экспрессии его наследственного материала.
Удобной моделью для изучения молекулярно-генетических механизмов наследственности и изменчивости у человека является гемоглобин — специфический белок эритроцитов, легко выделяемый из организма без применения трудоемких биохимических методик. В результате длительного изучения этого белка накопилось много фактов, свидетельствующих об изменчивости его первичной структуры и свойств. В настоящее время обнаружено около 400 различных разновидностей гемоглобина, встречающихся как в нормальном развитии на разных стадиях онтогенеза, так и приводящих к различным заболеваниям.
Молекула гемоглобина состоит из четырех полипептидных цепей (двух α- и двух β-цепей), каждая из которых соединена с небелковым компонентом — гемом, содержащим железо. Две названные полипептидные цепи имеют варианты, контролируемые разными, но близкими нуклеотидными последовательностями, которые образуют два семейства генов (см. разд. 3.6.4.3). Различные нуклеотидные последовательности экспрессируются на определенных стадиях индивидуального развития — у эмбриона, плода, после рождения (см. § 6.2). При этом полипептиды, сменяющиеся в зависимости от стадии онтогенеза, незначительно различаются по аминокислотному составу. Так, Aγ и Gγ-глобины различаются по одной аминокислоте в 136-м положении (аланин или глицин). Вариант Aγ-глобина (TAγ) в 75-м положении вместо изолейцина имеет треонин. Цепь δ отличается от β-цепи лишь десятью аминокислотными остатками.
Из многочисленных мутаций гемоглобина большинство достаточно редки и лишь немногие из них встречаются чаще других, например HbS, HbC, НЬЕ. Большая часть вариантов гемоглобина (около 350) различается единичными аминокислотными заменами, причиной которых являются генные мутации, связанные с заменой оснований в нуклеотидных последовательностях α- или β-глобинового семейства. Многие аминокислотные замены существенно не влияют на функцию гемоглобина и не приводят к патологическим проявлениям. Как правило, это замены в обращенных наружу участках полипептидных цепей тетрамера.
Замены аминокислот, нарушающие нормальную спиральную структуру цепей, часто вызывают неустойчивость гемоглобина. Замена в участках, которыми α- и β-цепи контактируют друг с другом, влияют на сродство гемоглобина к кислороду. Нарушения функций гемоглобина, возникающие в результате таких изменений структуры α- и β-глобиновых генов, ведут к появлению заболеваний, которые можно разделить на четыре основные группы.
1. Гемолитические анемии. Проявляются в распаде эритроцитов, зависящем от неустойчивости гемоглобина (описано около 100 вариантов нестабильных гемоглобинов с мутациями в гене β-цепи).
2. Метгемоглобинемии. Обусловлены ускоренным окислением двухвалентного железа до трехвалентного и образованием гемоглобина М (известны пять таких мутаций в генах α- и β-цепей, состоящих в замене одного основания).
3. Эритроцитоз. Заключается в образовании большего, чем обычно, количества эритроцитов, что обусловлено повышенным сродством гемоглобина к кислороду, который с трудом высвобождается в тканях (таких мутаций известно около 30).
4. Серповидно-клеточная анемия. Заключается в замене гемоглобина НЬА на HbS, который отличается растворимостью и кристаллизацией в условиях гипоксии, что приводит к изменению формы эритроцитов, и проявляется фенотипическим многообразием симптомов (см. рис. 3.21).
Заболевания первых трех групп наследуются по доминантному типу, так что гетерозиготы по мутантному гену страдают нарушением здоровья. Наследование серповидно-клеточной анемии при обычных условиях осуществляется по рецессивному типу, но в условиях сильной гипоксии, например при нахождении на высоте свыше 3000 м над уровнем моря гетерозиготы НbА HbS также страдают анемией.
Описанные мутантные формы гемоглобина возникают в результате изменений структуры генов по типу замены оснований. Мутации иного характера приводят к появлению аллелей глобинов, обусловливающих другие виды патологии. Так, нарушение процесса рекомбинации между аллельными генами (неравноценный кроссинговер) приводит к изменению числа нуклеотидов в них. Следствием этого может быть сдвиг рамки считывания. Нередким результатом таких структурных изменений генов является подавление синтеза той или иной цепи гемоглобина, приводящее к развитию патологических состояний, известных под общим названием талассемии.
Деления одного нуклеотида в 139-м триплете α-глобинового гена, состоящего из 141 триплета, приводит к сдвигу рамки считывания и прочитыванию в новой рамке терминирующего 142-го кодона. При этом (α-глобиновая цепь удлиняется на пять дополнительных аминокислот. Такой особенностью α-цепей характеризуется гемоглобин Vayne. Когда деления располагается ближе к 5'-концу, активный продукт не синтезируется и развиваются различные формы α-, β- и γ-талассемий.
Некоторые варианты гемоглобинов возникают в результате дупли-каций. Так, гемоглобин Grady несет дупликацию 116—118 аминокислотных остатков в γ-цепи. В гемоглобине Cranston удлинение р-цепи до 158 аминокислотных остатков является результатом дупликации AG-последовательности после 144-го триплета и последующего сдвига рамки с пропитыванием терминального кодона.
Описанное выше свидетельствует о том, что различные отклонения в структуре ДНК глобиновых генов приводят к замене аминокислот или удлинению полипептидных цепей. Это является причиной образования многих вариантов гемоглобина, которые определяют развитие у человека заболеваний, наследующихся в ряду поколений.
Не меньший интерес представляют механизмы развития различных заболеваний человека, в основе которых лежат мутации генов, приводящие к синтезу белков-ферментов со сниженной активностью или к его подавлению. Это нарушает течение процессов, катализируемых данными ферментами в клетках организма. Примером наследственно детерминированных повреждений метаболизма в организме человека служит фенилкетонурия, развивающаяся вследствие нарушения процессов обмена аминокислоты фенилаланина и накопления в организме токсических промежуточных продуктов.
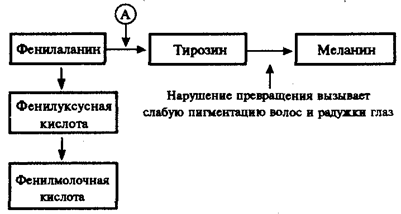
Рис. 4.1. Краткая схема обмена фенилаланина:
А — фермент фенилаланингидроксилаза, наследственный дефект которого приводит к развитию фенилкетонурии
При дефекте фермента фенилаланингидроксилазы фенилаланин не превращается в тирозин (рис. 4.1) и накапливается в крови больных в больших концентрациях (до 0,5—0,6 г/л вместо 0,003— 0,04 г/л в норме). Это приводит к частичному превращению фенилаланина в фенилуксусную и фенилмолочную кислоты, накопление которых наряду с повышенной концентрацией самого фенилаланина оказывает токсическое действие на мозг ребенка. В результате у детей наблюдается различная степень дефекта умственного развития. Нарушение метаболизма фенилаланина сопровождается также нарушением синтеза пигмента меланина, поэтому у больных наблюдается слабая пигментация волос и радужки глаз. Кроме того, высокая концентрация фенилаланина оказывает ингибирующее влияние на ряд ферментных систем, участвующих в превращении других аминокислот: у больных развивается судорожный синдром, нарастает отставание интеллектуального развития. Наследование фенилкетонурии осуществляется по рецессивному типу.
Таким образом, рассмотренные выше примеры демонстрируют весь спектр действия молекулярно-генетических механизмов, обеспечивающих образование в человеческом организме белков как нормально функционирующих, так и обусловливающих развитие различных патологических состояний. Из сказанного по поводу гемоглобина следует, что, во-первых, образование главного функционального белка эритроцитов находится под генным контролем, во-вторых, формирование тетрамерной формы этого белка, с которой связана его физиологическая активность, требует взаимодействия неаллельных генов α- и β-глобинов.
Специфический контроль небелковой части молекулы гемоглобина также имеет место и осуществляется независимо, через гены ферментов, необходимых для синтеза гема. Особенности проявления патологических признаков у носителей мутантных аллелей свидетельствуют о существовании определенных отношений между ними и нормальными аллелями. Так, аллель серповидно-клеточности в сочетании с нормальным аллелем (3-глобина (НbА HbS) проявляет себя в обычных условиях как рецессивный. Так же ведет себя мутантный аллель гена, детерминирующего синтез фермента фенилаланингидроксилазы. Проявлением взаимодействия между мутантным и нормальным аллелями по типу доминирования последнего является формирование в организме белка с нормальными свойствами у гетерозигот. Отсутствие нормального аллеля в генотипе организма, гомозиготного по мутантному аллелю, приводит к развитию патологического состояния, обусловленного нарушением функциональной активности соответствующего белка.
Особую группу наследственно обусловленных патологических состояний у человека представляют заболевания, причиной которых являются мутации митохондриальной ДНК (мгДНК).
Биосинтез митохондриальных белков находится под контролем двух генетических систем: ядерных и митохондриальных генов. Большая часть белков кодируется ядерной ДНК, синтезируется в цитоплазме, а затем транспортируется в митохондрии. Наряду с этим в кольцевой молекуле ДНК органеллы имеются гены, которые отвечают за собственный синтез белков, а также участвующих в нем тРНК и рРНК. В ядерном геноме имеется значительное количество генов, обеспечивающих функционирование митохондриальной ДНК. Предполагают, что мутации некоторых ядерных генов приводят к делениям значительных участков ДНК митохондрии. В результате нарушается синтез собственных белков, к числу которых относятся и ферменты дыхательных цепей, нарушается дыхательная функция митохондрии.
У человека описано более 100 заболеваний, причиной которых являются изменения в структуре мтДНК (см. 6.4.1.4).
Дата добавления: 2016-04-11; просмотров: 603;
