Исследование спектров флуоресценции
Исследование спектров флуоресценции - зависимости интенсивности излучения от длины
волн I=f(лямбда) - позволяет проводить качественный и количественный анализ различных компонентов в биологических и модельных системах, изучать их состояние, (например, агрегацию, комплексообразование и т.д.) и взаимодействие с другими соединениями.
По положению максимума (нм, см-1) в спектре флуоресценции можно судить о величине
кванта энергии, запасаемой в молекуле данного компонента системы, а сопоставление
спектров флуоресценции и поглощения дает информацию о миграции энергии
(межмолекулярном переносе энергии возбуждения в системе). Величина квантового выхода флуоресценции, представляющего собой отношение числа квантов флуоресценции к числу поглощенных квантов фи=n фл/nпогл, позволяет определить время жизни возбужденного состояния молекул компонента. Скорость затухания флуоресценции позволяет судить о времени сохранения энергии возбуждения в молекуле, что в сочетании со значениями квантовых выходов и скоростями тушения флуоресценции дает возможность проанализировать процессы растраты и миграции энергии.
Флуоресценция возникает при переходе молекулы с самого нижнего колебательного
подуровня первого синглетного возбужденного состояния на основной:
S1*→ S0 + hv. Излучательный переход в молекуле происходит на разные колебательные
подуровни основного состояния, а поглощательный – с основного почти на какой угодно возбужденный уровень. Таким образом, энергия поглощенного кванта всегда больше, чем энергия кванта флуоресценции, а спектр флуоресценции будет расположен в более длинноволновой области, чем самый длинноволновый максимум в спектре поглощения (закон Стокса). Очевидно, что поскольку высвечивание квантов флуоресценции происходит с самого нижнего колебательного подуровня возбужденного первого синглетного состояния, спектр флуоресценции не зависит от длины волны возбуждения (закон Вавилова).
Длительность жизни молекулы в синглетном возбужденном состоянии обычно составляет 10-8 - 10-9 с . Интенсивность флуоресценции вещества можно описать следующим выражением:
I= K*I0 (1-T)*фи,
где I0 - интенсивность возбуждающего света, (1-T) - поглощение, а фи - квантовый выход
флуоресценции, К – коэффициент пропорциональности.
Измерение спектров флуоресценции и кинетики ее изменения обычно производятся на
установке, принципиальная блок-схема которой представлена на следующем рисунке1:
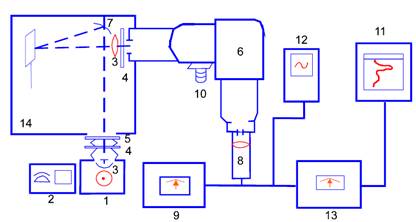
1. Источник возбуждающего света. 2. Автотрансформатор. 3. Линза. 4. Светофильтр. 5. Фотозатвор. 6. Монохроматор. 7. Зеркало. 8. Фотоумножитель.9. Высоковольтный источник питания. 10. Мотор барабана длин волн. 11. Самопишущий потенциометр.
12. Осциллограф. 13. Усилитель. 14. Кюветная камера.
Для выделения необходимого спектрального интервала возбуждения перед кюветной
камерой устанавливается светофильтр, пропускающий свет в сине-зеленой области
(лямбда≤580нм). Для быстрого включения и выключения возбуждающего света используется фотозатвор.
Фокусировка возбуждающего света на объект, помещенный в специальном держателе,
осуществляется вогнутым зеркалом, установленным на стенке камеры. Свет флуоресценции от объекта фокусируется на щель монохроматора линзой.
Для того чтобы избавиться от рассеянного возбуждающего света, который может попасть в монохроматор вместе с измеряемым светом флуоресценции, применяют, так называемые, «скрещенные» светофильтры. Перед входной щелью монохроматора помещают светофильтр, не пропускающий возбуждающий свет, но пропускающий свет в области флуоресценции объекта. С этой целью перед входной щелью монохроматора установлен «красный» светофильтр, пропускающий лишь длинноволновую часть спектра ( лямбда≥630нм ). Возбуждающий свет проходит через «синий» светофильтр (лямбда≤580нм). Таким образом. Эти светофильтры оказываются «скрещенными».
Испускаемый объектом свет флуоресценции определенного спектрального состава проходит через «красный» светофильтр, попадает на призменную систему монохроматора и разлагается в спектр. Выходная щель монохроматора выделяет узкий спектральный интервал, определяемый геометрической шириной щели и дисперсией монохроматора. Узкий спектральный участок (определяемый спектральной шириной щели Δлямбда в нм) света флуоресценции из выходной щели попадает на фотокатод фотоэлектонного умножителя (ФЭУ).
Малая величина квантовых выходов и низкая концентрация флуорецирующих компонентов приводит к тому, что интенсивность флуоресценции биологических объектов ,как правило,весьма незначительна. При комнатной температуре квантовый выход флуоресценции хлорофилла в нативных фотосинтетических мембранах составляет не более 3%.
При измерении спектров флуоресценции биологических объектов следует также учитывать влияние интенсивного возбуждающего света на возможные индуцируемые им процессы фотохимически активных компонентов. Чтобы ослабить влияние возбуждения на светоиндуцируемые процессы, следует по возможности уменьшать яркость возбуждающего света на объекте за счет улучшения условий фокусировки, а также увеличивать скорость измерений и использовать низкотемпературную технику. Для решения этих задач применяют светосильные монохроматоры, чувствительные приемники света и охлаждение объектов вплоть до температуры жидкого азота (77К).
Биологические объекты, как правило, сильно рассеивают свет, что приводит к усилению
экранирующего эффекта (т.е. к увеличению поглощения возбуждающего света другими
компонентами системы) и эффекта реабсорбции (поглощения света испускаемой
флуоресценции или, так называемого, явления перепоглощения) вследствие увеличения
оптического пути. Поэтому рекомендуется, выбрав оптимальную область возбуждения
(обычно в максимуме поглощения и, если возможно, расположенного дальше от полосы
флуоресценции, например, для хлорофилла - в синей области спектра), производить
измерения в тонких слоях и при малых концентрациях. При этом надо стремиться уменьшить светорассеяние, для чего дополнительно используются специальные приемы, например, инфильтрация листьев растений, добавление глицерина к суспензии клеток, хлоропластов или хроматофоров, приготовление гомогенатов, применение специальных кювет,уменьшение светового пути в образцах и т.д.
Световая стадия фотосинтеза зеленых растений осуществляется двумя пространственно разделенными фотосистемами, которые сопряжены цепью переносчиков
электронов (рис. 2).
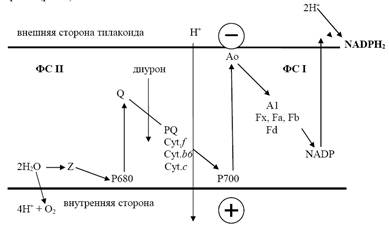 Ао - первичный акцептор ФС I – молекула хлорофилла а. Цепь переноса включает молекулу филлохинона (A1), железо-серные центры Fx, Fa и Fb и ферредоксины (Fd). Перед хиноном Q должен быть феофетин, молекулы феофетина ( на рис.1 не указана), которая затем передает электрон на молекулы хинона Q. Известно две формы акцептора Q: QA - первичный хинон и QB - вторичный хинон (на рис не указаны). В дальнейшем Р680+ восстанавливается от первичного донора Z, связанного с системой разложения воды. Перенос электронов от Q- к Р700 + осуществляется промежуточными переносчиками: пластохиноном (PQ), цитохромами (Cyt. f, Cyt. b6, Cyt. c).
Ао - первичный акцептор ФС I – молекула хлорофилла а. Цепь переноса включает молекулу филлохинона (A1), железо-серные центры Fx, Fa и Fb и ферредоксины (Fd). Перед хиноном Q должен быть феофетин, молекулы феофетина ( на рис.1 не указана), которая затем передает электрон на молекулы хинона Q. Известно две формы акцептора Q: QA - первичный хинон и QB - вторичный хинон (на рис не указаны). В дальнейшем Р680+ восстанавливается от первичного донора Z, связанного с системой разложения воды. Перенос электронов от Q- к Р700 + осуществляется промежуточными переносчиками: пластохиноном (PQ), цитохромами (Cyt. f, Cyt. b6, Cyt. c).
Транспорт электронов между фотосистемами может быть прерван ингибитором диуроном на участке от Q к РQ. Процесс переноса электрона между обеими пигментными системами осуществляется по градиенту редокспотенциала. Доля пигментов, включенных непосредственно в фотоактивный РЦ, весьма незначительна по сравнению с общей массой светособирающих (антенных) пигментов. Для высших растений один РЦ приходится на 400-500 молекул хлорофилла светособирающей антенны, а в состав
активного комплекса РЦ входит не более 6 молекул хлорофилла а.
Флуоресценция в нативных фотосинтетических мембранах продуцируется молекулами
хлорофилла антенны и при комнатной температуре характеризуется главным максимумом
при 684-687 нм и «плечом» в более длинноволновой области около 720-730 нм (для
хлоропластов и гомогенатов высших растений, для клеток водорослей). Однако в случае
целых листьев растений, вследствие сильной реабсорбции в спектрах флуоресценции
относительная доля длинноволновой полосы существенно возрастает.
Для фотосистемы 1 квантовый выход флуоресценции при комнатной температуре в
несколько раз меньше, чем для фотосистемы-2, поэтому флуоресценция хлоропластов
обусловлена в основном светособирающей массой хлорофилла второй пигментной системы.
Только при низкой температуре (77К) относительная доля (и квантовый выход)
длинноволновой флуоресценции в области 730 нм значительно возрастает и спектр
становится более структурированным (за счет выявления дополнительных флуоресцирующих центров).
Интенсивность флуоресценции целых клеток и хлоропластов чувствительна к температуре и ингибиторам фотосинтеза, а также претерпевает характерные индукционные изменения после «темновой» адаптации при включении света. Интенсивность флуоресценции в начальный период после включения возбуждающего света отличается от установившегося затем стационарного уровня флуоресценции, который достигается в течение нескольких (иногда десятка) секунд. Такая переходная кинетическая кривая изменения интенсивности флуоресценции обычно имеет сложный характер и отражает, так называемую, индукцию флуоресценции. Варьируя время темновых интервалов, можно наблюдать различные индукционные кривые флуоресценции.
Индукция флуоресценции интерпретируется обычно с точки зрения первичного механизма стабилизации энергии возбуждения и переноса электрона. Флуоресценция основной массы хлорофилла (антенны) будет изменяться в зависимости от состояния РЦ, (состояние с «закрытыми» или «открытыми» РЦ). При включении света РЦ переходит в «закрытое» состояние, когда происходит прекращение потока электронов в первичных процессах фотосинтеза. В этих условиях поглощенная энергия света уже не может использоваться в фотосинтезе, поэтому и флуоресценция хлорофилла возрастает, а затем, вследствие реакции образовавшегося первичного фотопродукта Qa- с последующими акцепторами, произойдет обратный переход РЦ в исходное («открытое») состояние, что приведет к замедлению скорости возрастания флуоресценции. Таким образом,
по кинетике флуоресценции антенного хлорофилла измеряемой на описанной выше
установке можно следить за состоянием фотохимически активных реакционных центров в
нативных фотосинтетических мембранах. Закрыть центры можно создавая также избыточную освещенность клеток, когда происходит световое насыщение фотосинтеза. Фотосинтетическая цепь переноса электрона как бы захлебывается от избытка поглощенной световой энергии, переводя все большую часть поглощенной энергии света в флуоресценцию. Предполагается, что тушителем флуоресценции антенного хлорофилла является первичный хинонный акцептор (QA), локализующийся между Р680 и феофитином с одной стороны и вторичным акцептором (Qв) с другой. Было установлено, что под действием света происходит восстановление первичного акцептора QA до QA- и выход флуоресценции возрастает от начального уровня (Fo) до максимального уровня (Fm), т.е. возникает так называемая переменная флуоресценция (Fv = Fm — Fo). При введении в систему избыточных количеств экзогенных акцепторов электрона (например, ферроцианида) выход флуоресценции сохраняется относительно низким. Если QA предварительно восстановлен в темноте, то при включении света сразу достигается максимальный уровень флуоресценции (Fm). Как правило, в нормальных условиях величина F0 мала, что говорит об активном использовании клетками энергии поглощенного света. При каких-либо воздействиях нарушается состояние фотосинтетических мембран и центры (РЦ) переходят в неактивное (закрытое) состояние. Можно полностью вывести из рабочего состояния РЦ, например при действии ингибитора потока электронов диурона. В этом случае флуоресценция сильно возрастает и приближается к своим максимальным значениям Fm.
Как видно, величина Fv соответствует той части энергии света, которая используется открытыми реакционными центрами в фотосинтезе, то есть может характеризовать активность начальных стадий фотосинтеза (Рис3). 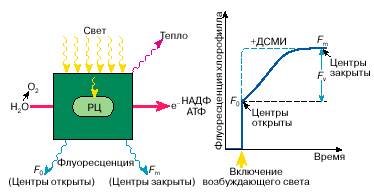
Пунктирная линия отражает изменение флуоресценции в присутствии диурона (ДСМИ). На практике оценивают отношение Fv /Fm , величина которого тесно связана с первичной продуктивностью фитопланктона в природных водоемах. Она хорошо коррелирует с фотосинтетической продукцией клеток, определенной классическими методами по восстановлению СО2 с помощью радиоактивных изотопов 14 С.
Широкий круг исследований, проводимых методами измерения флуоресценции хлорофилла фотосинтезирующих организмов, показал что соотношение интенсивности флуоресценции хлорофилла при насыщающем фотосинтез возбуждающем свете (Fm) и при облучении светом низкой интенсивности, не вызывающем изменений состояния фотосинтетического аппарата (F0), позволяет определить эффективность утилизации света в ходе фотосинтеза, которая равна (Fm - Fo)/Fm. Эта безразмерная энергетическая характеристика фотосинтеза, аналогична коэффициенту полезного действия, является универсальной и не зависит от видовой специфики организма. Показано, что по флуоресценции хлорофилла, возбуждаемой источниками импульсного света, можно определить такие показатели долгосрочной адаптации к условиям выращивания объекта, как размеры фотосинтетической антенны ФС2 и величину пула хинонов. В ответ на длительное (десятки минут) воздействие света можно определить величину потока электронов по цепи фотосинтетического электронного транспорта и оценить возможности системы срочной защиты от избыточного облучения по нефотохимическому тушению. Для исследования флуоресценции фитопланктона в природных водоемах на кафедре биофизики биологического факультета МГУ разработан специальный прибор (погружной зонд-флуориметр), позволяющий проводить измерение величин F0 и Fm в водоемах на разных глубинах (до 200 м). При освещении первой слабой вспышкой света порции фитопланктона в зонде измеряется величина фоновой флуоресценции F0 . Затем при действии второй мощной вспышки света в клетках происходит кратковременное насыщение всех РЦ, которые не успевают утилизировать поглощенную энергию света и переходят в результате этого в закрытое состояние. В этих условиях флуоресценция хлорофилла возрастает до максимальных значений Fm. Таким образом можно определить значения переменной флуоресценции Fv = Fm - F0 и отношение Fv / Fm , которые отражают эффективность запасания энергии света на начальных этапах фотосинтеза.
Поскольку величина F0 зависит от количества хлорофилла в клетках, то это можно использовать для определения его концентрации. По величине F0 можно также определять и количество биомассы фитопланктона, которое пропорционально содержанию хлорофилла в клетках. Определение величин F0 и Fv / Fm позволяет выявить ситуации, когда в водоемах имеется много фитопланктона (F0 велико), однако его активность и продукция невелика из-за неблагоприятных условий. На основании этих данных можно получить сравнительную информацию о распределении как самого фитопланктона (F0), так и его фотосинтетической активности (Fv / Fm) по глубине и горизонтальным разрезам в водоемах и рассчитать фотосинтетическую продукцию.
Другим источником информации о характере функционирования фотосинтетического аппарата является процесс замедленной флуоресценции (ЗФ), обнаруженный Арноном и Стреллером в 1951 году. Это явление состоит в том, что после светового возбуждения в фотосинтезирующих клетках наблюдается слабое, длительно затухающее свечение, испускаемое хлорофиллом. Это свечение возникает уже после прекращения флуоресценции (F0) за счет энергии, выделяемой в ходе темновых реакций первичных фотопродуктов фотосинтеза в РЦ.
В исследованиях первичных реакций фотосинтеза используют метод регистрации характеристик замедленной флуоресценции (=послесвечения). Спектральный состав послесвечения соответствует спектральному составу света, испускаемого в процессе быстрой флуоресценции антенным хлорофиллом. Время жизни быстрой флуоресценции составляет 10 в-9 – 10 в-8 с, замедленная флуоресценция может наблюдаться в течение нескольких минутпосле прекращения освещения. Быстрая флуоресценция является чисто фотофизическим процессом и обусловлена высвечиванием части поглощенной антенным хлорофиллом энергии, которая не успела мигрировать на реакционный центр. Замедленная флуоресценция тесно связана с фотохимическими реакциями, протекающими в реакционных центрах. Основной вклад в замедленную флуоресценцию растений вносит ФС II; замедленная флуоресценция ФС I составляет не более 2% от общего выхода послесвечения. На рис. 4 приведена схема реакций, приводящих к генерации послесвечения в реакционном центре фотосистемы II
зеленых растений, водорослей и цианобактерий.
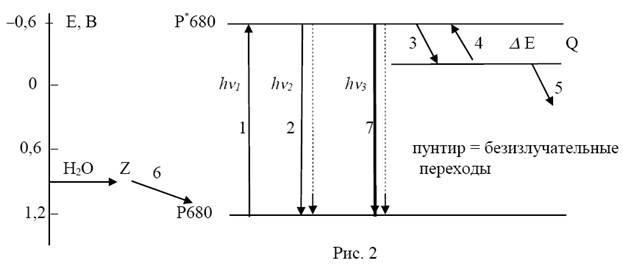
При фотовозбуждении электрон с основного уровня хлорофилла реакционного центра
Р680 переходит на синглетно-возбужденный уровень Р*680 (переход 1). С уровня Р*680
происходит или переход 2 в основное состояние (часть этих переходов сопровождается
излучением квантов света ашню2), или переход 3 на уровень первичного акцептора Q c потерей энергии на величину дельтаE и Р680+. Далее происходит перенос электрона на вторичные акцепторы (переход 5) и восстановление фотоокисленногохлорофилла реакционного центра от первичного донора Z (6). Реакциями 5 и 6 завершается цикл окислительно-восстановительных реакций, связанных с утилизацией энергии поглощенного антенным хлорофиллом кванта света.
Возможен обратный переход электрона (4) на возбужденный уровень Р680* с
последующим испусканием кванта света ашню3 (7). Этот переход сопряжен с преодолением достаточно высокого барьера энергии активации (дельтаE ~ 70 кДж/моль), поэтому вероятность обратного перехода 4 мала по сравнению с прямым переносом электрона 5 на вторичные акцепторы. Последнее обстоятельство обусловливает очень низкую интенсивность послесвечения. Таким образом, энергия, высвечиваемая в виде замедленной флуоресценции, выделяется в реакции обратного переноса электрона с восстановленного акцептора Q на хлорофилл реакционного центра Р680 (в реакции рекомбинации зарядов): Р680+ + Q- = Р680 + Q + ашню3. За счет высоких скоростей миграции энергии возбуждения между молекулами хлорофилла замедленная флуоресценция высвечивается не пигментом реакционного центра, а светособирающими молекулами хлорофилла. Именно поэтому спектры быстрой и замедленной флуоресценции идентичны. Кинетика затухания послесвечения имеет форму
сложной экспоненты, которая может быть представлена в виде суммы нескольких компонент с различным временем жизни (тау от 0,5 мс до нескольких секунд). Это свидетельствует о наличии нескольких реакций, определяющих замедленную флуоресценцию. Скорость реакции рекомбинации зависит от скорости восстановления Р680+ донором Z и окисления Q- последующими акцепторами. Количество компонент послесвечения и их время жизни сложным образом зависят от кинетики прямого и обратного транспорта электронов в ближайшем донорно-акцепторном окружении реакционного центра ФС II. Интенсивность послесвечения (I) пропорциональна скорости рекомбинации (омега) Р680+ и Q- и квантовому выходу излучения в акте рекомбинации (h). Скорость реакций рекомбинации определяется концентрацией реакционных центров в состоянии Р680+ Q-, а квантовый выход h зависит от квантового выхода энергии возбуждения Р680 при обратном переносе электронов (hвозб) и собственно квантового выхода флуоресценции (hфл):
I = h*омега=k1*hвозб *hфл*[Р680 +Q-].
Как было отмечено выше, концентрация Р680+ Q- зависит от скорости оттока электронов от реакционного центра - этим обстоятельством объясняется зависимость интенсивности и
компонентного состава замедленной флуоресценции от изменения скорости транспорта
электронов в хлоропластах растений, вызванного изменением внешних условий.
Фотоиндуцированное свечение подобно многим химическим процессам лимитировано
больцмановским фактором, в параметры которого входят энергия активации и температура. В связи с этим интенсивность послесвечения определяется соотношением:
I = hомега= k2 *hвозб *hфл [Р680+ Q-] *exp(-(дельтаE-дельтамюаш)/КТ)
Кроме того, разделенные заряды в реакционных центрах определенным образом
ориентированы в мембране, поэтому образование трансмембранного потенциала на
мембране хлоропласта (дельтамюаш) влияет на процессы прямого и обратного транспорта электронов и, соответственно, на выход послесвечения. Например, создание электрического диффузионного потенциала при быстром введении одновалентных солей металлов или наложение искусственного электрического поля на суспензию хлоропластов приводит к стимуляции замедленной флуоресценции.
Важным достоинством метода регистрации замедленной флуоресценции является
возможность получения информации от интактного объекта, что оказывается существенным, в частности, при проведении физиологических исследований в полевых условиях. Быстротаполучения информации позволяет использовать метод для экспресс-оценки устойчивости организмов к неблагоприятным факторам среды и фитотоксическим веществам. Например, применение метода в селекционной работе позволяет выявлять сортовые различия растений в устойчивости к температуре, водному дефициту, засолению, болезням, гербицидам.
При исследовании замедленной флуоресценции растений используют методы
регистрации кинетики затухания и кривых индукции миллисекундных компонент
(зависимостей интенсивности послесвечения от времени освещения образцов).
Дата добавления: 2016-04-11; просмотров: 2502;
