Роль азота в питании растений. Превращение азота в растении
Как химический элемент азот был открыт Резерфордом в 1722 г., но название ему дал А. Лавузье в 1777 г. Название происходит от греческого α – отрицательная частица – и zoo – жизнь – «не поддерживающий жизни», так как азот не поддерживает дыхания и горения. Позже было установлено, что азот – один из основных элементов, необходимых растениям. Он входит в состав аминокислот, всех простых и сложных белков, нуклеиновых кислот, играющих исключительно важную роль в обмене веществ в растениях, и передаче наследственных свойств. Азот содержится в хлорофилле, фосфатидах, алкалоидах, ферментах и во многих других органических веществах растительных клеток. Без азота рост и развитие растений невозможны.
Основными источниками азота для растений являются органические и минеральные удобрения, биологический азот, накапливаемый клубеньковыми бактериями и свободноживущими микроорганизмами, а также азот, поступающий с атмосферными осадками и семенами. Главные химические соединения, из которых растения усваивают азот – соли азотной кислоты (нитраты) и соли аммония. В естественных условиях растения потребляют нитрат-ион и катион аммония, находящиеся в почвенном растворе и в обменно-поглощенном почвенном коллоидами состоянии. Поступившие в растения минеральные формы азота проходят сложный цикл превращений, в конечном итоге включаясь в состав органических азотистых соединений – аминокислот, амидов и, наконец, белков.
Нитраты и нитриты (азотнокислые и азотистокислые соли и эфиры) не способны вступать в реакцию с кетогруппами органических карбоновых кислот, поэтому для образования аминокислот они восстанавливаются в тканях растений до аммиака. Если растения содержат достаточное количество углеводов, то нитраты восстанавливаются до аммиака еще в корнях. Процесс ферментативного восстановления нитратов, происходящий в растениях благодаря окислению углеводов, идет через ряд промежуточных соединений и катализируется несколькими ферментами:
HNО3 → HNО2 → (HNO)2 → NН2ОН → NН3.
нитрат нитрит гипонитрит гидроксиламин аммиак
На первой стадии процесса нитраты под действием фермента нитратредуктазы восстанавливаются до нитритов:
HNО3 +H2 → HNО2 + H2О.
Далее при участии фермента нитритредуктазы нитрит восстанавливается до гипонитрита:
2HNО2 +2H2 → (HNO)2 + 2H2О.
Затем под действием фермента гипонитритредуктазы присоединяются еще два атома водорода и образуется гидроксиламин:
(HNO)2 + 2H2 → 2NH2OH.
Последующее восстановление гидроксиламина при участии фермента гидроксиламинредуктазы приводит к образованию аммиака:
NH2OH +H2 → NH3 +H2O.
Ферменты, под влиянием которых нитраты восстанавливаются до аммиака, представляют собой металлофлавопротеиды. Для фермента, участвующего в восстановлении нитратов до нитритов, необходим молибден; для превращения нитрита в гипонитрит и гипонитрита в гидроксиламин – медь, железо и магний, а для перехода последнего в аммиак – марганец и магний. Из всех названных элементов особую роль в усилении процессов восстановления нитратов играет молибден.
Нитраты в растениях восстанавливаются по мере использования аммиака на синтез органических азотистых соединений. Нитратный азот способен накапливаться в растениях, не причиняя им вреда, в значительных количествах. Однако содержание нитратов в кормах, овощах и других продуктах растительного происхождения выше определенного уровня вредно для животных и человека.
В свободном виде аммиак содержится в высших растениях в незначительных количествах, чрезмерное его накопление, особенно при дефиците углеводов, ведет к отравлению растений.
Если же углеводов достаточно, аммиачный азот, поступивший в растения из почвы или образовавшийся при восстановлении нитратов, присоединяется к органическим кетокислотам – продуктам неполного окисления углеводов (щавелевоуксусной и кетоглутаровой или фумаровой), образуя первичные аминокислоты – аспарагиновую и глутаминовую:
+NH3
СООН ∙ СО ∙ СН2 ∙ СООН → СООН ∙ CH2 ∙ CHNH2 ∙ СООН
щавелевоуксусная кислота -Н2О acпapaгиновая кислота
+NH3
СООН ∙ СО ∙ СН2 ∙ СН2 ∙ СООН → СООН ∙ СН2 ∙ CH2 ∙ CHNH2 ∙ СООН
кетоглутаровая кислота -Н2О глутаминовая кислота
Этот процесс называется прямым аминированием и является основным способом образования аминокислот. Он указывает на тесную связь углеводного и белкового обменов. Все другие аминокислоты, входящие в состав белка (более 20), синтезируются переаминированием аспарагиновой и глутаминовой кислот и их амидов – аспарагина и глутамина, а также в результате других специфических реакций. В процессе переаминирования под воздействием соответствующих ферментов происходит перенос аминогрупп указанных и других аминокислот на другие кетокислоты.
Например, пировиноградная кислота, присоединяя аминную группу от аспарагиновой или глутаминовой кислоты, дает аланин. Глутаминовая и щавелевоуксусная кислоты в реакции переаминирования образуют аспарагиновую и α-кетоглутаровую кислоты.
1. СООН ∙ СН2 ∙ CHNH2 ∙ СООН + СН3 ∙ СО ∙ СООН 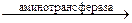
аспарагиновая кислота пировиноградная кислота
→ СН3 ∙ CHNH2 ∙ СООН + СООН ∙ СН2 ∙ СО ∙ СООН
аланин щавелевоуксусная кислота
аминотрансфераза

 2. СООН ∙ СН2 ∙ СН2 ∙ CHNH2∙ СООН+ СООН ∙ СН2 ∙ СО2 ∙ СООН
2. СООН ∙ СН2 ∙ СН2 ∙ CHNH2∙ СООН+ СООН ∙ СН2 ∙ СО2 ∙ СООН 
глутаминовая кислота щавелевоуксусная кислота
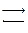 СООН ∙ СО ∙ СН2 ∙ СН2 ∙ СООН + СООН ∙ СН2 ∙CHNH2 ∙ СООН
СООН ∙ СО ∙ СН2 ∙ СН2 ∙ СООН + СООН ∙ СН2 ∙CHNH2 ∙ СООН
α-кетоглутаровая кислота аспарагиновая кислота
Переаминирование имеет большое значение для синтеза белков, а также для дезаминирования аминокислот. Дезаминирование – отщепление аминогруппы от аминокислоты, в результате чего образуется аммиак и кетокис-лота. Последняя перерабатывается растением в углеводы, жиры и другие вещества, а аммиак вновь используется для синтеза аминокислот.
Большое значение в азотном обмене принадлежит амидам – аспарагину и глутамину, которые образуются присоединением к аспарагиновой и глутаминовой кислотам еще по одной молекуле аммиака:
СООН ∙ СН2 ∙ CHNH2 ∙ СООН + NН3 =
аспарагиновая кислота
= CОNH2 ∙ СН2 ∙CHNH2 ∙ СООН + Н2О
амид аспарагиновой кислоты (аспарагин)
Как показали исследования Д. Н. Прянишникова, благодаря образованию амидов обеззараживается аммиак, накопившийся в растениях при обильном аммиачном питании и недостатке в растениях углеводов. При недостатке углеводов и, следовательно, органических кислот (особенно при прорастании семян, имеющих малый запас углеводов, например сахарной свеклы) аммиачный азот не успевает использоваться на синтез аминокислот и накапливается в тканях, вызывая их «аммиачное отравление». Растения, репродуктивные органы которых содержат большое количество углеводов (например, картофель), быстро усваивают аммиачный азот и хорошо отзываются на внесение аммиачных удобрений.
Синтез белков, состоящих из аминокислот, соединенных между собой пептидными связями, происходит с участием нуклеиновых кислот, являющихся матрицей, на которой фиксируются и соединяются аминокислоты в определенной последовательности с образованием разнообразных белковых молекул. Одновременно с синтезом в растениях происходит распад белков на аминокислоты (отщепление аммиака под действием протеолитических ферментов). В молодых растущих органах и растениях белков синтезируется больше, чем распадается; по мере старения, наоборот, расщепление идет быстрее, чем синтез. Таким образом, синтез органических веществ начинается с аммиака, а распад завершается его образованием. Как сказал Д. Н. Прянишников, «аммиак есть альфа и омега в обмене азотистых веществ в растениях».
Растения поглощают азот и синтезируют белки и другие органические азотистые вещества в течение всей вегетации, но интенсивность этих процессов в разные фазы роста и развития неодинакова.
При прорастании семян расщепляются запасные белки эндосперма или семядолей и продукты гидролиза используются для построения белков других органов растения. По мере формирования фотосинтезирующего листового аппарата и корневой системы питание растений и синтез белка происходят за счет минерального азота, поглощаемого из почвы. Наиболее интенсивно азот поглощается растениями при максимальном росте вегетативных органов – стеблей и листьев. Из стареющих частей растений, где преобладает распад белка, продукты гидролиза передвигаются в молодые растущие органы. При образовании репродуктивных органов белковые вещества вегетативных частей растения распадаются и продукты распада поступают в репродуктивные органы, где из них вновь синтезируются белки. Постепенно поглощение азота из почвы уменьшается, пока не прекращается вовсе.
Содержание азота сильно варьирует в разных растениях и органах одного и того же растения. Семена содержат больше азота, чем листья и стебли в конце вегетации. До 90 % азота входит в состав белков. Бобовые растения во всех органах содержат больше азота, чем злаковые.
При недостатке азота рост и развитие растений резко ухудшаются. Прежде и сильнее других органов страдают листья: они растут мелкие, светло-зеленого цвета, преждевременно желтеют, стебли становятся тонкими и слабо ветвятся. Ухудшается формирование репродуктивных органов и налив зерна. При нормальном азотном питании растения образуют мощные листья и стебли с интенсивной зеленой окраской, хорошо растут и кустятся, нормально формируют репродуктивные органы. В условиях избыточного азотного питания, особенно во второй половине вегетации, задерживается созревание растений, они формируют большую вегетативную массу, но мало зерна, клубней и корнеплодов. Увеличение содержания в них азотистых веществ отрицательно сказывается на хозяйственной ценности урожая. Например, при избыточном азотном питании в конце вегетации в корнях сахарной свеклы накапливается много небелковых азотных соединений, из-за чего снижается содержание сахара. Как отмечалось, при избыточном азотном питании в растениях накапливаются опасные для людей и животных количества нитратов.
Качество растениеводческой продукции зависит и от вида азотных соединений, усваиваемых растениями. При аммиачном (NH4+) питании повышается восстановительная способность растительной клетки, больше образуется восстановленных органических соединений, при нитратном (NO3-) питании, наоборот, преобладает окислительная способность клеточного сока, больше образуется органических кислот. Д. Н. Прянишников и его ученики доказали, что аммиачный и нитратный азот при определенном сочетании внешних и внутренних условий могут быть равноценными источниками питания растений.
Усвоение растениями аммиачного и нитратного азота зависит от реакции среды, концентрации в почве сопутствующих катионов, анионов и зольных элементов (фосфора, серы, калия, микроэлементов), концентрации в почвенном растворе кальция, магния, аммонийных и нитратных солей, обеспеченности растений углеводами и биологических особенностей культуры. При нейтральной реакции аммиачные соли усваиваются растениями лучше, а при кислой – хуже, чем нитратные. При аммиачном питании положительно влияет на урожай повышенная концентрация в питательном субстрате кальция, магния и калия, а при нитратном питании важное значение имеет достаточное обеспечение растений фосфором и молибденом.
Отрицательное влияние избыточной концентрации аммиачного азота в растворе наиболее вероятно при внесении азотных удобрений в рядки при посеве. Поэтому для внесения одновременно с севом лучше использовать нитратные, а не аммиачные формы удобрений и вносить их небольшими дозами.
Содержание и форма соединений азота в почве и их превращение
Основная часть азота (94 – 95 %) находится в почве в виде сложных органических соединений. В пахотном слое (25 см) почв разных типов количество его колеблется в широких пределах – от 0,05 до 0,5 % и зависит от содержания в них органических веществ: больше азота в мощных черноземах, меньше – в бедных гумусом дерново-подзолистых почвах.
В пределах одной почвенной зоны количество азота в почвах также сильно различается в зависимости от их гранулометрического состава. В дерново-подзолистых песчаных почвах содержится в среднем 0,07–0,1 % азота, супесчаных – 0,08 – 0,13, суглинистых – 0,1– 0,16, глинистых – 0,1– 0,23, в торфяных – 2,5 – 5 %. Общие запасы азота в пахотном слое 1 га могут колебаться от 1,5 т (супесчаная дерново-подзолистая) до 4 т (суглинистая почва) и зависят от степени обеспеченности почв гумусом (табл. 5.1). Запасы азота в пахотном слое торфяных почв могут достигать 16 – 20 т/га.
5.1. Градация почв Беларуси по содержанию и запасам гумуса
| Группы почв по содержанию гумуса | Содержание гумуса, % | Запасы гумуса в перегнойном горизонте, т/га |
| 1. Очень низкое | < 1,0 | < 30 |
| 2. Низкое | 1,01 – 1,50 | 31 – 50 |
| 3. Недостаточное | 1,51 – 2,00 | 51 – 70 |
| 4. Среднее | 2,01 – 3,00 | 71 – 90 |
| 5. Повышенное | 2,51 – 3,00 | 91 – 110 |
| 6. Высокое | > 3,00 | > 110 |
Среди органических соединений азота его легкогидролизуемая фракция (амиды, часть аминов, часть необменного аммония) является в агрономическом отношении наиболее ценной, так как она является ближайшим резервом в питании растений. Запасы легкогидролизуемых соединений азота в пахотных почвах с повышением окультуренности повышаются. При окультуривании легких почв интенсивность аккумуляции фракции легкогидролизуемого азота опережает интенсивность накопления общего азота.
В суглинистых почвах содержание трудногидролизуемого азота (часть аминов, амиды, необменный аммоний, часть гуминов) значительно преобладает над содержанием легкогидролизуемого, а в песчаных почвах, наоборот.
Негидролизуемый азот (большая часть аминов, гумины, меланины, битумы, остаток необменного аммония) – фракция представленная более стойкими к гидролизу и микробиологическому разложению органическими азотсодержащими соединениями – составляет большую часть валовых запасов азота дерново-подзолистых почв (80 – 82 % в слое 0 – 40 см в суглинистых и супесчаных почвах и 70 – 75 % в песчаных). Закономерности распределения в почвенном профиле негидролизуемых соединений азота в целом совпадают с распределением общего азота.
Имеются определенные различия азотного фонда в дерново-подзолис-тых избыточно увлажняемых почвах, которых в Беларуси насчитывается более 1,8 млн. га. С увеличением гидроморфности почв содержание азота в них возрастает. Запасы общего азота в метровом слое временно избыточно увлажняемых почв возрастают по сравнению с автоморфными: в суглинистых – на 27, супесчаных – на 14, песчаных – на 11 %; в глееватых соответственно – на 111, 53 и 29 %. При этом с возрастанием степени гидроморфности почв доля минерального азота снижается, а легкогидролизуемого и трудногидролизуемого возрастает. Избыточно увлажняемые почвы в отличие от автоморфных содержат больше влаги и имеют более короткий благоприятный период для процессов нитрификации.
Однако снабжение сельскохозяйственных растений азотом зависит не от общего его количества в почве, а от содержания усваиваемых растениями минеральных соединений. Но только около 1 % азота почвы находится в легкоусвояемых минеральных формах (нитратной и обменного аммония).
Наряду с обменным аммонием в почве присутствует фиксированный аммоний, который не извлекается из почвы 1 М раствором КС1. В пахотном горизонте дерново-подзолистых почв его содержится от 20 до 60 мг в 1 кг почвы (в пересчете на N), т.е. на фиксированный аммоний приходится 2–5 % общего азота почвы. В почвах связного гранулометрического состава в нижних горизонтах почвенного профиля содержание фиксированного аммония составляет уже 12–20 % общего. Фиксация ионов NH4+ обуславливается вхождением их в межпакетные промежутки кристаллической решетки почвенных глинистых минералов (вермикулита и др.) с последующим проникновением в гексагональные пустоты в сетке кислородных атомов тетраэдрических слоев. Часть фиксированного аммония может быть доступна растениям: та его фракция, которая не является структурным элементом решетки.
Таким образом, так как только 1 % азота содержится в легкоусвояемых формах, а остальная часть минерального азота (3–5 % общего) находится в фиксированной (недоступной) форме, то нормальное снабжение растений азотом зависит от скорости минерализации азотистых органических веществ. В общем виде разложение последних происходит так: белки, гуминовые вещества → аминокислоты, амиды → аммиак → нитриты → нитраты → молекулярный азот.
Процесс разложения органических азотсодержащих веществ почвы до аммиака называется аммонификацией. Он осуществляется многочисленными аэробными и анаэробными почвенными микроорганизмами, бактериями, ак-тиномицетами и плесневыми грибами. Они выделяют протеолитические ферменты, под воздействием которых белковые вещества распадаются до аминокислот. Последние легко усваиваются микроорганизмами и под действием ферментов микробных клеток (дезаминаз и дезамидаз) подвергаются дезаминированию и дезамидированию: от амино- и амидосоединений отщепляется аммиак и образуются различные органические кислоты, которые в свою очередь разлагаются до простейших соединений – СО2, Н2О, Н2, СН4. Выделившийся аммиак (NH3) образует соли с соответствующими органическими и минеральными кислотами (угольной, азотной, муравьиной, уксусной и др.), которые также получаются при минерализации органического вещества почвы:
2NH3 + Н2СО3 = (NH4)2CО3,
NH3 + HNO3 = NH4NO3.
Аммоний поглощается почвенными коллоидами:
ППК) 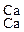 + (NH4)2CO3 = ППК)
+ (NH4)2CO3 = ППК) 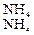 + CaCO3 .
+ CaCO3 .
Са
Аммонификация происходит во всех почвах, при разной реакции среды, в присутствии воздуха и без него, но в анаэробных условиях при сильных кислой и щелочной реакциях резко замедляется. На скорость аммонификации влияют также температура и влажность почвы, другие факторы. В анаэробных (безкислородных) условиях азотистые органические вещества разлагаются до аммиака. В аэробных условиях соли аммония окисляются до нитратов.
Процесс нитрификации выполняется группой специфических аэробных бактерий, для которых окисление аммиака является источником энергии. С. В. Виноградским установлено, что в окислении аммиачных солей до азотистой кислоты (первая фаза) принимают участие бактерии рода Nitrosomonos, Nitrosocystis и Nitrosospira, а до азотной кислоты (вторая фаза) – бактерии рода Nitrobacter. Нитрификацию можно описать следующими уравнениями:
2NH3 + О2 = 2HNО2 + 2H2O (первая фаза)
2HNO2 + О2 = 2HNO3 (вторая фаза).
Нитратная форма азота при соответствующих условиях может хорошо поглощаться растениями. Образовавшаяся в почве в результате нитрификации азотная кислота нейтрализуется бикарбонатом кальция или магния или поглощенными основаниями почвы:
2HNО3 + Са(НСО3)2 = Ca(NO3)2 + 2Н2СО3
2HNО3 + ППК) 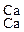 = ППК)
= ППК) 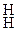 + Ca(NО3)2.
+ Ca(NО3)2.
Са
Нитрификация протекает интенсивно при хорошем доступе воздуха, 60–70% -ной влажности почвы, температуре 25–32 оС и рН КС1 6,2–8,2. Ранней весной из-за низких температур и переувлажнения почвы эти процессы протекают медленно. По мере прогревания почвы количество нитратов увеличивается, летом оно бывает максимальным, а осенью снова убывает. Известкование кислых почв, систематическое внесение органических и минеральных удобрений способствуют активизации деятельности микроорганизмов и тем самым большей минерализации органического вещества с образованием усвояемых соединений азота.
Однако образующиеся в процессе нитрификации нитраты, будучи подвижными соединениями, могут вымываться из почвы, а также подвергаться денитрификации – образованию газообразных форм азота (NO, N2O и N2), в результате чего также теряется азот почвы. В денитрификации участвует обширная группа бактерий-денитрификаторов (Bact. denitrificas, Bact. stutzer, Bact. fluorescens и др.). Этот процесс идет особенно интенсивно, если почва имеет щелочную реакцию, содержит мало воздуха, но большое количество органического вещества с большим содержанием клетчатки. В восстановлении нитратов до нитритов участвует фермент нитратредуктаза, а в дальнейшем восстановлении нитритов – нитритредуктаза. Восстановление нитратов денитрифицирующими бактериями идет через ряд промежуточных этапов.
HNО3 → HNО2 → (HNO)2 → N2О → N2.
нитрат нитрит гипонитрит закись азота молекулярный азот
Основными газообразными продуктами биологической денитрификации являются молекулярный азот и закись азота, улетучивающиеся из почвы. Кроме того, потери азота происходят из-за косвенной денитрификации или хемоденитрификации, т.е. из-за химического восстановления нитратов, образующихся в ходе нитрификации. В хемоденитрификации участие микроорганизмов ограничено разложением органического азотистого вещества до аминокислот, аммиака и азотистой кислоты. Вступая между собой в реакцию, эти соединения восстанавливают свой азот до молекулярного. Последний образуется также при химическом взаимодействии таких промежуточных продуктов окисления в процессе нитрификации, как гидроксиламин и азотистая кислота:
3NH2OH + HNО2 → 5H2О + 2N2.
Восстановление нитратов до NO, N2O и N2 возможно и при реакции их с почвенным органическим веществом, сохраняющим фенольные и хинонные группы, и при взаимодействии с ионами некоторых тяжелых металлов (Мn2+, Fe2+). Кроме того, азотистая кислота, будучи очень нестойкой, в кислых почвах (рН КС1 < 5) легко разлагается с образованием азотной кислоты и окиси азота (NO), а последняя улетучивается из почвы:
3HNO2 → 2NO + HNО3 + Н2О.
Всего в результате денитрификации теряется от 15 до 30% азота, вносимого с удобрениями.
Как показали последние исследования, азот в газообразной форме теряется также при аммонификации и нитрификации.
Одновременно с минерализацией органического вещества, нитрификацией и денитрификацией в почве происходят обратные процессы – из минеральных вновь образуются органические соединения азота, неусваиваемые растениями. Микроорганизмы углеводы и азот переводят в белок плазмы своих тел. Схема трансформации азота в почве приведена на рис. 5.1. При отмирании и разложении микроорганизмов белковый азот частично снова переходит в минеральную форму (NH3), а часть его в процессе гумификации микробного белка включается в состав образующихся в почве гумусовых веществ. Процессы мобилизации и иммобилизации азота протекают в почве одновременно. Их интенсивность и соотношение между ними в значительной степени определяют азотный режим почвы и условия азотного питания растений.
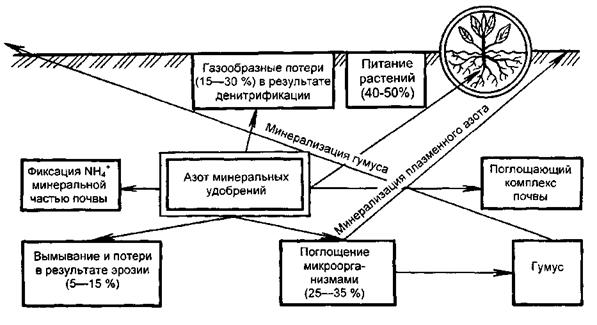
Рис. 5.1. Схема трансформации азота минеральных удобрений в почве.
Дата добавления: 2016-04-06; просмотров: 2091;
