Хромосомные мутации в гаметах человека
| Мутации | Частота мутантов (%) среди | Частота мутаций (*10 –4) в гаметах для | |||
| Спонтанных абортов | Живорожденных | Спонтанных абортов | Живорожденных | При всех исходах беременностей | |
| Балансированные | 0,28 | 0,19 | 3,99 | 1,88 | 2,20 |
| Небалансированные | 1,54 | 0,04 | 41,85 | 0,81 | 6,96 |
| Структурные перестройки в целом | 1,82 | 0,23 | 45,84 | 2,69 | 9,16 |
Методы оценки частоты возникновения хромосомных и геномных мутацийсходны с прямым методом учета доминантных мутаций, т.е. определяется число мутантов в популяции. В большинстве случаев хромосомные болезни представляют собой вновь возникшие мутации, за исключением случаев сбалансированных транслокаций, которые встречаются редко. Для установления факта унаследования хромосомных и геномных мутаций достаточно исследовать кариотипы родителей.
Частота хромосомных мутаций 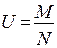
Основная трудность оценки частот возникновения хромосомных болезней состоит в том, что при многих хромосомных аномалиях организм погибает на разных стадиях онтогенеза, начиная с раннего эмбриогенеза, а мутанты концентрируются в определенных группах населения.
В этом случае частоту возникновения мутаций рассчитывают по принципу средней взвешенной: U = N1f1 + N2f2 + N3f3 + …
U – частота возникновения мутаций;
N1, N2, N3 – спонтанные аборты, мертворождения, новорождения;
f1 , f2 , f3 – частота мутантов в соответствующей группе.
Таким образом, для определения частот индуцированных мутаций необходимо определять одновременно частоту хромосомных аномалий при спонтанных абортах, мертворождениях и среди новорожденных.
Прогнозирование опасности индуцированного мутагенеза.
Необходимость прогнозирования мутагенной опасности факторов внешней среды не вызывает сомнений. Прогнозирование индуцированного мутагенеза у человека означает оценку изменения интенсивности мутационного процесса в зародышевых клетках в связи с воздействием факторов окружающей среды.
Не всегда мутагенный эффект одного и того же вещества проявляется одинаково в различных биологических объектах; на одном он четко обнаруживается, на другом отсутствует. Это не опровергает положение об универсальности индуцированного мутагенеза, поскольку разные живые существа различаются по метаболизму химических веществ.
Всякая оценка опасности факторов внешней среды для наследственности человека должна быть индуцированной и популяционной. Индивидуальный прогноз определяется только количеством химического вещества и его мутагенной активностью. Популяционный прогноз определяется числом лиц, контактирующих с мутагеном до окончания воспроизводительной функции, и дозой фактора для каждого из них. Для правильности оценки определяют среднюю популяционную дозу мутагена.
Прогнозирование мутационного процесса у человека может осуществляться двумя путями:
1. на основе аналогий с экспериментальными объектами;
2. путем экстраполяций на основе мониторинга мутационной изменчивости в популяциях человека (во времени или путем сравнения «экспонированных» и контрольных групп). Эти два подхода не исключают, а дополняют друг друга.
В настоящее время наиболее разработаны методы аналогии с экспериментальными объектами. Оценка или прогнозирование генетических эффектов действия факторов внешней среды этими методами должна основываться на экспериментально-генетических и гигиенических данных.
Экспериментально-генетические данные должны обеспечивать выполнение главных условий для правильного прогнозирования:
1. первичную идентификацию мутагенных факторов в среде;
2. последующую более строгую проверку мутагенности и установление количественных закономерностей;
3. определение «коэффициентов» экстраполяций в пределах экспериментального мутагенеза;
4. определение «коэффициентов» экстраполяций с экспериментальных объектов на человека.
Гигиенические данные необходимы для оценки динамики количества мутагенных факторов в среде обитания человека и степени подверженности их действию населения. Должна быть определена популяционная величина
«мутагенных нагрузок» от влияния разных факторов в отдельности и при их взаимодействии. В этой работе вместе с гигиенистами должны участвовать генетики, для того чтобы своевременно установить потенциальную мутагенную опасность новых факторов среды.
В связи с многосторонним изменением среды, окружающей человека, уменьшением коэффициента инбридинга, увеличением миграции населения необходимо обоснованно интерпретировать получаемые различия в частоте наследственных болезней или мутаций в разных группах населения (или во времени), т.к. они могут быть следствием не только индуцированного мутагенеза, но и других популяционных процессов. Даже стабильные частоты наследственных болезней еще не могут быть свидетельством отсутствия индуцированного мутационного процесса.
Например, во всех странах отличается снижение процента женщин, рожающих в возрасте старше 35 лет. Это приводит к существенному уменьшению частоты болезни Дауна (трисомия 21) – на 20 –50 %.
Таким образом, если в какой-то популяции частота болезни Дауна не меняется при одновременном существенном уменьшении относительного числа рожающих женщин в возрасте старше 35 лет, то это может означать, что какие-то внешние факторы индуцируют трисомию.
Количественное выражение прогноза частот наследственной патологии при условии мутагенного действия факторов внешней среды может быть разным. Возможны 4 способа такой оценки:
1. сравнение со спонтанным уровнем мутаций, то есть определение степени возрастания мутационного процесса;
2. учет абсолютного числа мутантов;
3. определение дозы, удваивающей число спонтанных мутаций;
4. определение эквивалентной дозы ионизирующих излучений, вызывающих такое же число мутаций, как и химические вещества.
Наиболее обоснована оценка, проводимая путем сравнения со спонтанным уровнем. Такой подход позволяет не только определить вклад новых индуцированных мутаций, но и представить его относительную значимость по сравнению с ранее накопленным генетическим грузом и с постоянным уровнем спонтанного мутационного процесса.
В отличие от радиации химические вещества индуцируют мутации только на определенных стадиях сперматогенеза. Химические вещества индуцируют мутации всех трех типов: генные, хромосомные, геномные. Универсального метода для обнаружения всех типов мутаций не существует. Следовательно, проверка должна осуществляться на нескольких объектах. Сначала просеивающий метод (в опытах на микроорганизмах) дает возможность качественно выявить предполагаемые мутагены. Затем они более обстоятельно проверяются в последующих тестах на млекопитающих и клетках человека, в том числе устанавливаются количественные закономерности .
В качестве примера приведем просеивающий метод учета генных мутаций у salmonella typhimurium, индуцированных химическими веществами. Этот метод предложен B. Ames и соавторами в 1973 г. Он сделал переворот в системе проверки химических веществ на мутагенность. С его помощью проведены многие тысячи исследований по проверке факторов среды обитания человека в разных странах (Sorsa M., Vainio H., 1982; Sugimura T. et al., 1982).
Принцип метода основан на том, что берутся индикаторные штаммы, которые несут мутации ауксотрофности по гистидину. Мутации, индуцированные химическим веществом, которое должно быть обязательно активировано микросомной фракцией печени и кофакторами (NaDP, глюкозо-6-фосфат), учитывают по числу обратных мутаций от ауксотрофности по гистидину к прототрофности. В геном индикаторных штаммов salmonella typhimurium введены дополнительные мутации, повышающие их чувствительность к некоторым химическим мутагенам. Если использовать 5 индикаторных штаммов (ТА 1950, ТА 1537, ТА1534, ТА100 и ТА98),то можно не только зарегистрировать факт мутации, но и определить первичный механизм действия генов. Этот набор штаммов использовался в СССР для проверки лекарственных веществ на мутагенность.
Проверка химических веществ на мутагенность может осуществляться и на других видах бактерий, в частности уже разработаны методы проверки на Eherichia coli.
Принимая во внимание специфику метаболизма химических веществ у теплокровных животных, особенно у млекопитающих, проверка их на соответствующих экспериментальных животных считается обязательной. Наиболее подходящим объектом для этого являются лабораторные мыши, как хорошо изученная генетическая модель.
Исследования мутагенеза, проводимые на мышах, в настоящее время считаются наиболее приближенными к моделированию мутагенеза у человека. Ионизирующая радиация индуцирует мутации на всех стадиях сперматогенеза, но "выход" мутаций различный в зависимости от стадии облучения. В отличие от радиации химические вещества индуцируют мутации только на определенных стадиях сперматогенеза.
Мутагенное действие факторов внешней среды на зародышевые клетки животных часто проверяют путем учета доминантных летальных мутаций у мышей. Доминантные летальные мутации – это сборная группа хромосомных, геномных и генных мутаций в родительских зародышевых клетках, которые ведут к гибели первое поколение на эмбриональной стадии развития. Мутагенный эффект оценивается по повышенной эмбриональной смертности. Для исключения «материнского эффекта» (при мутагенном воздействии на самку наряду с повреждением гамет будет влиять и повреждение организма самки) мутагеном обрабатывают только самцов и спаривают их с интактными самками. Для проверки одного мутагена требуется примерно 100 самцов и 1100 самок. Скрещивание производится на протяжении 5 недель (по 3 самки на каждого самца с заменой их новыми виргинными самками через каждую неделю). Смертность эмбрионов, у самок, забеременевших от самцов в первую неделю после воздействия мутагеном, свидетельствует о мутациях в зрелых спермиях, во вторую неделю – о мутациях в поздних сперматидах, в третью и четвертую – в периоде от ранних сперматид до поздних сперматоцитов, в пятую – в сперматоцитах. Репрезентативная группа на каждую точку (доза или контроль) должна состоять примерно из 15 животных (самцов). Самок, отсаженных от самцов, вскрывают через 15 –17 дней. Регистрируют число живых и мертвых эмбрионов, а также число мест имплантации. Уровень доминантных летальных мутаций оценивают по уровню постимплантационных потерь. Широкому применению метода учета доминантных летальных мутаций у мышей для проверки химических веществ на мутагенность способствовали его преимущества: оценка мутагена in viro, на млекопитающих, на зародышевых клетках. Однако, при специальной проверке результатов применения этого метода (James D., Smith D.M, 1982) оказалось, что, во-первых, основной тип генетических повреждений в доминантных леталях – это хромосомные разрывы (а не наследуемые генные мутации), и, во–вторых, этот метод относительно нечувствительный вследствие вариабельности эффекта в контроле и опыте. Помимо действия мутагена, на частоту эмбриональной гибели сильно влияют условия содержания, кормления, возраст животных, инфекционные заболевания и др. Поэтому при применении этого метода необходимо строго контролировать все условия, в которых проводится эксперимент.
К методам с быстрой регистрацией мутагенного действия на млекопитающих относится учет хромосомных аберраций в клетках костного мозга мышей. Клетки костного мозга интенсивно делятся. Процедуры подготовки и окрашивания препаратов простые. Спонтанный уровень хромосомных аберраций в клетках костного мозга стабильно невысокий (около 1 %).
Из других методов используется цитогенетический анализ семенников (наследуемые транслокации в F1), анализ мозаичности окраски шерсти у потомства при воздействии мутагенами на беременных самок (соматические генные мутации в эмбриональном периоде). Для учета разных типов хромосомных аномалий и генных мутаций у человека используют развитые клетки: лимфоциты периферической крови, эмбриональные фибробласты, костный мозг, эпителий волосяных фолликулов, сперматозоиды.
Наибольшее практическое распространение получили методы с применением культуры лимфоцитов периферической крови, деление которых стимулировано фитогемаглютинином (образцы крови до 0,5 мл получить нетрудно). Делящиеся в культуре Т – лимфоциты относятся к долгоживущим без деления в организме клеткам (до 1,5-2 лет), следовательно, они аккумулируют повреждения и проявляют их в культуре. Техника культивирования простая; фиксировать клетки надо в первом митозе.
Метод учета генных мутаций в соматических клетках человека основывается на двух подходах: на оценке достаточности специфических ферментов в лимфоцитах и анализе вариантов гемоглобинов и белков в эритроцитах. Метод учета генных мутаций в лимфоцитах основан на том, что мутантные клетки нормально реплицируют ДНК и растут при тех условиях, при которых нормальные клетки не могут расти, например, в присутствии в среде 6- тиогуанина (Albertini R.J., 1985).
Для оценки мутагенности химических веществ проводят также анализ спермы человека, который включает 4 теста: подсчет количества спермиев (в 1 мл эякулята), анализ их подвижности, морфологии и определения двойного У- хроматина. Учитывая, что объем эякулята, подвижность спермиев прямо не отражают мутационных событий, а в лучшем случае являются индикатором токсичных (не обязательно мутагенных) влияний физических и химических факторов, основное внимание надо уделять анализу морфологии спермиев. Этот признак является показателем генных мутаций, проявляющихся в виде изменения морфогенеза спермиев. Важность изучения морфологии спермиев для генетической оценки возникновения мутаций обусловлена следующим:
1. форма спермия, включая индивидуальные размеры, типы аномальных форм и их соотношения, характеризуют генотип сперматогенных клеток, то есть фенотип спермия в значительной степени определяется генетически. Это показано при исследовании образцов спермы, взятой от близнецов. Известны также морфологические изменения спермиев при некоторых наследственных болезнях.
2. Показано, что фракция аномальных спермиев заметно повышается вследствие воздействия на животных мутагенными физическими и химическими агентами и не увеличивается при действии немутагенных агентов.
3. Установлено, что индуцированное повышение числа аномальных спермиев может передаваться последующим поколениям в полном соответствии с законом Менделя.
Все это указывает на то, что индукция аномальности спермиев может быть генетического происхождения, и этот метод можно использовать для оценки мутагенного действия физических и химических агентов на зародышевые клетки.
Для анализа мутагенного действия достаточна оценка формы головки, поскольку вариабельность этого признака не менее других зависит от проведения технических процедур. У контрольных индивидов спонтанный уровень количества измененных спермиев можно оценить в среднем от 12 до 27 % . Примерно у одного из 20 фертильных мужчин обнаружено более 40 % аномальных спермиев. Отмечено строгое совпадение относительной встречаемости аномальных спермиев с большой, маленькой, искривленной, аморфной, двойной головкой или незрелых спермиев. При повторных исследованиях спермиев от одних и тех же мужчин в течение нескольких лет установлено, что сохраняется постоянным не только общее количество аномальных спермиев, но и тип аномалий.
Величина выборок (число обследованных) для установления повышенного уровня аномальных спермиев (Wyrobek A.J., et al., 1982) следующая: на 10 % -116 –128, на 20% - 27 – 30, на 30% - 12-13, на 40% - 7 человек, на 50% -4-5 человек, на 60% - 3 человека. Таким образом, число обследованных может быть резко уменьшено при 20-30% повышении числа аномальных спермиев. Следовательно, этот метод можно использовать для выявления мутагенности производственных вредностей.
Количество спермиев с двойным У- хроматином отражает частоту нерасхождения У – хромосомы. Для такого анализа приготавливают мазки спермы, высушивают их на воздухе, фиксируют и окрашивают флюоресцентными красителями. Спермии, имеющие Х – хромосому не содержат флюоресцирующих телец, а с У – хромосомой имеют столько телец, сколько У – хромосом.
Анализ спермы человека как метод для оценки мутагенности химических веществ имеет некоторые преимущества: оценка эффекта воздействий in viro, т.е. с учетом тестикулярного барьера, образцы для исследования получают без применения инвазивных методов, лабораторный анализ недорог и занимает мало времени, одновременно можно оценить состояние репродуктивной функции. Однако на результаты этого теста могут влиять состояние здоровья обследуемого, индивидуальные привычки. Кроме того, пока не известна наследуемость индуцированных повреждений, не ясна взаимосвязь нарушений морфологии спермиев, их количества с двойным У – хроматином с патологией эмбриона или плода.
Дата добавления: 2016-04-02; просмотров: 1053;
