1 страница. Пример 1. Рассчитайте разницу между тепловыми эффектами при постоянном давлении и постоянном объеме (Qp — Qv ) реакции С2 H4 0(г) + H2 (г) =C2 Н5 0Н(Ж)
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ. ПРОЦЕССЫ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ПРИ ПОСТОЯННОМ
ОБЪЕМЕ
Пример 1. Рассчитайте разницу между тепловыми эффектами при постоянном давлении и постоянном объеме (Qp — Qv ) реакции
С2 H4 0(г) + H2 (г) =C2 Н5 0Н(Ж) , протекающей при 298 К. Чему равна эта разница, если температуру повысить до 400 К и спирт перевести в газообразное состояние?
Решение. 1-й закон термодинамики можно выразить уравнением
ΔU = Q - Aмех
где ΔU - изменение внутренней энергии системы (U2-U1) при переходе системы из состояния "1" в состояние “2"; Q — теплота; Aмех - работа механическая, равная рΔV, где р - давление, а ΔV- изменение объема (V2-V1).
Тепловой эффект процесса, протекающего при р=const
Qp= ΔH = ΔU+pΔ , (1.1.2)
ΔH - изменение энтальпии.
Тепловой эффект процесса, протекающего при р = const
Qp-Qv=pΔV=ΔnRT,
где R - газовая постоянная = 8,3144 Дж/моль *К; Δn=n2-n1 ;
n1 и n2 - количество молей реагентов и продуктов реакции газообразных веществ; T - температура, К.
Отсюда: 1) при 298 К Qр - Qv = ΔnRT = (0-2) 8,3144-298 = -4955,38 Дж;
2) при 400 К и газообразном С2Н5ОН Qp – Qv = (1-2) 8,3144-400 = -3325,76 Дж.
Ответ при 298 К Qp-Qv = -4955,38 Дж;
при 400°К Qp - Qv= -3325,76 Дж.
Пример 2. Определить стандартную энтальпию образования
ацетилена по энергиям связей отдельных его атомов:
2С(гр) + H2 → C2H2 ; Δ Hообр .
Решение. Стандартная энтальпия (теплота) образованиям Δ Hообр - тепло, поглощенное или выделенное в процессе синтеза 1 моля соединения из простых веществ при условии, что все компоненты системы находятся в стандартных состояниях.
Верхний индекс Δ Hо здесь и в последующих случаях Δ Gо, Δ Sо, Δ Fо обозначает, что реагирующие вещества находятся в своих стандартных состояниях. Стандартное состояние для газов - это состояние идеального газа при давлении 1 атм (101330 Па) и определенной температуре. Для жидкости - это состояние чистой жидкости, а для твердых веществ — это кристаллическое состояние при тех же условиях. Строго говоря, температура должна быть точно указана в виде индекса.
Например, Δ Hо 273 , однако, если не оговорено, то стандартное состояние относится к 298 К. Образование молекулы ацетилена Н – С ≡С- Н сопровождается образованием двух связей Н - С (358,2 кДж/моль) и одной связи С ≡ С (536 кДж/моль); разрушением связи H – H (430 кДж/моль) и переходом 2C(rp) → 2-С(г) (525 кДж/моль).
Образование связи сопровождается выделением энергии, разрушение - поглощением.
Δ Hообр C2H2 = (-358,2*2)+(-536)+430+525*2=227,6 кДж/моль.
Ответ. Δ Hообр C2H2 = 227,6 кДж/моль.
Задачи
1.Вычислить разность между Qp и Qv при 298 К для реакции полного сгорания бензола С6Н6, нафталина С10 Н8 и этилена C2H4 с образованием диоксида углерода и воды в жидком состоянии.
2. Найти разность между Qp и Qv при 298 К для следующих реакций:
N2(г) + 3H2(г) ⇄ 2NH3(г) ; 2SO2(г)+O2(г) ⇄2SO3(г)
2C(гр)+O2(г)=2CО2(г); NH4CL(кp) ⇄ NH3(г)+ HCL(г).
3. Тепловой эффект реакции 1/2 N2(r)+3/2 H2(г) ⇄NH3(г) при постоянном давлении, при температуре 298 К Qp = Δ H= = -46,26 кДж/моль.
Определить Qv для этой реакции при этой же температуре.
4. Тепловой эффект изобарного процесса, протекающего по реакции
2Fe(кр)+3/2 О2(г)=Fe2O3 (кр) , при 291 К равен -82З,З кДж/моль. Определить тепловой эффект для изохорного процесса, протекающего по этой реакции при той же температуре.
5. Вычислить разность между Qp и Qv при 773 К для реакции CO2(г) + C(гр)= CO(г) и
3C2H2(г) → C6H6(г) .
6. Энергия диссоциации H2 , Cl2 и стандартная энтальпия образования HCl соответственно составляют 436,243 и -92 кДж/моль. Вычислить энергию связи H-Cl .
7. Рассчитайте тепловой эффект сгорания метилацетата по энергиям связей при 298 К. Реакция сгорания метилацетата протекает по уравнению
CH3COOCH3(ж) + 3,5O2(г) → 3H2O(г) + 3CO2(г) ; Δ Hо.
Структурная формула метилацетата
H O H
| || |
H— C— C —O — C — H
| |
H H
8. Рассчитать стандартную энтальпию образования этилена
H H
| |
H — C = C — H
получаемого по уравнению
2C(гр) + 2H2(г)- C2H4(г) ; ΔH
по величинам энергии связей. Сравнить полученный результат с табличным (см. табл. 1).
9. Вычислить стандартную энтальпию образования H — бутана
H H H H
| | | |
H — C — C — C— C— H
| | | |
H H H H
по энергиям связей.
Уравнение образования бутана
4C(гр) + 5H2(г) = C4 H10 ; Δ H°
10. Вычислить стандартную энтальпию образования метанола по величинам энергий связи
C(гр) + 2H2 + 1/2 O2 = CH3OH ; ΔH°.
Сравнить полученную величину с табличным значением (см. табл. З).
11. Рассчитайте тепловой эффект (ΔH° ) дегидратации этилового спирта по уравнению реакции
H H H H
| | \ /
H — C— C — OH(ж) → C = C + H — O — H ; ΔH°
| | / \
H H H H(г)
Энергии соответствующих связей взять в табл. 1, теплоты испарения спирта
и воды - в табл. 2.
12. Рассчитать тепловой эффект ( ΔH° ) сгорания этилацетата
H
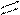 | O H H
| O H H
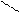 H — C — С | |
H — C — С | |
| O — C — C — H(ж)
H | |
H H до СO2 и H2O(ж)
по энергиям разрыва связей при 298 К. (Энергию связей см. в табл. 1, теплоту испарения этилацетата и H2 O - в табл. 2).
1.2. ЗАКОН ГЕССА. РАСЧЕТ ТЕПЛОПРОИЗВОДИТЕЛЬНОСТИ ТОПЛИВА. ЗАВИСИМОСТЬ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ. УРАВНЕНИЕ КИРХГОФА
Пример 1. Определить при 298 К тепловой эффект (ΔH°) реакции
Al2O3(кр) + ЗSO3(г)= Al2(SO4)3(кр) ; ΔH° .
Решение. Если ΔH реакции > О - реакция эндотермическая, идет с поглощением тепла; если ΔH реакции < О - реакция экзотермическая, идет с выделением тепла. По следствию из закона Гесса имеем: тепловой эффект реакции ΔH° равен разности между суммой стандартных энтальпий (теплот) образования Δ Hообр продуктов реакции и реагентов с учетом их стехиометрических коэффициентов νj, νi) :
продукты реагенты
δη°=ς vj Δ Hообр - ς νi Δ Hообр . (1.2.1)
Из табл. 3 выпишем значения стандартных энтальпий образования:
Δ Hо298 Al2O3(кр) = -1672 кДж/моль;
Δ Hо298 SO3(г) =-395,7 кДж/моль;
Δ Hо298 A12(S04)3(кр)= -3439,0 кДж/моль.
Тепловой эффект реакции находим по (1.2.1):
Δ Hо= Δ Hо298 A12(S04)3 - Δ Hо298 Al2O3-3 Δ Hо298 SO3 =
= -3439,0+1672+3*395,7 = -580,8 кДж
Ответ ΔΗ°=-580,8 кДж.
Пример 2. Определить тепловой эффект ΔΗ° реакции этерификации щавелевой кислоты метиловым спиртом, протекающей по уравнению
(СООН)2+ 2СН3 ОН—> (соосн3)2 + 2Н2О ,
если стандартные энтальпии сгорания (см. табл. 5)
ΔHocгop(COOН)2 = -251,8 кДж/моль;
ΔHocгop (СН3ОН) = -727,59 кДж/моль;
ΔHocгop (COOCН3)2= -168О,19 кДж/моль.
Решение. По следствию из закона Гесса имеем: тепловой эффект реакции равен разности между суммой энтальпий сгорания реагентов и суммой энтальпий сгорания конечных продуктов с учетом их стехиометрических коэффициентов:
реагенты продукты
ΔHo=Σ νi ΔHocгop - Σ νj ΔHocгop (1.2.2)
Следовательно,
ΔHo = ΔHocгop(COOН)2 + 2 ΔHocгop (СН3ОН) - 2 ΔHocгop (COOCН3)2 - 2 ΔHocгop (H2O)= - 251,8 - (2*727,59)+1680,19 = -26,79 кДж.
Энтальпия сгорания Н20 (а также CO2 ) равны нулю.
Ответ. ΔHo = -26,79 кДж.
Пример 3. Определить стандартную энтальпию образования (Δ Hо298 обр) этилена, если тепловой эффект реакции горения этилена равен - 1412,99 кДж/моль, а стандартные энтальпии образования (Δ Hо298 обр) CО2 и H2O(ж) равны соответственно - 394,07 и - 286,26 кДж/моль.
Решение. Горение этилена происходит по реакции
C2H4(г) + 3О2 = 2СО2(г) + 2Н2О(ж);
ΔΗ = -1412,99 кДж/моль
По следствию из закона Гесса (1.2.1):
Δ Hо =2Δ Hо298 Н2О + 2Δ Hо298 СО2 - Δ Hо298 С2Н4 - Δ Hо298 О2
Стандартные энтальпии образования простых веществ равны нулю, отсюда Δ Hо298 О2= 0. Тогда
Δ Hо298 C2H4 = 2Δ Hо298 H20 +2Δ Hо298 CO2 - Δ Hо =-(2*286,26)- (2*394,07) +1412,99 = -572,52-788,14+ +1412,99 = 52,3 кДж/моль.
Ответ. Δ Hо298 C2H4 = 52,3 кДж/моль.
Пример 4. Рассчитать теплотворную способность метана. Реакция горения метана протекает по уравнению
СН4 + 2O2 =СО2 + 2H2O;Δ Hо.
ΔHocгop метана равна -891,63 кДж/моль.
Решение. Теплотворной способностью топлива называется количество тепла, выделяющееся при сгорании одного килограмма топлива (топливо состоит из горючего и окислителя).
По формуле (1.2.2) имеем
ΔΗ°= ΔHocгop CH4 + ΔHocгop O2 - ΔHocгop CO2 - ΔHocгop H2O;
ΔHocгop для O2, Н2O и СO2 равны нулю,
Поэтому ΔΗ0= ΔHocгop CH4 = -891,632 кДж/моль. Это количество тепла выделяется при сгорании 80 г топлива (вес 1-го моля метана и 2-х молей кислорода). Следовательно, теплотворная способность метана
Т.С. = (891,632/80)*1000=1114,54кДж/кг
Ответ. т.С. метана равна 1114,54 кДж/кг.
Пример 5. Определить тепловой эффект реакции
CH3OH(г) + 3/2O2=CO2(г) + 2H2O(г) при 500К и 1013 гПа
Решение. Зависимость теплового эффекта реакции от температуры выражается уравнением Кирхгофа (если в данном процессе отсутствуют фазовые превращения)
ΔΗΤ = ΔΗ0Т0 + 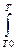 ΔС°р dT,(1.2.3)
ΔС°р dT,(1.2.3)
где ΔС°р -разность сумм молярных изобарных теплоемкостей продуктов реакций и реагентов с учетом их стехиометрических коэффициентов. Приняв, что ΔС°р не зависит от температуры в данном температурном интервале(T0 до T), уравнение (1.2.3) запишем в виде
ΔΗт= ΔΗ0Т0 + ΔС°р (Т-Т0). (1.2.4)
Для решения этого уравнения необходимо знать тепловой эффект реакции при какой-либо температуре Т0. Удобно воспользоваться тепловым эффектом, вычисленным по закону Гесса- при Т0=298 К. Стандартные энтальпии образования компонентов берем из табл. 3. По формуле (1.2.1)
Δ Hо298= Δ Hо298 CO2 + 2Δ Hо298 H2O - Δ Hо298 CH3OH(г) -3/2 Δ Hо298 O2=
=-394-(2*241,8)-(-201,2)-0=-676,4 кДж.
Далее находим ΔС°рпо табличным значениям Ср (табл.4):
ΔС°р= С°р CO2 + 2 С°рH2O - С°рCH3OH -3/2 ΔС°рO2=
37,13+2.33ι56-43,9-3/2·(29,36)=16>31 Дж/моль*К =
= 16,31·10-3 кДж/моль*К, отсюда по формуле (1.2.4)
δΗ°500 = -676,4+16,31·10-3(500-298) = -676,4 + 3,29 = -673,11 кДж.
Ответ. δΗ°500 = -673,11 кДж.
Задачи
13. Вычислить тепловой эффект реакции дегидрирования этана
2С2Н6→ 2СН4 + C2H2+H2.
Расчет произвести по стандартным энтальпиям сгорания компонентов табл. 5 и по стандартным энтальпиям образования табл. 3. Ответы сравнить.
14. Опpедeлить теплоту cгopания фocфopиcтогo водорода
2PH3 + 4O2 = P2 O5 +3H2O(ж) ; ΔНo.
Cтандapтныe энтальпии образования компонентов взять в табл. 3.
15. Опpедeлить тепловой эффект peaкции:
Fe3O4 + CО = 3FeO + CO2 ; ΔHo.
16. При cοединении 2,1 г железа c ceρой выдeлилocь
3,77 кДж. Pаccчитать cтандаpтнyю энтальпию oбpазoвания сульфида железа.
17. Найти кoличecтво теплоты, выделяющейся при взрыве
8,4 л гpeмучeгo газа, взятого при ноpмaльныx ycлoвияx.
18. Определить cтандаρтнyю энтальпию (Δ Hо298 ) обpазoвания
РH3 , иcxoдя из ypавнения
2PH3(г)+4O2(г)=P2О5(кр) + 5H2O(ж) ; ΔHо=-2398 кДж
19. Cpавнить Δ Hо298 peакций воccтановления оксида железа (III) различными вoccтановителями при 298 K:
а) Fe2O3(кр)+2H2(г)=2Fe(кр) + 3H2O(г);
б) Fe2O3(кр)+3C(гр)=2Fe(кр) + 3СО(г);
в) Fe2O3(кр)+3CO(г)=2Fe(кр) + 3СО2(г).
20. Bычиcлить Δ Hо298 обpaзования MgCO3(кр) при 298 K, пользуясь cледyющими данными:
C(гр)+O2(г) = CO2 (г) ; Δ Hо298 = -394 кДж;
2Mg+O2 = 2MgO(кp); ΔHo298 = -1203,6 кДж;
MgO(кр) + CO2 (г)=MgCO3(кр); ΔHo298 = -117,6 кДж.
2 . Bычиcлить Δ H298 pеaкций :
а) 2Li(кр)+2H2O(ж)=2Li+(водн) + 2OH-(водн) + H2(г) ;
б) 2Na(кр)+ 2H2O(ж)=2Nа+(водн) + 2OH-(водн) + H2(г).
Cтандаpтные энтальпии обpазοвания Li+(водн), Na+(водн) и OH-(водн) принять cooтвeтcтвeннo paвными - 278,5: -239 и 228,9 кДж/моль.
22. Bычиcлить, какое кoличеcтвo тепла выделяeтcя при протекающих в opганизмe pеакциях пpевpaщения глюкозы:
а) C6 H12 O6 (кр) =2 C2 H5 OH( ж) + 2 CO2 (г) ; Δ H о1
б) C6H12O6(кр)+6O2(г)=6СO2(г) + 6H2O(ж); ΔHо2.
Какая из этих реакций πocтавляeт оpганизмy больше энергии?
23. Cтандаpтная теплота oбpазoвания жидкого бензола при
298 K paвнa 82,9 кДж/моль. Haпишитe ypaвнение peaкции, к
котopой отноcитcя этот тепловой эффект.
24. Сколько тепла выдeлитcя при вoccтанoвлeнии 8г окиси
меди водородом c oбpазoванием жидкой воды?
25. Реакция oбpазoвания xлopиcтoгo водоpодa из xлоpа и
водорода выpажаeтcя ypавнeниeм:
H2+Cl2=2HCl; Δ H°= -184,6 кДж.
Cкoлькo тепла выдeлитcя при coeдинeнии 1 литра xлopа c
водородом?
26. Oпpeдeлить тeплотвоpнyю cпоcобноcть этилена. Реакция
гоpeния этилена выpажаeтcя уравнением:
С2H4+3O2=2CO2+2H2O.
27. Определить теплотвоpнyю cпocoбнocть этана. Реакция
горения этана:
C2H6 +3,5O2 =2CO2+3H2O.
28. Рассчитать тeплoтвopнyю cпоcобноcть ацетилена. Реакция горения ацетилена:
C2H2+ 2,5O2=2CO2+H2O.
29. Οпpeдeлить тепловой эффект реакции:
CH4+2О2 =CO2+2H2О(г) при Т=700 K.
30. Οпpеделить тепловой эффект реакции:
4NH3+5O2=4NO+6H2O(г) пpи Т= 500 K.
31. Οпpeдeлить тепловой эффект peакции:
2CO+O2=2CO2 при 800 K.
32. Οпpeдeлить тепловой эффект реакции:
2SO2 + O2 =2SO3 при 400 K.
ЗЗ. Οпредeлить тепловой эффект реакции oбpазoвания хлориcтoгo водopoда из xлopа и вoдopoдa при 800 K.
34. Реакция получения водяного газа H2+CO идет по уравнению
C(гр)+H2O(г)=CO(г)+H2(г) ; ΔHo.
Вычислите тепловой эффект ΔHo реакции. Найдите, сколько поглощается тепла при образовании 1000 л водяного газа (н.у.).
35. Исходя из ΔHo298 образования H2O(г) (-241,8 кДж/моль)
и следующих данных:
FeO(кр)+ CO(г)= Fe(кр)+ CO2(г); Δ Hо298 =-18,2 кДж
2CO(г) + O2 (г)= 2CO2(г); Δ Hо298 = -566,0 кДж.
вычислить Δ Hо298 реакции
FeO(кр)+H2(г)=Fe(кр)+H2O(г).
36. Найти массу метана, при полном сгорании которой с образованием жидкой воды выделяется теплота, достаточная для нагревания 100 г воды от 293 K до 303 K. Мольную теплоемкость воды принять равной 75,3 Дж/моль*К.
37. Рассчитайте тепловой эффект ΔHo реакции
2Cl2 + 2H2O=4HCl + O2 ,
протекающей при 798 K, считая, что теплоемкости вcex веществ - участников реакции - в интервале 298 - 798K остаются постоянными.
38. Укажите, как изменится (увеличится, уменьшится или останется неизменным тепловой эффект реакции СО +2Н2= СН3ОН(г) при изменении температуры от 298 K до 1ООО K при
P=const.
1.3. ВТОРОЙ 3AKОH ТЕРМОДИНАМИКИ. ЭНТРОПИЯ.
ЭНЕРГИИ ГИББСА И ГЕЛЬМГОЛЬЦА. КРИТЕРИЙ
САМОПРОИ3ВОЛЬНОГО ПРОТЕКАНИЯ ПРОЦЕССА
Пример 1. Один моль кислорода расширяется до десятикратного увеличения объема и одновременно охлаждается от 400К до 300К. Чему равно изменение энтропии, если для заданного
температурного интервала мольная изобарная теплоемкость кислорода C = 29,2 Дж/моль*К (Ср считаем в данном интервале температур постоянной).
Решение. Общее изменение энтропии ΔS будет складываться из изменения энтропии газа ΔS1 при его расширении и изменения энтропии газа ΔS2 при изменении температуры:
ΔS1= R ln 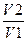 , (1.3.1)
, (1.3.1)
где R - газовая постоянная; V1 и V2 — соответственно конечный и начальный объемы газа. .Находим по формуле (1.3.1)
ΔS1= 8,31*ln10=19,1 Дж/моль*K.
ΔS2 =Cp*ln 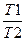 , (1.3.2)
, (1.3.2)
где С - мольная изобарная теплоемкость О2; Т2 и Т1 — конечная и начальная температуры.
Отсюда
ΔS2 = 29,2·1n 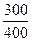 = -8,05 Дж/моль*К, тогда ΔS = ΔS1+ΔS2= 19,1-8,05 = 11,05 Дж/моль*К.
= -8,05 Дж/моль*К, тогда ΔS = ΔS1+ΔS2= 19,1-8,05 = 11,05 Дж/моль*К.
Ответ. ΔS = 11,05 Дж/моль*К.
Пример 2. При охлаждении 12 л кислорода от 473 до 233 K одновременно повышается давление от 105 до 6·106. Рассчитать изменение энтропии, если мольная изобарная теплоемкость кислорода Ср = 29,2 Дж/моль*К (газ считать идеальным).
Решение. Рассчитаем число молей кислорода из уравнения состояния идеального газа
pV= nRT ; n=  =(105*12*10-3)/(8,31*473)= 0,3052 моля.
=(105*12*10-3)/(8,31*473)= 0,3052 моля.
Общее изменение энтропии ΔS будет складываться из изменения энтропии ΔS1 при увеличении давления и изменения энтропии ΔS2 при охлаждении газа
ΔS1 =R ln 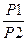 , (1.З.З)
, (1.З.З)
где Ρ1 и Ρ2 — исходное и конечное давления; R — газовая постоянная.
ΔS2 находим по формуле (1.3.2).
Отсюда
ΔS = R ln 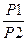 + Cpln
+ Cpln 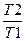 .
.
Так как у нас участвует 0,3052 молей кислорода, то
ΔS =0,3052(8,31*ln(105/(6*106)) + 29,2*ln(233/437))=-16,77 Дж/моль*К.
(энтропия уменьшается при охлаждении газа).
Ответ. ΔS = —16,77 Дж/моль*К.
Пример 3. Определить изменение энтропии ΔS при нагревании 30 г ледяной уксусной кислоты (СН3 СООН) от температуры плавления до 333 K. Τпл уксусной кислоты 289,6 K. Теплота
плавления ΔΗпл= 194 Дж/г, удельная теплоемкость уксусной кислоты равна 2,19 Дж/г*К.
Решение. Общее изменение энтропии Δ S Равно сумме изменения энтропии при плавлении уксусной кислоты Δ S1 и при нагревании жидкой уксусной кислоты от Τпл до заданной температуры (333 К) Δ S2
Δ S1= Δ Hпл/Tпл (1.3.4)
1 моль СН3СООН= 60 г.
По формуле (1.3.4) находим Δ S1=194*30/289,6*60=20,1 Дж/К
Δ S2 рассчитываем по формуле (1.3.2):
Δ S2=Сpln(T2/T1)=2,19*30ln(333/289,6)=9,20 Дж/К.
Тогда
Δ S = Δ S1 + Δ S2= 20,1+9,2=29,3 Дж/К.
Ответ: Δ S = 29,3 Дж/К.
Пример 4. Определить изменение энтропии ΔSо и энергии Гиббса ΔGо при стандартных условиях для системы
Fe3О4 + CO = 3FeO + CO2
и решить вопрос о возможности самопроизвольного протекания ее при указанных условиях.
Решение. Значения ΔSо и ΔGо Для реакции определяем по следствию из закона Гесса (2.2.1). Стандартные энтропии S°298 и энергии Гиббса ΔGо 298 компонентов берем из табл.3.
Следовательно,
продукты реагенты
ΔSо = ∑ νj S°298 - ∑νi S°298.
или
ΔSо = 3Sо298 FeO + Sо298 CO2 - Sо298 Fe3O4 - Sо298 CO =3*58,79 + 213,6 -151,46 – 197,4 = 39,11Дж
продукты реагенты
ΔGо = ∑ νj ΔGо 298 - ∑νi ΔGо 298. (1.3.6)
или
ΔGо = 3 ΔGо 298 FeO + ΔGо 298 CO2 - ΔGо 298 Fe3O4 - ΔGо 298 CO = 3(-246,0) – 394,89 +1010 +137,4 = 14,51 кДж
Если ΔG < О, процесс идет самопроизвольно, при ΔG > 0 процесс не идет. В данном случае ΔG > 0, следовательно, процесс самопроизвольно не пойдет.
Ответ. ΔS° = 39,11 Дж; ΔGо = 14,51 кДж, реакция самопроизвольно не пойдет.
Пример 5. Вычислить стандартное значение изменения свободной энергии ΔGо реакции: C2H2+5/2 О2 = 2 CО2 + Н2О (ж); ΔGо,
По табличным данным -Sо298 и ΔΗо298 для компонентов (табл. 3).
Решение. Определяем тепловой эффект и изменение энтропии реакции по закону Гесса (формулы (1.2.1) и (1.3.5)).
ΔΗ° = ΔΗ°298 H2O + 2ΔΗ°298 CO2 - 2ΔΗ°298 C2H2= -285,8+2* (-394)-226,8= -1299,6 кДж/моль;
ΔS°= Sо298 H2O + 2Sо298 CO2 - Sо298 C2H2 – 5/2Sо298 O2 =
= 70+2213,6-200,8-2,5*205= -216,2 Дж/моль*К;
ΔS°= -0,2162 кДж/моль*К.
Изменение изобарно-изотермического потенциала находим по формуле
Дата добавления: 2016-03-27; просмотров: 15528;
