Выход продуктов из 1 т шихты, %, на Авдеевском коксохимическом заводе
Кокс сухой валовой – 75,3
Пековый кокс – 0,02
Смола каменноугольная – 3,85
Нафталин – 0,15
Бензол каменноугольный – 0,87
Фталевый ангидрид – 0,001
Сульфат аммония – 0,01
Обратный кокс газ – 12,8
Серная кислота – 0,007
Повышение экономической эффективности коксохимического производства достигается, прежде всего, совершенствованием технологии получения кокса. Так, внедрение непрерывного способа коксования позволяет снизить себестоимость кокса в среднем на 30% и повысить производительность труда в 3 раза по сравнению с обычным способом. Значительный эффект достигается при внедрении метода сухого (инертными газами) тушения кокса, позволяющего улучшить его качество и повысить производительность коксохимического производства.
9.3. Технология переработки нефти
Нефтеперерабатывающая промышленность занимает одно из ведущих мест в народном хозяйстве страны. Сырая нефть, поступающая на нефтеперегонные предприятия, перерабатывается на моторное топливо высокого качества, смазочные и специальные масла широкого ассортимента, битумы и восковые составы, парафины, сажу, кокс для электродов. Плотность нефти находится в пределах 780-1040 кг/м3. Нефть плотностью ниже 900 кг/м3относят к легким сортам, свыше 900 кг/м3– к тяжелым. Плотность нефти зависит от содержания в ней легких фракций и в первом приближении характеризует ее состав, определяет направление переработки нефти, а также ассортимент и качество вырабатываемой продукции. Сырая нефть содержит примеси: воду (10-30%), растворенные соли, частицы породы (3-5%), а также газообразные фракции углеводородов – попутных газов (1-4%), которые при атмосферном давлении интенсивно испаряются, увлекая с собой и часть низкокипящих фракций. Поэтому добытая нефть для предотвращения потерь этих фракций направляется в специальные испарители (трапы), где происходит отделение газов, которые подвергаются дальнейшей переработке.
Свободная вода вместе с механическими примесями отделяется от нефти в отстойниках. Для разрушения мелких капелек воды на нефть воздействуют переменным электрическим полем в специальных аппаратах – электродегидраторах, внутри которых имеются сетки, образующие обкладки конденсатора. Капельки соленой воды, являющиеся электропроводником, интенсивно колеблются в электрическом поле, и, смешиваясь, образуют более крупные капли, стекающие вниз. Обезвоженная нефть поднимается через верхние сетки и подается на переработку.
Процесс перегонки основан на явлениях испарения и конденсации смеси веществ с различными температурами кипения. Технологический процесс перегонки нефти состоит из четырех операций: нагрева смеси, испарения, конденсации и охлаждения полученных фракций.
Нагревание нефти и нефтепродуктов осуществляется в трубчатых печах, имеющих по 3-4 камеры. Сначала холодный продукт поступает в конвекционные камеры, где подогревается отходящими газами, а затем в радиационные. Подогрев в печи производится до температуры 300-500°С.
|
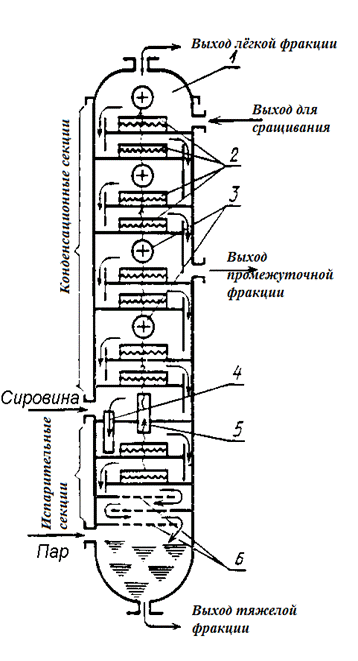
Разделение смесей на фракции при перегонке производится в ректификационных колоннах (рис. 9.3), которые представляют собой цилиндрический аппарат высотой 25-55 м, диаметром 5-7 м, с внутренними горизонтальными перегородками (тарелками), расположенными одна над другой. В перегородках имеются щели, прикрытые колпаками, которые преграждают путь поднимающимся парам, и сливы, предназначенные для стекания избытка жидкости на тарелке.
Нагретую в печи смесь подают в нижнюю часть колонны. Давление в колонне ниже, чем в трубках печи, поэтому смесь закипает и разделяется на две фазы: парообразную и жидкую. Жидкие продукты стекают вниз, а пары поднимаются вверх по колонне.
В верхнюю часть колонны подается орошающая жидкость (флегма) – легкая фракция, которая перетекает вниз с тарелки на тарелку по переливным патрубкам. Поднимающиеся снизу пары подходят под колпак и барботируют через слой жидкости на тарелке. Встречаясь с поднимающимися горячими парами, орошающая колонну жидкость нагревается и частично испаряется. Пары, отдавая ей теплоту, конденсируются, а конденсат стекает в нижнюю часть колонны. Этот процесс многократно повторяется по всей высоте колонны на каждой тарелке. По мере подъема с тарелки на тарелку температура паров и флегмы уменьшается. Температура регулируется существующей подачей холодной легкой фракции для орошения.
Фракционный состав флегмы и паров по высоте колонны непрерывно меняется: стекающая вниз флегма все более обогащается тяжелыми фракциями, а поднимающиеся вверх пары – легкими. Внизу колонны собирается жидкость, содержащая тяжелые фракции (мазут). Легкие фракции поднимаются, по колонне вверх, постепенно охлаждаясь. Самая легкая бензиновая фракция при температуре 180-200°С отводится из колонны в виде паров в конденсатор и отделяется от воды в сепараторе.
С промежуточных тарелок колонны отводятся средние фракции: керосиновая, кипящая при 200-300°С, и газойлевая (300-350°С). Иногда отводят также промежуточые фракции, например, лигроины (160-200°С), керосиногазойлевую (270-320°С).
Мазут разделяют на фракции вакуумной установкой: на легкую фракцию (тяжелый газойль), промежуточную (масляные дистилляты: веретенный, машинный, цилиндровый) и тяжелую (гудрон).
Производительность ректификационных колонн составляет 3-9 тыс. т нефти в сутки, вакуумных установок – 1,5-3 тыс. т мазута в сутки.
Таким образом, продукты перегонки нефти можно резделить на три группы: топливные, масляные дистилляты и гудрон.
Наиболее ценная топливная фракция – бензиновая, выход бензинов из нефти составляет 3-15%, для легкой нефти – до 20%.
Лигроины прямой перегонки используются для дальнейшей переработки на бензин и растворители для лакокрасочной промышленности, их выход составляет 7-10%.
Керосины – осветительный, моторный, компоненты реактивных и дизельных видов топлива, выход 8-20%.
Легкие газойли (соляр) являются основой дизельных видов топлива, а тяжелые – как сырье для дальнейшей переработки (крекинга); их выход составляет в среднем 7-15%.
Мазут – фракция, включающая углеводороды, парафин, маслянистые и смолистые вещества. Легкие мазуты применяются как топливо для котельных и газовых турбин; выход мазута – 50-60%.
Масляные дистилляты – тяжелые фракции, из которых получают различные смазочные и специальные масла; их выход – около 20-25%. Гудрон состоит из смолистых веществ, парафинов и тяжелых углеводородов и служит полуфабрикатом, из которого получают битумы и кокс для электродов; его выход – 15-30%.
Сравнительно малый выход бензина при прямой перегонке обусловил необходимость разработки метода получения легких фракций из тяжелых внедрением крекинг-процесса.
Крекинг, пиролиз и риформинг нефтепродуктов.Переработка нефти обычной перегонкой, т.е. физическим методом, не изменяет химического состава нефти и ее продуктов, не разрушает и не создает углеводородов, а лишь разделяет нефть на ее составные части. Перегонкой нельзя получить из нефти больше того, что естественно в ней содержится. Например, в нефти содержится 10-15% бензина, и получить большее количество бензина перегонкой невозможно.
Для значительного увеличения выхода из нефти легких продуктов и прежде всего бензина наряду с физическими методами сейчас применяют и химические методы переработки нефтепродуктов, основанные на изменении их химического состава. Этими новыми методами являются крекинг и пиролиз. Сущность их заключается в том, что переработку нефтепродуктов производят в условиях, при которых отдельные углеводороды расщепляются (распадаются на части) и образуют новые, более легкие углеводороды (с меньшим числом атомов углерода) (рис. 9.4). Таким путем достигается увеличение выхода бензина и других легких продуктов сверх того количества, которое содержится в исходном сырье.
Крекинг(что означает расщепление) ведут при температуре 475-500°С и давлением 2…7 МПа. Для активизации и соответствующего направления процесса крекинга применяют различные катализаторы, чаще всего алюмосиликатные (как правило, синтетические, иногда природные – бентонитовые глины).
Пиролиз(означающий разложение при высокой температуре) осуществляется при атмосферном давлении, но при более высоких температурах (680-750°С).

Рис. 9.4. Расщепление углеводорода при крекинге
Тяжелый углеводород – цетан С16Н34распадается на два легких углеводорода: С8Н18и октилен С8Н16
Крекингом из тяжелых нефтяных фракций (соляра, мазута) получают преимущественно бензин и другое легкое моторное топливо. Пиролизом обычно перерабатывают нефтяные газы, бензины и керосины для получения сырья (этилена, пропилена, бутадиена и др.) для промышленности органического синтеза и полимеров.
На передовых нефтеперерабатывающих предприятиях, применяющих новейшую технологию производства, выход легкого моторного топлива очень высок; из соляра, например, получают 60-80% высококачественного бензина и керосина и небольшое количество газов и крекингового остатка. Крекинг-бензин отличается более высокими антидетонационными свойствами и в этом отношении превосходит бензин, получаемый при перегонке нефти.
Получаемые при крекинге и пиролизе газы содержат этилен, пропилен, бутилен и другие легкие углеводороды. Из них получают спирты, синтетический каучук, пластмассы и множество других продуктов.
Крекинговый остаток подвергают коксованию - процессу глубокого разложения при температуре 480-650°С. В результате получаются нефтяной кокс, газ и жидкие нефтепродукты, в том числе некоторое количество бензина. Нефтяной кокс может служить заменителем каменноугольного кокса.
Таким образом, новейшие методы переработки нефти открывают широчайшие возможности для использования нефтепродуктов во всех отраслях народного хозяйства и полного обеспечения страны всеми видами жидкого топлива и смазочных материалов, а также разнообразным химическим сырьем без чрезмерного увеличения нефтедобычи.
Риформинг – процесс, применяемый для улучшения качества бензина, повышения его антидетонационных свойств (повышения октанового числа бензина). Использование высокооктанового бензина значительно повышает мощность двигателей и экономическую эффективность эксплуатации автомобилей. Процессы риформинга осуществляют при температуре 450-530°С и давлении 1,4-5,6 МПа с участием водорода и в присутствии различных катализаторов (молибден, платина, окиси хрома и молибдена и др.). В процессе риформинга преобразуется структура молекул углеводородов бензина, уменьшается содержание в нем низкооктановых и увеличивается содержание высокооктановых углеводородов. В результате бензин получается высокооктановым.
9.4. Производство аммиака, азотной кислоты и минеральных удобрений
Производство аммиака. Азот относится к группе химических элементов, играющих исключительно важную роль в живой природе и в жизни человека. Наряду с углеродом, кислородом и водородом азот является основным элементом, составляющим растительные и животные организмы. Он участвует в основных биохимических процессах, входит в состав питательных веществ и пищевых продуктов.
Растения усваивают азот только из аммиачных и азотнокислых солей, находящихся в почве и накапливающихся там при гашении органических соединений. Однако связанного в почве азота недостаточно для интенсивного ведения сельского хозяйства, и поэтому необходимо применение азотных удобрений, на производство которых расходуется большая часть соединений азота, выпускаемых промышленностью. Наиболее экономичным способом оказался синтез аммиака из азотоводородной смеси, в настоящее время более 95% связанного азота получают по этому способу.
Аммиак NH3 представляет собой при нормальном давлении и температуре бесцветный газ с резким характерным запахом. Жидкий аммиак – бесцветная прозрачная жидкость плотностью 0,68 г/см3, кипящая при – 33,4°С. Аммиак обладает восстановительными свойствами, он хорошо растворим в воде, 25%-й раствор его в воде называют нашатырным спиртом. Аммиак используется в качестве удобрения, которое вносится в почву в жидком виде, он применяется в холодильной, металлургической промышленности, при производстве пластмасс, фотореактивов и т.п. Часть аммиака перерабатывается в азотную кислоту и минеральные удобрения.
Для синтеза аммиака необходимо иметь азот, водород в соотношении 1:3. Источником азота служит атмосферный воздух, водорода – метан, другие углеводороды.
В состав воздуха входит 78% азота, 21% кислорода, около 1% аргона и от 0,1 до 2% водяных паров. Разделение воздуха на составные части основано на различии их температур кипения, так, кислород кипит при –182,9°С, аргон при –185,7°С, азот при –195,8°С. Для разделения воздуха вначале его сжижают охлаждением ниже температуры кипения азота, а затем испаряют в ректификационных колоннах, в которых и осуществляется разделение воздуха на азот и кислород. Существуют аппараты одно- и двухкратной ректификации. При однократной ректификации в колоннах получают азот с содержанием в нем 7% О2. Аппарат двухкратной ректификации работает следующим образом: сжатый воздух, охлажденный в предварительном теплообменнике, поступает в змеевик, расположенный в нижней части колонны. Воздух охлаждается воздушно-кислородной смесью, дросселируется, и пары, обогащенные азотом, поднимаются по колонне вверх и конденсируются в испарителе. Конденсат, обогащенный кислородом, стекает вниз, а пары азота поднимаются вверх и по пути очищаются от кислорода жидким азотом, стекающим сверху. Чистый азот отбирается из верхней колонны. Мощности современных установок разделения воздуха составляют от 3 до 17 тыс. м3/ч азота.
Водород, необходимый для синтеза аммиака, добывают в промышленности различными способами: конверсией метана; конверсией окиси углерода; разделением коксового газа; электролизом воды.
Природный газ содержит до 98% метана. Процесс получения водорода из природного газа состоит из ряда последовательных стадий. Вначале проводят конверсию метана водяным паром и кислородом по уравнениям реакций:

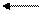
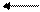
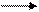 CH4 + H2O CO + 3H2 – 206,4 кДж
CH4 + H2O CO + 3H2 – 206,4 кДж
СН4 + ½О2 СО + 2Н2 + 35,6 кДж
Далее осуществляют конверсию окиси углерода:
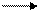
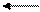
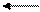
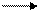 СО + Н2О СО2 + Н2 + 41,0 кДж
СО + Н2О СО2 + Н2 + 41,0 кДж
Затем следует очистка газовой смеси от СО2и остаточной СО.
Процесс конверсии метана проводят под давлением, близком к атмосферному, реакция идет с поглощением тепла и увеличением объема. Конверсия метана проходит при температуре 800-1100°С с применением катализатора (никеля, нанесенного на окись алюминия или на окись магния) и при 1350-1400°С без катализатора.
Каталитическую конверсию метана осуществляют в шахтных конвертерах – реакторах, футерованных изнутри огнеупорным кирпичом и снабженных водяной рубашкой.
Полученные для синтеза аммиака азот и водород или их смеси подвергаются очистке от кислородо- и серосодержащих соединений, являющихся каталитическими ядами.
Очистку газов производят при помощи жидких или твердых поглотителей или вымораживанием, т.е. переводом примесей в жидкое или твердое состояние.
Синтез аммиака происходит по реакции:
N2 + 3H2 2NH3 + Q
и является обратимым процессом, протекающим с уменьшением объема и выделением тепла. Следовательно, с повышением давления и понижением температуры равновесие реакции синтеза смещается в правую сторону.
Синтез аммиака проводят в реакторе – колонне синтеза, изготовленной из хромованадиевой стали, высотой 12-20 м и внутренним диаметром 1,0-1,4 м. Снизу и сверху колонна закрывается крышками. В верхней части колонны расположен катализатор, а в нижней – теплообменник. Азотоводородная смесь поступает в верхнюю часть колонны, проходит сверху вниз и поступает в теплообменник, после чего газ поднимается вверх по кольцевому пространству. Азотоводородная смесь, нагретая до 400-420°С, поступает на слой катализатора, где поддерживается температура 450-520°С. Прореагировавший газ (продукт) поступает в трубки теплообменника, где охлаждается и выводится из колонны при 90-100°С.
Колонны синтеза обеспечивают производительность аммиака от 150 до 1500 т/сутки. Срок службы катализатора – около двух лет.
После охлаждения аммиак конденсируется и отделяется от газа, а непрореагировавшая азотоводородная смесь при помощи циркуляционного компрессора возвращается в аппарат.
На Украине аммиак производится на Новомосковском и Горловском азотнотуковых заводах.
Производство азотной кислоты. Азотная кислота – одна из важнейших минеральных кислот. Безводная азотная кислота HNО3представляет собой тяжелую бесцветную жидкость (плотность 1,52 г/см3), дымящуюся на воздухе. Она кипит при 86°С и замерзает при – 47°С.
Азотная кислота – сильный окислитель. Концентрированная азотная кислота превращает большинство металлов в соответствующие окислы и нитраты. Она широко применяется в промышленности. Большая часть азотной кислоты расходуется на производство удобрений, взрывчатых веществ, ракетного топлива, синтетических красителей и волокон, различных пластмасс и т.п.
Промышленностью выпускаются 3 сорта разбавленной (45-55%) и 2 сорта концентрированной (97-98%) азотной кислоты.
Процесс получения разбавленной азотной кислоты из аммиака основан на следующих реакциях:
1) контактное окисление аммиака до окиси азота:
Процесс контактного окисления аммиака проходит только при высоких температурах (выше 800-900°С) в присутствии катализаторов, ускоряющих реакцию (в качестве которых служат платина и ее сплавы, окиси железа, марганца, кобальта и др.) Окисление аммиака ведут в реакторах конвертерного типа, диаметром 1,5-2,5 м. Катализаторные сетки помещаются в центральной части аппарата. Аммиачно-воздушная смесь подается в верхнюю часть реактора, нижняя часть охлаждается воздухом. Здесь размещен выход нитрозных газов.
Последующие две реакции (окисление NO и абсорбция NO2водой) осуществляются в одной и той же аппаратуре. Окисление – самая медленная из всех реакций, она идет с уменьшением объема и до 150°С протекает в сторону образования NO2, а при более высокой температуре сдвигается влево. Повышение давления в значительной мере ускоряет реакцию. Поэтому на установках при повышенных давлениях (до 106 Н/м2) окись азота практически полностью окисляется до NO2).
Абсорбция двуокиси азота водой представляет конечную стадию производства азотной кислоты. При переработке нитрозных газов в системах, работающих под давлением с использованием смеси аммиака (10-12%), получают разбавленную 45-50%-ю азотную кислоту (при повышенных до 106Н/м2давлениях – до 60-62% НNO3).
Для отдельных производств требуется не разбавленная азотная кислота, а концентрированная с содержанием НNO3выше 96%. Такую кислоту получают путем концентрирования разбавленной кислоты. Сущность этого процесса заключается в перегонке разбавленной азотной кислоты в присутствии водоотнимающего средства – концентрированной серной кислоты. Последняя связывает воду, содержащуюся в разбавленной азотной кислоте. Перегонку азотной кислоты ведут в тарельчатых барботажных колоннах, изготовленных из кислотоупорного чугуна, устойчивого по отношению к серной и азотной кислотам.
Серную кислоту подают на одну из верхних тарелок, а несколько ниже – разбавленную азотную кислоту. Нагревание смеси осуществляется острым паром (180-200°С), вводимым в нижнюю часть колонны. Пары концентрированной азотной кислоты направляются в конденсатор, где кислота конденсируется, а нитрозные газы направляются на дальнейшее улавливание.
Отработанная 70%-я серная кислота вытекает снизу колонны, поступает без охлаждения непосредственно на упаривание. Расход крепкой серной кислоты составляет 3-4 т на 1 т крепкой азотной кислоты. Для возврата отработанной серной кислоты в процесс ее необходимо концентрировать, что связано с потерями топлива, кислоты и сильной коррозией аппаратуры.
2) Поэтому в последнее время процесс получения концентрированной азотной кислоты ведут путем прямого синтеза этой кислоты из жидкой двуокиси азота по уравнению:
Процесс ведут в специальных автоклавах под давлением
5•106 Н/м2и температуре 75°С.
Слабая азотная кислота (45-60%) хранится на складах в резервуарах из нержавеющей стали. Небольшие количества ее перевозят в стеклянных бутылях, упакованных в корзины или деревянную обрешетку с обкладкой стружкой или соломой. Большие количества кислоты перевозят в железнодорожных цистернах из нержавеющей стали.
Концентрированную кислоту хранят в резервуарах и перевозят в железнодорожных цистернах из алюминия.
Окислы азота и азотная кислота обладают токсичными свойствами. Попадая на кожу, азотная кислота вызывает ожоги. Концентрированная азотная кислота вызывает загорание хлопчатобумажной ткани и древесины. Поэтому работающий с азотной кислотой должен быть одет в спецодежду из шерстяного сукна, иметь противогаз марки В с коробкой желтого цвета, а также резиновые перчатки и защитные очки.
Производство минеральных удобрений. Минеральные удобрения – это соли и продукты, содержащие элементы, необходимые для питания растений и используемые для получения высоких и устойчивых урожаев. В состав растений входят: углерод, кислород, водород, азот, фосфор, калий, кальций, магний и др. Ежегодно при снятии урожая из почвы выносятся питательные вещества, необходимые для растений; почва истощается, что снижает урожайность.
Углерод растения получают из воздуха в виде двуокиси углерода, усвояемой ими путем фотосинтеза, водород поступает из почвы в составе воды, а все остальные элементы растения получают из почвы в виде минеральных солей, растворенных в воде или слабых органических кислотах. Среди них наибольшее значение для питания растений имеют азот, фосфор и калий.
Азот растения получают из почвы через корневую систему в виде растворов нитратов, карбамида, аммиака и др., а также из азотосодержащих соединений воздуха в результате деятельности на корнях растений клубеньковых бактерий.
Фосфор и калий растения получают из почвы в виде растворимых фосфорнокислых и калийных солей, но их в почве мало, поэтому необходимо внесение в почву удобрений.
Потребление растениями бора, меди, цинка, марганца и некоторых других элементов сравнительно невелико. Эти элементы вносятся в почву в небольших количествах в виде так называемых микроудобрений.
Все удобрения по своему происхождению делятся на минеральные, органические, органо-минеральные и бактериальные. Минеральные удобрения вырабатываются на химических предприятиях – это в основном неорганические соли. Из органических соединений к ним относят карбамид (мочевину). Органические удобрения содержат питательные вещества, входящие в состав органических соединений. Органо-минеральные удобрения – это смесь органических и минеральных. Бактериальные удобрения содержат культуры бактерий, которые способствуют накоплению в почве питательных элементов.
По составу в зависимости от вида питательного элемента удобрения подразделяются на азотные, фосфорные и калийные. Если удобрения содержат несколько питательных элементов, то их называют комплексными. По концентрации питательных элементов различают ординарные (тощие) и концентрированные (содержащие 30% и более питательных веществ).
Азотные удобрения разделяют на аммиачные, нитратные, аммиачно-нитратные и амидные. Все они хорошо растворяются в воде и усваиваются растениями.
3) Наиболее распространенным азотным удобрением в нашей стране является аммиачная селитра NH4NO3, содержащая 35% N и применяющаяся для различных культур. Вместе с тем она обладает отрицательными свойствами: гигроскопична, легко слеживается, разлагается при нагревании, а сухая пылевидная соль способна взрываться (поэтому она используется еще и для производства взрывчатых веществ). Взрывоопасность аммиачной селитры усложняет ее производство и применение в качестве удобрения. Получают селитру по уравнению реакции:
Эта реакция проводится в реакторе, протекает с большой скоростью и сопровождается интенсивным выделением тепла. В реакторе смешиваются азотная кислота и аммиак. Протекает реакция нейтрализации при атмосферном давлении и температуре до 110°С. Из реактора выводится раствор аммиачной селитры, содержащий 65-82% NH4NO3.
Технология производства аммиачной селитры совершенствуется в направлении улучшения физических свойств (путем выпарки удаляют воду до 0,4%), применения концентрированной азотной кислоты и увеличения мощности реактора.
Карбамид (мочевина) CO(NH2)2 содержит 46,3% N, используется как удобрения и как добавка к кормам для скота, а также как сырье в производстве пластмасс – аминопластов.
Карбамид получают при взаимодействии аммиака и двуокиси углерода путем синтеза при давлении до 20-106H/м2и при температуре 180-200°С. В результате синтеза получают продукт, содержащий около 35% карбамида.
Производство карбамида осуществляется в колонне синтеза, изготовленной из легированной стали. Двуокись углерода и жидкий аммиак поступают в нижнюю часть колонны, где внутри цилиндра образуется сплав, содержащий около 35% карбамида.
В качестве удобрений используют сульфат аммония, содержащий до 21% азота. Его получают поглощением аммиака из коксового газа серной кислотой и как побочный продукт в производстве капролактама.
На Украине азотные удобрения производят в Лисичанске, Горловке, Черкассах, Ровно и др.
Фосфорные удобрения по степени растворимости подразделяются на водорастворимые, цитратно- и лимоннорастворимые и труднорастворимые. К водорастворимым относятся простой и двойной суперфосфат. Цитратно-растворимые удобрения (прецинитат) растворимы в аммиачном растворе цитрата аммония, лимоннорастворимые – в 2%-м растворе лимонной кислоты. Такие соли растворяются в почвенных кислотах и усваиваются растениями. Труднорастворимые удобрения содержат соли фосфорной кислоты, растворимые только в сильных минеральных кислотах (к ним относятся фосфоритная и костяная мука).
Сырьем для производства фосфорных удобрений служат природные фосфаты: апатиты и фосфориты. Апатиты добывают на Кольском полуострове, фосфориты – в России и Казахстане.
Для производства концентрированных фосфорных и комплексных удобрений необходима фосфорная кислота H3PO4, которую получают из апатитов или фосфоритов экстракционным или электротермическим методом. Эти методы заключаются в разложении фосфатного сырья кислотами (чаще всего серной).
Суперфосфат – наиболее распространенное, универсальное водорастворимое фосфорное удобрение, которое представляет собой порошок или гранулы серого цвета и состоит из смеси монокальция фосфата Ca(H2PO4).H2O и сульфата кальция СаSO4. Его вырабатывают в камерах, где реакции проходят в две стадии: сначала разлагается под воздействием серной кислоты апатитовое или фосфористое сырье (при температуре 110-115°С), а затем созревает (кристаллизируется) суперфосфат, который содержит не более 20% окиси фосфора Р2О5. Более концентрированные фосфорные удобрения получаются при разложении фосфатных руд фосфорной кислотой. Получающийся в результате этого двойной суперфосфат не содержит в себе сульфата кальция, поэтому содержание в нем усвояемой Р2О5 в 2-2,5 раза выше, чем в простом суперфосфате. Двойной суперфосфат – концентрированное удобрение, содержащее 42-49% усвояемой Р2О5, не содержит балласта (сульфата кальция), и в его производстве могут быть использованы местные фосфориты, которые непригодны для получения простого суперфосфата.
В Украине суперфосфат производится в Виннице, Одессе и Сумах, а также в Мариуполе и Константиновке – как побочный продукт черной металлургии.
Сырьем для производства калийных удобрений служат природные калийные соли, содержащие минералы сильвинит и карналлит. В Украине большие запасы калийных солей в Прикарпатье.
Используя промышленные методы галургии (или методы раздельной кристаллизации), из этих солей получают удобрения – хлориды калия трех сортов: высший сорт содержит не менее 99% KCl, первый – не менее 98,3% KCl и второй – не менее 95% KCl (60% K2O).
Комплексные удобрения получают с различным соотношением азота, фосфора и калия – в зависимости от характера почвы и сельскохозяйственных культур, для которых они предназначаются. Например, аммофос – азотнофосфорное сложное концентрированное удобрение, содержащее 11-13% N и47-50% Р2О5 в водорастворимом состоянии; нитрофоска – удобрение, содержащее все три питательных элемента (11-17% N, 11-17% K2O и 10-17% Р2О5) в водорастворимой форме; нитроаммофоска – удобрение, содержащее по 17% Р2О5, К2О и N. Получают комплексные удобрения в реакторах путем нейтрализации фосфорной кислоты аммиаком с последующим добавлением к пульпе фосфатов аммония, аммиачной селитры и измельченного твердого хлорида калия.
ОСНОВНЫЕ ПОНЯТИЯ
Горно-химическая промышленность
Каменноугольная смола
Бензол
Металлургический кокс
Надсмольная вода
Шихта
Полукокс
Коксовая печь
Коксовая батарея
Коксовыталкиватель
Вертикалы
Сырая нефть
Электродегидратор
Обезвоженная нефть
Ректификационная колонна
Фракционный состав флегмы
Лигроины
Масляные дистилляты
Синтез аммиака
Крекинг
Пиролиз
Риформинг
Каталитическая конверсия метана
Аммиачная селитра
Карбамид
ВОПРОСЫ ДЛЯ ОБСУЖДЕНИЯ
1. Понятие о химическом производстве.
2. Что представляет собой кокс и каковы области его применения?
3. Показатели качества кокса.
4. Основные компоненты, получаемые при коксовании угля, и их особенности.
5. Охарактеризуйте сырье для получения кокса.
6. Раскройте сущность коксохимического процесса и этапы технологического процесса.
7. Устройство и работа коксовой батареи.
8. Перечислите продукты, получаемые из сухой шихты.
9. Пути повышения экономической эффективности коксохимического производства.
10. Перечислите компоненты сырой нефти.
11. На чем основан процесс перегонки нефти?
12. Ректификационная колонна, устройство и принцип работы.
13. Продукты прямой перегонки нефти и их применения.
14. Крекинг, пиролиз и риформинг нефтепродуктов, сущность процессов и получаемые продукты.
15. Производство аммиака.
16. Производство азотной кислоты.
17. Производство минеральных удобрений.
ГЛАВА 10. СТРОИТЕЛЬНЫЕ МАТЕРИАЛЫ И ИЗДЕЛИЯ ИЗ НИХ
10.1. Свойства строительных материалов
Пригодность строительных материалов для конкретных условий определяют по их свойствам. Свойства материалов многообразны, что обусловлено главным образом их вещественным составом. Выделяют физические, механические, химические и другие свойства.
Физические свойства характеризуют физическое состояние материала (фазовое состояние, плотность, структуру), а также определяют его отношение к физическим процессам окружающей среды. При этом физические процессы в материале не изменяют строение его молекул. Обычно к таким свойствам относят плотность, объемную массу, теплопроводность, теплоемкость, звукопроницаемость, влажность, водопроницаемость, водопоглощение, усадку, огнеупорность, огнестойкость, светостойкость, электросопротивление.
Механические свойства – способность материала сопротивляться деформированию и разрушению под действием напряжений, возникающих в результате приложения внешних сил (прочность, упругость и вязкость, пластичность и хрупкость, релаксация, ползучесть, твердость материалов и др.).
Химические свойства материала определяют его способность вступать в химическое взаимодействие с веществами среды, в которой он находится, при этом появляются новые вещества. К химическим свойствам можно отнести растворимость и кристаллизацию, коррозионную стойкость, старение, атмосферостойкость, адгезию, горючесть, токсичность и др.
Свойства материалов не остаются стабильными, они изменяются под воздействием физических, химических, механических и физико-химических факторов, например, прочность древесины (сосны) при увлажнении до 20% снижается в 1,5 раза по сравнению с воздушно-сухим состоянием и т.п.
Показатели свойств материалов являются важнейшими критериями их качества. Они нормированы в государственных стандартах и других нормативно-технических документах.
Физические свойства. Важнейшими из физических свойств материала являются плотность и объемная масса.
Плотность – масса вещества материала в единице его объема. Плотность строительных материалов больше единицы.
Объемная масса – масса единицы объема материала в естественном состоянии (с порами, пустотами и т.д.). Объемная масса строительных материалов обычно меньше плотности (табл. 10.1). Чем меньше пористость материала, тем ближе значения объемной массы и плотности.
Таблица 10.1
Объемная масса и плотность строительных материалов

Пористость характеризует количество пор и микротрещин в единице объема материала
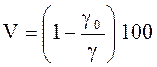 ,
,
где γ0– объемная масса; γ – плотность материала.
Чем больше пористость, тем меньше прочность и теплопроводность, больше водо- и газопроницаемость.
Обычно материалы имеют влагу на внутренней поверхности пор, микротрещин и других дефектов.
Влажность определяют в процентах по объему или массе:
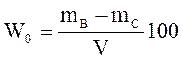 или
или 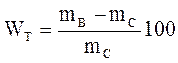 ,
,
WО= WТg ,
где mВи mС– масса влажного и сухого образца материала, г;
V – объем материала; g – объемная масса материала.
Водопоглощение – количество воды, которое может поглотить погруженный в воду материал, а затем удержать молекулярными и капиллярными силами при атмосферном давлении.
Водонасыщение определяется количеством воды, которое может поглотить материал при вакууме или повышенном давлении. Тогда из открытых пор вытесняется воздух, вследствие чего материал насыщается водой больше, чем при атмосферном давлении. Водопоглощение и водонасыщение изменяются в пределах у гранита 0,02-0,7, асфальтобетона 2-5, кирпича 8-15, пористых теплоизоляционных материалов до 100%.
Пористые строительные материалы изменяют свой объем при изменении влажности. Усадкой называют изменение размеров материала при его высыхании; набухание – увеличение объема при насыщении материала водой. Усадка (набухание) древесины изменяется в пределах 30-100, кирпича – 0,03-0,1, гранита – 0,02-0,06 мм/м. Многократное высыхание и увлажнение материала ускоряет его разрушение.
Водонепроницаемость (газонепроницаемость) – способность материала не пропускать воду (газ) при заданных условиях. Она измеряется величиной предельного давления (МПа), при котором вода (газ) не проходит через данный слой материала.
Теплопроводность – способность материала передавать через свою толщу тепловой поток, возникающий вследствие разности температур на поверхностях, ограничивающих материал. Ее характеризуют коэффициентом теплопроводности, измеряемым в единицах Вт/(м·°С). Коэффициент теплопроводности колеблется от 0,06 (минеральная вата) до 58 (сталь), для кирпича он равен 0,82, бетона 1,28-1,55, гранита 2,92.
Звукопроницаемость – способность материала пропускать звуковую волну, обратное свойству звукоизоляции.
Дата добавления: 2016-03-27; просмотров: 1396;
