ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ БЕЛКОВ В ЖЕЛУДОЧНО-KИШЕЧНОМ ТРАКТЕ
МЕТАБОЛИЗМ БЕЛКОВ
Особая роль белков в питании
Белки являются незаменимым компонентом пищи. В отличие от белков - углеводы и жиры не являются незаменимыми компонентами пищи. Ежесуточно потребляется около 100 граммов белков взрослым здоровым человеком. Пищевые белки – это главный источник азота для организма. В смысле экономическом белки являются самым дорогим пищевым компонентом. Поэтому очень важным в истории биохимии и медицины было установление норм белка в питании.
В опытах Карла Фойта впервые были установлены нормы потребления пищевого белка - 118г/сутки, углеводов - 500г/сутки, жиров 56г/сутки. М.Рубнер первым определил, что 75% азота в организме находится в составе белков. Он составил азотистый баланс (определил, сколько азота человек теряет за сутки и сколько азота прибавляется).
У взрослого здорового человека наблюдается азотистое равновесие – «нулевой азотистый баланс»(суточное количество выведенного из организма азота соответствует количеству усвоенного).
Положительный азотистый баланс (суточное количество выведенного из организма азота меньше, чем количество усвоенного). Наблюдается только в растущем организме или при восстановлении белковых структур (например, в периоде выздоровления при тяжелых заболеваниях или при наращивании мышечной массы).
Отрицательный азотистый баланс (суточное количество выведенного из организма азота выше, чем количество усвоенного). Наблюдается при белковой недостаточности в организме. Причины: недостаточное количество белков в пище; заболевания, сопровождающиеся повышенным разрушением белков.
В истории биохимии проводились эксперименты, когда человека кормили только углеводами и жирами («безбелковая диета»). В этих условиях измеряли азотистый баланс. Через несколько дней выведение азота из организма уменьшалось до определенного значения, и после этого поддерживалось длительное время на постоянном уровне: человек терял ежесуточно 53 мг азота на кг веса в сутки (примерно 4 г азота в сутки). Это количество азота соответствует примерно 23-25г белка в сутки. Эту величину назвали "КОЭФФИЦИЕНТ ИЗНАШИВАНИЯ". Затем ежедневно добавляли в рацион 10г белка, и выведение азота при этом повышалось. Но все равно наблюдался отрицательный азотистый баланс. Тогда в пищу стали добавлять 40-45-50 граммов белка в сутки. При таком содержании белка в пище наблюдался нулевой азотистый баланс (азотистое равновесие). Эту величину (40-50 граммов белка в сутки) назвали ФИЗИОЛОГИЧЕСКИЙ МИНИМУМ БЕЛКА.
В 1951 году были предложены нормы белка в питании: 110-120 граммов белка в сутки.
В настоящее время установлено, что 8 аминокислот являются незаменимыми. Суточная потребность в каждой незаменимой аминокислоте - 1-1.5 гр., а всего организму необходимо 6-9 граммов незаменимых аминокислот в сутки. Содержание незаменимых аминокислот в разных пищевых продуктах различается. Позтому физиологический минимум белка может быть разным для разных продуктов.
Сколько необходимо съедать белка для поддержания азотистого равновесия? 20 гр. яичного белка, либо 26-27 гр. белков мяса или молока, либо 30 гр. белков картофеля, либо 67 гр. белков пшеничной муки. В яичном белке содержится полный набор аминокислот. При питании растительными белками необходимо гораздо больше белка для восполнения физиологического минимума. Потребности в белке у женщин (58 граммов в сутки) меньше, чем у мужчин (70 г белка в сутки) – данные нормативов США.
ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ БЕЛКОВ В ЖЕЛУДОЧНО-KИШЕЧНОМ ТРАКТЕ
Переваривание не относится к процессам метаболизма, поскольку происходит вне организма (по отношению к тканям просвет желудочно-кишечного тракта является внешней средой). Задача переваривания - раздробить (расщепить) крупные молекулы пищевых веществ до маленьких стандартных мономеров, которые всасываются в кровь. Эти вещества, которые получаются в результате переваривания, уже лишены видовой специфичности. Но энергетические запасы, имеющиеся в пищевых веществах, сохраняются, и в дальнейшем используются организмом.
Все пищеварительные процессы являются гидролитическими, то есть не приводят к большой потери энергии - они не окислительные. Каждые сутки в организм человека всасывается примерно 100 граммов аминокислот, которые поступают в кровь. Еще 400 граммов аминокислот поступает ежесуточно в кровь в результате распада собственных белков тела. Все эти 500 г аминокислот представляют собой метаболический пул аминокислот. Из этого количества 400 граммов используется для синтеза белков тела человека, а оставшиеся 100 г ежедневно распадаются до конечных продуктов: мочевина, CO2 . В процессе распада образуются также необходимые организму метаболиты, способные выполнять функции гормонов, медиаторов различных процессов и другие вещества (например: меланины, гормоны адреналин и тироксин).
Для белков печени период полураспада составляет 10 дней. Для белков мышц этот период составляет 80 дней. Для белков плазмы крови - 14 дней, печени - 10 дней. Но есть белки, которые распадаются быстро (для a2-макроглобулина и инсулина период полураспада - 5 мин).
Ежедневно ресинтезируется около 400 г белков.
Распад белков до аминокислот происходит путем гидролиза - присоединяется H2O по месту расщепления пептидных связей под действием протеолитических ферментов. Протеолитические ферменты называются ПРОТЕИНАЗАМИ или ПРОТЕАЗАМИ. Существует много разных протеиназ. Но по структуре каталитического центра все протеиназы делят на 4 класса:
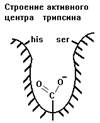
1. СЕРИНОВЫЕ ПРОТЕИНАЗЫ - у них в каталитическом центре содержатся аминокислоты серин и гистидин.
2. ЦИСТЕИНОВЫЕ ПРОТЕИНАЗЫ - в каталитическом центре цистеин и гистидин.
3. КАРБОКСИЛЬНЫЕ ПРОТЕИНАЗЫ (АСПАРТИЛЬНЫЕ) в каталитическом центре содержат 2 радикала аспарагиновой кислоты. К ним относится пепсин.
4. МЕТАЛЛОПРОТЕИНАЗЫ. В каталитическом центре этих ферментов находятся гистидин, глутаминовая кислота и ион металла (карбоксипептидаза ”А”, коллагеназа содержат Zn2+).
Все протеиназы различаются по механизму катализа и по условиям среды, в которой они работают. В каждой молекуле белка имеются десятки, сотни и даже тысячи пептидных связей. Протеиназы разрушают не любую пептидную связь, а строго определенную.
Как происходит узнавание "своей" связи ? Это определяется структурой адсорбционного центра протеиназ. Пептидные связи отличаются только тем, какие аминокислоты участвуют в их образовании.
Структура адсорбционного центра такова, что она позволяет распознать радикал той аминокислоты, СООН-группа которой образует эту связь. В некоторых случаях для субстратной специфичности имеет значение аминокислота, аминогруппа которой образует гидролизуемую связь. А иногда обе аминокислоты имеют значение для определения субстратной специфичности фермента.
С практической точки зрения все протеиназы по их субстратной специфичности могут быть разделены на 2 группы:
1. МАЛОСПЕЦИФИЧНЫЕ ПРОТЕИНАЗЫ
2. ВЫСОКОСПЕЦИФИЧНЫЕ ПРОТЕИНАЗЫ
МАЛОСПЕЦИФИЧНЫЕ ПРОТЕИНАЗЫ:
У них адсорбционный центр имеет простое строение, их действие зависит только от тех аминокислот, которые формируют пептидную связь, гидролизуемую данным ферментом.
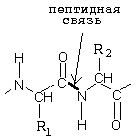
|
Пепсин
Это фермент желудочного сока. Синтезируется в клетках слизистой оболочки желудка в форме неактивного предшественника - пепсиногена. Превращение неактивного пепсиногена в активный пепсин происходит в полости желудка. При активации отщепляется пептид, закрывающий активный центр фермента. Активация пепсина происходит под действием двух факторов:
а) соляной кислоты (HCl)
б) уже образовавшегося активного пепсина - это называется аутокатализом.
Пепсин является карбоксильной протеиназой и катализирует гидролиз связей, образованных аминокислотами фенилаланином (Фен) или тирозином (Тир) в R2-положении (смотрите предыдущий рисунок), а также связь Лей-Глу. pH-оптимум пепсина равен 1.0-2.0 рН, что соответствует рН желудочного сока.
Реннин
В желудочном соке грудных детей переваривание белков осуществляет фермент РЕННИН, который расщепляет белок молока казеин. Реннин похож по строению на пепсин, но его рН-оптимум соответствует рН среды желудка грудного ребенка (рН=4.5). Реннин отличается от пепсина также механизмом и специфичностью действия.
Химотрипсин.
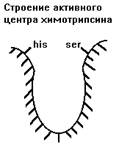
|
Синтезируется в поджелудочной железе в форме неактивного предшественника - химотрипсиногена. Активируется химотрипсин активным трипсином и путем аутокатализа. Разрушает связи, образованные карбоксильной группой тирозина (Тир), фенилаланина (Фен) или триптофана (Три) - в положении R1, либо крупными гидрофобными радикалами лейцина (лей), изолейцина (иле) и валина (вал) в том же положении R1 (смотрите рисунок).
В активном центре химотрипсина имеется гидрофобный карман, в который помещаются эти аминокислоты.
|
Трипсин
Синтезируется в поджелудочной железе в форме неактивного предшественника - трипсиногена. Активируется в полости кишечника ферментом энтеропептидазой при участии ионов кальция, а также способен к аутокатализу. Гидролизует связи, образованные положительно заряженными аминокислотами аргинином (Арг) и лизином (Лиз) в R1-положении. Его адсорбционный центр похож на адсорбционный центр химотрипсина, но в глубине гидрофобного кармана есть отрицательно заряженная карбоксильная группа.
Эластаза.
Синтезируется в поджелудочной железе в виде неактивного предшественника - проэластазы. Активируется в полости кишечника трипсином. Гидролизует пептидные связи в R1-положении, образованные глицином, аланином и серином.
Все перечисленные малоспецифичные протеиназы относятся к ЭНДОПЕПТИДАЗАМ, потому что гидролизуют связь внутри молекулы белка, а не на концах полипептидной цепи. Под действием этих протеиназ полипептидная цепь белка расщепляется на крупные фрагменты. Затем на эти крупные фрагменты действуют ЭКЗОПЕПТИДАЗЫ, каждая из которых отщепляет одну аминокислоту от концов полипептидной цепи.
ЭКЗОПЕПТИДАЗЫ.
Карбоксипептидазы.
Синтезируются в поджелудочной железе. Активируются трипсином в кишечнике. Являются металлопротеинами. Гидролизуют пептидные связи на “С”-конце молекулы белка. Бывают 2-х видов: карбоксипептидаза “А” и карбоксипептидаза “В”.
Карбоксипептидаза “А” отщепляет аминокислоты с ароматическими (циклическими) радикалами, а карбоксипептидаза “В” отщепляет лизин и аргинин.
Аминопептидазы.
Синтезируются в слизистой оболочке кишечника, активируются трипсином в кишечнике. Гидролизуют пептидные связи на “N”-конце молекулы белка. Существуют 2 таких фермента: аланинаминопептидаза и лейцинаминопептидаза.
Аланинаминопептидаза отщепляет только аланин, а лейцинаминопептидаза - любые “N”-концевые аминокислоты.
ДИПЕПТИДАЗЫ
Расщепляют пептидные связи только в дипептидах.
Все описанные ферменты относятся к МАЛОСПЕЦИФИЧНЫМ ПРОТЕИНАЗАМ. Они характерны для желудочно-кишечного тракта.
Действуя вместе, они вызывают тотальный протеолиз белковой молекулы до отдельных аминокислот, которые затем всасываются в кровь из кишечника.
Всасывание аминокислот происходит путем вторично-активного транспорта вместе с Na+(подобно глюкозе).
Часть аминокислот не всасывается и подвергается процессам гниения с участием микрофлоры в толстом кишечнике. Продукты гниения аминокислот могут всасываться и попадают в печень, где подвергаются реакциям обезвреживания. Подробнее об этом - смотрите учебник Коровкина, стр. 333-335.
Малоспецифичные протеиназы встречаются и в лизосомах.
ФУНКЦИИ ЛИЗОСОМАЛЬНЫХ МАЛОСПЕЦИФИЧНЫХ ПРОТЕИНАЗ:
1. Обеспечивают расщепление чужеродных белков, попавших в клетку.
2. Обеспечивают тотальный протеолиз собственных белков клетки (особенно при гибели клетки).
Таким образом, тотальный протеолиз - один из общих биологических процессов, необходимый не только для внутриклеточного пищеварения, но и для обновления стареющих белков клетки, и организма в целом. Но этот процесс находится под строгим контролем, который обеспечивают специальные механизмы, защищающие белки от избыточного действия протеаз.
МЕХАНИЗМЫ, ЗАЩИЩАЮЩИЕ БЕЛКИ ОТ ДЕЙСТВИЯ ПРОТЕИНАЗ:
1. Защита типа "клетки" - пространственная изоляция протеиназ от тех белков, на которые они могут подействовать. Внутриклеточные протеиназы сосредоточены внутри лизосом и отделены от белков, которые они могут гидролизовать.
2. Защита типа "намордника". Заключается в том, что протеиназы вырабатываются в виде неактивных предшественников (проферментов): например, пепсиноген (в желудке) трипсиноген и химотрипсиноген (в pancreas) Во всех этих предшественниках активный центр фермента прикрыт фрагментом полипептидной цепи. После гидролиза определенной связи эта цепочка отрывается и фермент становится активным.
3. Защита типа “кольчуги“. Защита белка-субстрата путем включения в его молекулу каких-либо химических структур (защитные группы, прикрывающие пептидные связи). Протекает тремя способами:
а) Гликозилирование белка. Включение в белок углеводных компонентов. Образуются гликопротеины. Эти углеводные компоненты выполняют некоторые функции (например, рецепторную функцию). Во всех гликопротеинах с помощью углеводной части обеспечивается также защита от действия протеиназ.
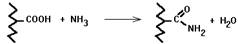
б) Ацетилирование аминогрупп. Присоединение остатков уксусной кислоты к свободным аминогруппам в молекуле белка.

|
Если протеиназа узнает место своего действия по наличию аминогруппы, то появление ацетильного остатка препятствует действию протеиназы на белок.
|
в) Амидирование карбоксильной группы. Защитный эффект аналогичен.
 г) Фосфорилирование радикалов серина или тирозина
г) Фосфорилирование радикалов серина или тирозина
4. Защита типа “сторожа“. Это защита белков с помощью эндогенных ингибиторов протеиназ.
Эндогенные ингибиторы протеиназ - это особые белки или пептиды, которые специально вырабатываются в клетке и могут взаимодействовать с протеиназой и блокируют ее. Хотя в связывании участвуют слабые типы связей, связывание протеиназы с эндогенным ингибитором прочное. Субстраты с высоким сродством к данной потеиназе могут вытеснять ингибитор из его комплекса с протеиназой, и тогда она начинает действовать. В плазме крови много таких ингибиторов и если появляется протеиназы, то ингибиторы их обезвреживают.
Обычно такие ингибиторы протеиназ являются специфическими по отношению к определенному классу протеиназ.
Ингибиторы сериновых протеиназ.
Самый активный ингибитор плазмы - альфа1-антитрипсин. Его концентрация в крови примерно 35 нмоль/л. Ингибирует в первую очередь эластазу, а при больших концентрациях ингибитора угнетает трипсин. Бывает, что его вырабатывается мало. Также может нарушаться процессинг этого белка. В результате он накапливается в гранулах, но не выделяется в активной форме в кровь. Это генетический дефект, и у гомозиготных по этому признаку больных могут развиться нарушения со стороны легких, а затем в печени (развиваются эмфизема и гепатит). У гетерозигот - склонность к развитию хронических воспалительных процессов.
В плазме крови есть и другие ингибиторы сериновых протеиназ: альфа1-антихимотрипсин, антитромбин, альфа2-антиплазмин.
Ингибиторы тиоловых протеиназ
Одним из наиболее важных ингибиторов этой группы - альфа2- макроглобулин.
альфа2-макроглобулин - универсальный ингибитор (блокирует протеиназы разных типов). Он не блокирует активные центры ферментов, а лишь захватывает протеиназу в ловушку, которая есть на поверхности макроглобулина. При таком взаимодействии активный центр фермента свободен и низкомолекулярные субстраты продолжают разрушаться протеиназой. Но в "ловушке" фермент уже не может сблизиться в достаточной степени с белковым субстратом. То есть альфа2-макроглобулин не просто ингибитор, а модулятор субстратной специфичности протеиназ. Если макроглобулин захватывает протеиназу в ловушку, то, например, плазмин, продолжает расщеплять молекулы фибрина (небольших размеров). Как только альфа2-макроглобулин захватывает в ловушку протеиназу, то он сразу изменяется и в результате освобождается участок, для которого многие клетки (лейкоциты, макрофаги) обладают специфическими рецепторами. Поэтому они связываются с комплексом “альфа2-макроглобулин-фермент”, фагоцитируют его и в лизосомах поглощенные белки полностью гидролизуются до аминокислот. Поэтому альфа2-макроглобулин называют еще "чистильщиком". 4% всех белков плазмы приходится на долю альфа2-макроглобулина, который по процентному содержанию является вторым после альбумина. Период полусуществования молекулы альфа2-макроглобулина составляет около 5-ти минут. Это означает, что за 5 минут обновляется половина содержащегося в плазме крови альфа2-макроглобулина.
Дата добавления: 2016-03-10; просмотров: 1350;
