Химические свойства воды.
Вода частично диссоциирует:
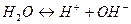
В такой форме вода практически не существует:
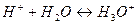 (ион гидроксония, является самой сильной кислотой)
(ион гидроксония, является самой сильной кислотой)
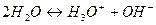
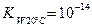
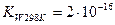
Вода – аморфное соединение:
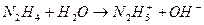
Вода может быть как окислителем, так и восстановителем.
Сильные окислители (рис., обл.3) окисляют воду с выделением кислорода:
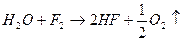
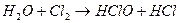
Рис.. зависимость потенциалов водородного и кислородного электродов от рН среды, парциальное давление равно 100 кПа.
Сильные восстановители (рис., обл.1) восстанавливают воду с выделением водорода:
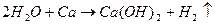
При повышенной температуре водяной пар взаимодействует с оксидом углерода (на железном катализаторе), а также с метаном (на никелевом катализаторе), при этом протекают реакции:

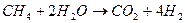
Вода реагирует с оксидами многих металлов и неметаллов с образованием гидроксидов:
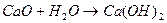
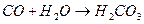
Вода является лигандом и координируется как катионами, так и анионами.
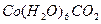
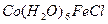
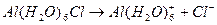
На один ион водорода и гидроксильную группу соответственно образуется протон, гидроксильная группа и 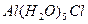 . Эта диссоциация достаточно сильная, Кд=10-5 (приблизительно равна Кд(СН3СООН)).
. Эта диссоциация достаточно сильная, Кд=10-5 (приблизительно равна Кд(СН3СООН)).
Вода взаимодействует с анионами слабых кислот и катионами слабых оснований, т.е. вступает в реакцию гидролиза с их солями:

Вода образует кристаллогидраты с некоторыми солями:
Вода при взаимодействии с различными ионами образует гидратированные формы ионов. В водном растворе не существует иона натрия, в воде образуется гидратированный ион натрия, количество молекул воды зависит от заряда: однозарядные гидраты связываются не менее, чем с четырьмя молекулами воды, двухзарядные – с шестью.
Вода катализирует протекание многих реакций (например, щелочные металлы взаимодействуют с каким-либо веществом при комнатной температуре только в присутствии следов воды).
Вода – участник и среда для протекания множества биохимических реакций в живых организмах. Жизнь человека, растений, животных и микроорганизмов связана с водными растворами. Одним из биологических катализаторов является энзимгидрагиназа, с помощью которой вода включается в биохимический процесс.
Т.к. молекулы воды полярны, они хорошо растворяют многие полярные и хорошо диссоциирующие соединения. В воде у таких веществ образуются водородные связи с ней (водой). Результатом этого может стать образование нового химического соединения.
Водородная связь.
Молекула воды Н2О образуется из атома кислорода и двух атомов водорода. Атом кислорода имеет два неспаренных электрона, которые занимают две р-орбитали, расположенные под углом 90° друг к другу. Атомы водорода имеют неспаренные 1s-электроны. Угол между двумя связями О-Н должен быть прямым или близким к нему.
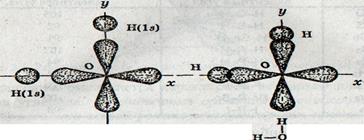
Рис. 3.4. Схема образования связей в молекуле воды.
Само название этого типа связи подчеркивает, что в ее образовании принимает участие атом водорода. Водородные связи могут образовываться в тех случаях, когда атом водорода связан с электроотрицательным атомом, который смещает на себя электронное облако, создавая тем самым положительный заряд δ+ на водороде.
Водородная связь — связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Водородная связь имеет частично электростатический, частично донорно-акцепторный характер.
В качестве примера рассмотрим образование водородной связи между двумя молекулами воды. Связи О-Н в Н2О имеют заметный полярный характер с избытком отрицательного заряда δ- — на атоме кислорода. Атом водорода, наоборот, приобретает небольшой положительный δ+ и может взаимодействовать с неподеленными парами электронов атома кислорода соседней молекулы воды:
О—Н… О—Н…
I
| Н8 |
Н
Водородную связь обычно схематично изображают точками.
Взаимодействие между молекулами воды оказывается достаточно сильным, таким, что даже в парах воды присутствуют димеры и тримеры состава (Н2О)2, (Н2О)з и т.д. В растворах же могут возникать длинные цепи ассоциатов (Н2О)n:
Энергия и длина водородной связи.
Энергия водородной связи растет с увеличением электроотрицательности и уменьшением размеров атома В, поэтому наиболее прочные водородные связи возникают, когда в качестве атома В выступают фтор, кислород и азот.
Энергия связи (в кДж/моль) увеличивается в следующем ряду:
H∙∙F (25 – 45)>H∙∙O 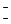 (13 – 19)>H∙∙N
(13 – 19)>H∙∙N 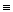 (8 – 21) (2)
(8 – 21) (2)
Несмотря на высокую электроотрицательность у хлора, водородная связь у него слабая из-за большого размера атома хлора.
Количество энергии, выделяющейся при образовании химической связи, называется энергией химической связи (кДж/моль (например, 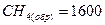 кДж/моль, тогда (
кДж/моль, тогда ( 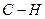 ) =400 кДж/моль)).
) =400 кДж/моль)).
Чем больше энергия химической связи, тем устойчивей молекула. Энергия водородной связи между любыми молекулами имеет промежуточное значение между энергией ковалентных связей и энергией вандерваальсовых сил (вандерваальсова сила<водородная связь< ковалентная связь), также промежуточное значение имеет длина водородной связи.
Влияние водородных связей на свойства вещества.
При воздействии водородных связей из мономеров различных веществ образуются полимерные структуры (димеры, триммеры и тетрамеры воды и полимеры HF). Например, молекула уксусной кислоты образует устойчивый димер и в растворах присутствует в таком связанном состоянии.
Более сложная конфигурация образуется за счет водородных связей в молекуле воды.
Соответственно, в жидком состоянии молекулы, вступающие в водородные связи, ассоциированы, а в твердом состоянии они могут образовывать твердую кристаллическую структуру.
Образование водородных связей приводит к существенным изменениям свойств вещества: повышению вязкости, диэлектрической постоянной, температуры кипения, температуры плавления, теплот плавления и парообразования. Все это мы видим на примере молекул воды.
Прочность водородной связи.
Водородная связь 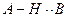 , прочность связи при одинаковом В увеличивается по мере возрастания дипольной связи А-Н, следовательно, если сохраняется постоянное значение В, то прочность водородной связи увеличивается в следующем ряду:
, прочность связи при одинаковом В увеличивается по мере возрастания дипольной связи А-Н, следовательно, если сохраняется постоянное значение В, то прочность водородной связи увеличивается в следующем ряду:
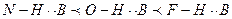 .
.
При одинаковом А-Н рассмотрим влияние В на силу водородной связи. Как было указано выше, В должен обладать большей электроотрицательностью и меньшим размером атома, чтобы прочность водородной связи была высока, поэтому выполняется неравенство (2).
Если А и В одинаковы, то чем больше электроотрицательность элемента, тем прочнее связь.
Химико-технологическая характеристика природных вод.
Понятие стабильной и агрессивной воды.
По химическому составу примеси в природной воде подразделяются на органические и неорганические.
Органические имеют очень сложный состав и находятся в коллоидном или истинном состоянии.
Неорганические примеси находятся, в основном, в виде ионов: 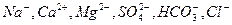 .
.
В воде, кроме того, растворены различные газы: 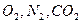 и т.д.
и т.д.
В воде содержатся карбонаты, при этом часть карбонатов гидролизуется, в результате образуется сложная система, включающая такие анионы как, 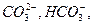 а также молекулу воды и
а также молекулу воды и 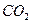 . Если рассмотреть систему, включающую все эти ионы, то выглядеть она будет в виде ряда равновесных процессов:
. Если рассмотреть систему, включающую все эти ионы, то выглядеть она будет в виде ряда равновесных процессов:
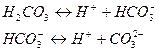
Обе эти ступени обеспечивают систему 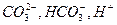 и т.д.
и т.д.
При повышении рН равновесие сдвигается в сторону образования 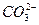 , и наоборот, при уменьшении рН равновесие смещается в строну образования угольной кислоты. Последний процесс имеет место при рН<6.
, и наоборот, при уменьшении рН равновесие смещается в строну образования угольной кислоты. Последний процесс имеет место при рН<6.
Вода, в которой 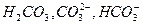 находятся в равновесии, называется стабильной водой.
находятся в равновесии, называется стабильной водой.
При сдвиге равновесия в сторону образования 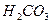 , вода становится агрессивной, при этом увеличивается ее коррозионная способность. Повышение рН, влияющее на сдвиг равновесия в сторону образования карбонат ионов, приводит к тому, что из воды начинают выделяться карбонаты различных металлов, в первую очередь
, вода становится агрессивной, при этом увеличивается ее коррозионная способность. Повышение рН, влияющее на сдвиг равновесия в сторону образования карбонат ионов, приводит к тому, что из воды начинают выделяться карбонаты различных металлов, в первую очередь 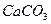 . Нестабильная вода может быть либо агрессивной, либо превращаться из гомогенной в гетерогенную систему.
. Нестабильная вода может быть либо агрессивной, либо превращаться из гомогенной в гетерогенную систему.
Жесткость воды.
Жесткость воды отражает содержание в ней ионов кальция и магния, она выражается в ммоль экв./л и определяется как сумма эквивалентов ионов кальция и магния. Из всех солей относящихся к солям жесткости, выделяют гидрокарбонаты, сульфаты и хлориды. Содержание других растворимых солей кальция и магния в природных водах очень мало. Жесткость, придаваемая воде гидрокарбонатами, называется гидрокарбонатной или временной, т.к. гидрокарбонаты при кипячении воды(точнее при температуре более 60С)разлагаются с образованием малорастворимых карбонатов:
СаНСО3-СаСО3+Н2О+СО2
В природных условиях эта реакция обратима, однако при выходе на поверхность подземных вод, обладающих значительной временной жесткость, равновесие сдвигается в сторону образования СО2, который удаляется в атмосферу. Этот процесс приводит к разложению гидрокарбонатов и выпадению в осадок СаСО3 и MgCO3. Таким путем образуется разновидности карбонатных пород, называемые известняковыми туфами. В присутствии в воде растворенного СО2 протекает и обратная реакция. Так происходит растворение карбонатных пород в природных условиях.
Жесткость, обусловленная хлоридами или сульфатами, называется постоянной, поскольку эти соли устойчивы при нагревании и кипячении воды. Суммарная жесткость воды, т.е. общее содержание растворимых солей кальция и магния , получила название общей жесткости.
Т.к.солями жесткости являются соли разных катионов, имеющие разную молекулярную массу, жесткость воды измеряют в единицах эквивалентной концентрации, моль*экв/л или моль*экв/л. При жесткости до 4 моль*экв/л вода считается мягкой, Ж от 4-8 моль*экв/л средней жесткости ; Ж 8 – 12 моль*экв/л жесткая; Ж >12 моль*экв/л-очень жесткой.
В среднем, жесткость речной воды равна 1 – 6, ПДК (питьевая вода) 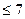 .
.
Щелочность воды.
Щелочность обусловлена присутствием в воде веществ, содержащих гидроксо-анион, а также веществ, реагирующих с сильными кислотами (соляной, серной). К таким соединениям относятся:
• сильные щелочи (КОН, NаОН) и летучие основания (NН4ОН). а также анионы, обуславливающие высокую щелочность в результате гидролиза в водном растворе при рН > 8,4 (СО32-, S2-, РО42-)
* слабые основания и анионы летучих и нелетучих слабых кислот (НСО3, Н2РО4 , НРО42-, СНзСОО, анионы гуминовых кислот ) .
Щелочность пробы воды измеряется в моль-экв/л или ммоль-экв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,01 или 0,1 моль-экв/л), израсходованной на нейтрализацию раствора.
При нейтрализации до значения рН 8,0-8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом ве-личина называется свободной щелочностью. При нейтрализации до «качений рН 4,2-4,5 в качестве индикатора применяют метиловый оранжевый. Установленная по этому индикатору величина называется общей щелочностью. При рН = 4,5 проба воды имеет нулевую щелочность.
Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов, которые вносят значительный вклад в минерализацию воды. Соединения первой группы могут содержаться также в сточных и поверхностных загрязненных водах.
Щ=[HCO3-]+[ CO3-]+[OH-]
Солесодержание.
Солесодержание – характеристика воды, которая определяется общей концентрацией солей.
Состав природных вод зависит от их вида и расположения водоема (источника воды). Воды рек имеют невысокое содержание (0,5 – 0,6 г/л), более высокое содержание имеют подземные воды. Содержание в морях и океанах примерно одинаково и составляет 35 г/л. Главными компонентами, обеспечивающими солевой состав, являются натрий и хлор. Содержание солей во внутренних морях меньше, чем в океанах и открытых морях (в Каспийском: 3 – 13 г/л, в Черном: 7 -18 г/л).
Кислотность
Кислотность воды обусловлена содержанием в воде веществ. реагирующих с гидроксо-анионами. К таким соединениям относятся:
1) сильные кислоты - НС1, НNО3, Н2SО4;
2) слабые кислоты -СНзСООН, Н2SО3, Н2СО3, Н2S и т.п.;
3) катионы слабых оснований - МН/, катионы органических аммонийных соединений.
Кислотность пробы воды измеряется в моль-экв/л или в ммоль-экв/л и определяется количеством сильной щелочи (обычно используют растворы КОН или NаОН с концентрацией 0.05 или 0.1 моль-экв/л/
Кислотность (перманганатную и бихроматную) определяет содержание примесей, способных взаимодействовать с окислителями, т.е. определяет восстановительный потенциал.
Биохимическое потребление кислорода (БПК).
Определяет расход кислорода на разложение органических веществ путем окисления бактериями, использующими эти вещества в метаболизме. Определяется БПК по изменению концентрации кислорода в воде до и после ее выдержки в темноте в течение пяти суток при 20ºС – БПК5. Определяют также БПК полное.
По БПК судят о степени загрязнении воды.
Вода с БПК до 30 мг/л – практически чистая;
С БПК=30 – 80 мг/л – слабозагрязненная;
С БПК>80 – сильнозагрязненная.
Хлорность воды.
В воде открытого океана независимо от абсолютной концентрации количественное соотношение между главными компонентами основного солевого состава постоянно (закон Дигмера). Эта зависимость……
Среди катионов:
Na+ >Mg2+ >Ca 2+ ≥ другие катионы
Среди анионов:
C l-> 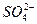 > Br-≥ другие анионы.
> Br-≥ другие анионы.
Благодаря закону Дигмера можно определить экспериментально концентрацию одного «рейперного» компонента, рассчитать содержание остальных. В качестве такого рейперного компонента выбрана достаточно легкоопределяемая величина – хлорность, т.е. число граммов ионов хлора, эквивалентное сумме ионов галогенов, осаждаемых нитратом серебра ( 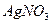 ), содержащееся в одном килограмме воды. Единицей измерения хлорности является промилле (‰).
), содержащееся в одном килограмме воды. Единицей измерения хлорности является промилле (‰).
Агрессивность воды.
Показатель агрессивности природных вод отражает способность природной воды перевести вещество в раствор:
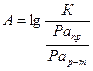
 , где
, где
А – показатель агрессивности воды;
К – константа растворения данного вещества;
Ра – произведение активностей продуктов реакции, содержащихся в воде, и реагентов, содержащихся в растворяемом веществе, соответственно.
Показатель агрессивности часто используют для сравнения растворяющей способности природных вод. Чем больше показатель, тем в большей степени система неравновесна и тем более интенсивно протекает процесс растворения данного вещества.
Показатель неустойчивости.
Степень удаленности системы от состояния равновесия характеризуется показателем неустойчивости. Этот показатель удобно использовать при сравнении устойчивости различных твердых веществ по отношению к одной и той же природной воде. Чем больше показатель, тем данное вещество менее устойчиво. Показатель неустойчивости обратно пропорционален показателю агрессивности (I=1/A).
Способность воды к растворению.
Самая удивительная способность воды – растворение.
Способность веществ к растворению зависит от их диэлектрической постоянной: чем она выше, тем больше способно вещество растворять другие вещества. Для воды эта величина больше в девять раз, чем у воздуха и вакуума, следовательно, ультрапресные и чистые воды не существуют.
В земной воде всегда что-то растворено: газы, молекулы или ионы химических веществ. В водах Мирового океана обнаружено более 80 элементов. Предполагается, что там могут быть растворены все элементы периодической таблицы.
Природные воды – растворы. Раствор – жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которой могут изменяться в значительных пределах.
Водные растворы представляют собой одну из наиболее важных представителей растворов, без которых невозможна органическая жизнь:
- истинные (молекулярно-ионные) растворы – растворы, в которых размеры растворенных частиц меньше
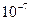 см., т.е. размеры самих молекул;
см., т.е. размеры самих молекул; - коллоидные растворы – растворы, в которых размеры растворенных частиц находятся в интервале от
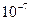 до
до 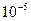 см. В природе коллоидные растворы встречаются очень часто (например, к ним относятся растворы органических соединений в клетках живых организмов и продукты их распада). Существует три типа коллоидных частиц, в соответствие с которыми коллоидные растворы делятся на три группы:
см. В природе коллоидные растворы встречаются очень часто (например, к ним относятся растворы органических соединений в клетках живых организмов и продукты их распада). Существует три типа коллоидных частиц, в соответствие с которыми коллоидные растворы делятся на три группы:
а). суспензоиды – коллоидные растворы металлов, окислов химических элементов, солей;
б). ассоциативные (мицеллярные) коллоидные растворы образованы низкомолекулярными веществами, объединенными в агрегаты молекул (мицеллы). Например, растворы 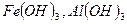 . При этом коллоидные частицы (мицеллы) имеют положительный заряд, хотя большинство при рН = 6,5 – 7,5 имеют на мицелле отрицательный заряд. Наличие электрического заряда препятствует коагуляции. Такая дисперсная система может существовать неопределенно долго, несмотря на то, что
. При этом коллоидные частицы (мицеллы) имеют положительный заряд, хотя большинство при рН = 6,5 – 7,5 имеют на мицелле отрицательный заряд. Наличие электрического заряда препятствует коагуляции. Такая дисперсная система может существовать неопределенно долго, несмотря на то, что 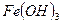 малорастворим;
малорастворим;
в). Молекулярные коллоиды. К ним относятся растворы природных и синтетических высокомолекулярных веществ с высокой молекулярной массой от 10 тысяч до нескольких миллионов а.е.м.. Молекулы этих веществ соизмеримы с размерами коллоидных частиц и являются макромолекулами. Эти коллоиды способны превращаться в гели или студни. Высушенные студни, в отличие от гелей, способны вновь набухать в воде. Особенностью геля является способность восстанавливать структуру после прекращения механического воздействия на гель в определенных размерах, этим они отличаются от золя. Например, раствор гемоглобина – коллоидный раствор, молекулярная масса равна 64 500 а.е.м.
Если размеры частиц в растворе больше или равны 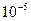 см, то нарушается характерная особенность раствора – его однородность, поэтому, это уже не растворы, а механические смеси (суспензии). При этом частицы с размером
см, то нарушается характерная особенность раствора – его однородность, поэтому, это уже не растворы, а механические смеси (суспензии). При этом частицы с размером 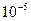 см образуют тонкие суспензии, больше
см образуют тонкие суспензии, больше 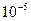 см – грубые суспензии (взвеси). Если агрегатное состояние такой частицы жидкое, то образуются эмульсии.
см – грубые суспензии (взвеси). Если агрегатное состояние такой частицы жидкое, то образуются эмульсии.
Растворимость твердых веществ.
При соприкосновении твердого вещества с водой ионы или молекулы, составляющие решетку, взаимодействуют с диполями воды, возникают ионно-дипольные связи. Если они окажутся прочнее кристаллизационной связи, то ионы отрываются от кристалла и переходят в раствор. Этому процессу также способствует непрерывное тепловое движение молекул.
Перешедшие в раствор ионы окружены молекулами воды, образующиеся гидратные оболочки ионов неустойчивы, но иногда прочные. При кристаллизации связи сохраняются и образуются кристаллогидраты. Например, 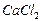 , растворяясь в воде, захватывает две молекулы воды ионами кальция и хлора, которые остаются в составе кристаллической решетки этого вещества при удалении растворителя (воды), следовательно, образовавшийся кристаллогидрат –
, растворяясь в воде, захватывает две молекулы воды ионами кальция и хлора, которые остаются в составе кристаллической решетки этого вещества при удалении растворителя (воды), следовательно, образовавшийся кристаллогидрат – 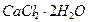 .
.
Существует правило образования гидратированных ионов:
- катионам свойственна более сильная гидратация, чем анионам.
Гидратационное число катионов (число молекул воды) щелочных металлов при первичной гидратации минимум равно 4, в то время как для галоидных ионов оно меняется от 1 до 4 (максимально). В нашем примере показано на натрии минимальное гидратационное число, а на хлоре – максимальное.
- чем больше заряд иона, тем сильнее он гидратируется (гидратационное число магния равно 6 – 12).
- при одинаковом заряде сильнее гидратируются ионы, имеющие меньший кристаллический радиус.
Зависимость растворимости твердых веществ и жидкостей от температуры, давления и солености.
При растворении твердых тел и жидкостей одновременно с прямым процессом (растворение) идет обратный процесс (кристаллизация). Чем больше площадь соприкосновения с водой, тем больше вещества в единицу времени раствориться водой. Скорость растворения 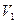 пропорциональна площади кристалла, а скорость кристаллизации
пропорциональна площади кристалла, а скорость кристаллизации 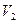 определяется концентрацией уже растворившихся ионов. Когда
определяется концентрацией уже растворившихся ионов. Когда 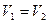 устанавливается динамическое равновесие, наступает состояние насыщения. У насыщенных растворов дальнейшее растворение возможно только при увеличении их температуры. При этом усиливается тепловое движение частиц в кристаллической решетке, силы стяжения ослабеваются, и ионы или молекулы из кристаллической решетки легче разрушаются или переводятся в раствор молекулами воды, и наоборот. Таким образом, растворимость веществ в воде зависит не только от природы вещества, но и от температуры.
устанавливается динамическое равновесие, наступает состояние насыщения. У насыщенных растворов дальнейшее растворение возможно только при увеличении их температуры. При этом усиливается тепловое движение частиц в кристаллической решетке, силы стяжения ослабеваются, и ионы или молекулы из кристаллической решетки легче разрушаются или переводятся в раствор молекулами воды, и наоборот. Таким образом, растворимость веществ в воде зависит не только от природы вещества, но и от температуры.
Влияние температуры на растворимость зависит от изменения 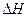 (энтальпии), которым сопровождается процесс растворения. Если растворение веществ представляет собой эндотермический процесс, то растворимость этих веществ увеличивается с ростом температуры; если процесс экзотермический – растворимость уменьшается с ростом температуры. Это можно объяснить с помощью принципа Ле-Шателье:
(энтальпии), которым сопровождается процесс растворения. Если растворение веществ представляет собой эндотермический процесс, то растворимость этих веществ увеличивается с ростом температуры; если процесс экзотермический – растворимость уменьшается с ростом температуры. Это можно объяснить с помощью принципа Ле-Шателье:
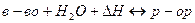 (1)
(1)
На схеме (1) описан эндотермический процесс, если повысить температуру, то равновесие сместиться вправо, понизить температуру – влево.
В соответствие с кривой растворимости на графике процесс растворения соли 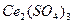 – экзотермический процесс.
– экзотермический процесс.
Зависимость растворимости ионно-кристаллических веществ от температуры.
Вещества с одинаковым типом межмолекулярных сил притяжения имеют тенденцию взаиморастворения, т.е. подобное растворяется в подобном.
Растворимость твердых и жидких веществ мало зависит от давления в виду слабой сжимаемости воды.
С увеличением солености (увеличения концентрации электролитов), растворимость твердых веществ растет (солевой эффект), а в случае присутствия в растворе одноименных ионов, растворимость может уменьшиться (эффект одноименного иона).
Растворимость газов в воде. Зависимость растворимости газов от их природы, температуры и солености воды.
Растворимость газов в воде уменьшается в следующем ряду (t = 20ºC):
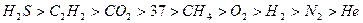 .
.
Растворимость измеряется в 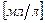 при общем давлении Р = 1 атм. И соответствующем парциальном давлении.
при общем давлении Р = 1 атм. И соответствующем парциальном давлении.
Есть газы, растворимость которых очень велика: 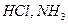 .
.
При растворимости газов в воде могут протекать реакции их взаимодействия с водой, поэтому растворимость газов определяется многофакторностью процессов.
Зависимость растворимости газов от давления (единичный фактор) определяется законом Генри: «Растворимость газов в данном объеме жидкости при постоянной температуре прямо пропорциональна давлению газа».
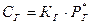 , где
, где
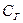 - растворимость газов в жидкости,
- растворимость газов в жидкости, 
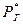 - парциальное давление данного газа над водным раствором,
- парциальное давление данного газа над водным раствором, 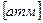
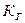 - коэффициент пропорциональности, константа Генри. Этот коэффициент выражает растворимость данного газа при давлении Р = 1 атм. Например, растворимость азота при t = 25 ºC и Р = 0,78 атм. равна
- коэффициент пропорциональности, константа Генри. Этот коэффициент выражает растворимость данного газа при давлении Р = 1 атм. Например, растворимость азота при t = 25 ºC и Р = 0,78 атм. равна 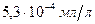 , если удвоить давление в два раза, то растворимость увеличится в два раза.
, если удвоить давление в два раза, то растворимость увеличится в два раза.
Растворимость смеси газов определяется законом Генри-Дальтона: «Растворимость каждой части смеси газов в жидкости прямо пропорциональна парциальному давлению данной составной части над другой».
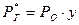 , где
, где
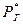 - парциальное давление компонента смеси,
- парциальное давление компонента смеси, 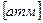
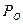 - общее давление,
- общее давление, 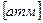
 - мольная доля данного газа в смеси.
- мольная доля данного газа в смеси.
На основании закона Генри-Дальтона можно объяснить, почему в природных водах, соприкасающихся с воздухом, азота содержится больше, чем кислорода, хотя растворимость у азота меньше. Если содержание азота в воздухе равно 78%, а кислорода – 21%, то соотношение 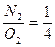 , то
, то 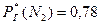 . И растворимость этих газов при t = 0ºC будет следующая:
. И растворимость этих газов при t = 0ºC будет следующая:
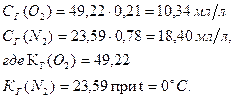
Что и составляет отношение растворенных в природных водах газов 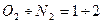
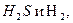 парциальное давление, которых в атмосферном воздухе приближается к нулю, не могут в нормальных условиях накапливаться в воде у поверхности водоемов.
парциальное давление, которых в атмосферном воздухе приближается к нулю, не могут в нормальных условиях накапливаться в воде у поверхности водоемов.
Растворимость газов зависит также от температуры и солености воды.
В отличие от твердых веществ и жидкостей, растворимость газов с ростом температуры уменьшается. Также уменьшается растворимость газов и с ростом солености. Кроме того, фактическое содержание газов в природных водах определяется также интенсивностью химических, биологических и гидрологических (перемешивание, вертикальная зимняя циркуляция и др.) процессов, поэтому часто содержание многих газов и обязательно кислорода, азота и углекислого газа выражают в процентах от их насыщающего количества. За насыщение системы газа принимают то количество газа, которое может раствориться в воде при данной температуре и данной солености (при сухом атмосферном воздухе и нормальном давлении).
Дата добавления: 2016-02-10; просмотров: 939;
