Рассказ первый - порядок из хаоса
Первый критерий: что-нибудь, где-нибудь должно изменяться
Начнем с логического начала. Если память требует изменений в биохимии и структуре определенных клеток, значит, при образовании энграмм что-то и где-то в мозгу должно изменяться, но мы не знаем точно, что и где. Хуже того, анатомическое строение мозга у кур сильно отличается от его строения у млекопитающих, и до сих пор нет хорошего атласа; поэтому мне нельзя было опираться на догадки, на которые наводит знакомство с мозгом млекопитающих: у цыплят, в частности, нет того, что я мог бы назвать гиппокампом. В связи с этим для начала мне нужен был метод, который не зависел бы от локализации и механизмов изучаемых процессов. Практически любой биохимический процесс, в особенности связанный с повышением активности нейронов и синтезом в них макромолекул, требует затраты энергии. Мозг получает энергию, сжигая глюкозу; поэтому, установив, где и когда используется больше глюкозы в первые минуты после обучения, можно узнать, какая область мозга имеет отношение к хранению следов памяти. К счастью, для этого имеется довольно простой способ. Он основан на применении синтетического вещества, очень похожего на глюкозу - 2-дезоксиглюкозы (2-дГ). Если 2-дГ ввести в кровяное русло, нейроны (и все другие клетки тела) будут обмануты и начнут поглощать ее так же, как глюкозу. Внутри клетки первый же из набора ферментов, расщепляющих глюкозу, тоже примет 2-дГ за природный сахар и станет превращать ее в 2-дезоксиглюкозо-6-фосфат (2-дГ-6Ф). Это первый этап нормального расщепления глюкозы. Однако следующий по порядку фермент, который должен был бы воздействовать на глюкозо-6-фосфат, оказывается умнее и не желает иметь дело с 2-дГ-6Ф. Поэтому последний накапливается в клетках, и его количество служит мерой того, сколько они используют глюкозы. Если вводимая в кровоток 2-дГ содержит радиоактивную метку, то происходит накопление меченого 2-дГ-6Ф, и остается только измерить радиоактивность в клетке.
Согласно плану эксперимента, 2-дГ вводят цыплятам, клюющим смоченные метилантранилатом или водой бусины, выжидают полчаса, чтобы в клетках накопился 2-дГ-6Ф, забивают цыплят, извлекают и замораживают их мозг, а потом измеряют в нем радиоактивность. Но задача состоит не в том, чтобы просто выяснить, возросло ли содержание метки в мозгу обученных птенцов по сравнению с контрольными; нужно еще установить, в каком отделе мозга это произошло. Вот здесь-то и нужна методика с использованием 2-дГ. Замороженный мозг помещают в лабораторную разновидность миниатюрной мясорезки, называемую криостатом, и делают серию очень тонких срезов. Срезы переносят на предметные стекла, которые затем прижимают к листу рентгеновской пленки, заворачивают в черную светонепроницаемую бумагу и оставляют в темной комнате. После этого остается подождать несколько дней или месяцев (сроки зависят от количества радиоактивности) и проявить пленку, называемую теперь радиавтографом (а сам процесс называют радиавтографиеи).
Каждый срез оставит на пленке отпечаток, который будет тем темнее, чем больше радиоактивной метки содержалось в ткани. Степень затемненности каждого участка измеряют с помощью автоматического сканера, который своим тонким лучом прощупывает изображение и регистрирует поглощение света. С помощью компьютера черно-белое изображение можно перевести в цветное, которое легче и приятнее рассматривать, хотя цвета совершенно условны и не дают никакой дополнительной информации. Теперь можно сравнить количество метки последовательно в каждом отделе мозга контрольных и обучавшихся цыплят и попытаться выявить разницу. Я проводил такой опыт четыре сумасшедших недели в 1980 году вместе с фанатично преданной делу Маргарет Кошут - специалистом по радиоавтографии из Варшавы, а на следующий год повторил его более углубленно с нейроанатомом из Будапешта Андрашем Чиллагом, который помог идентифицировать те анатомические структуры, где Маргарет и я обнаружили изменения.
Результаты были ясны. Два участка - IMHV (Intermediate Medial Hyperstriatum Ventrale) и LPO (Lobus Parolfactorius) - «светились» у обученных животных сильнее, чем у контрольных. При этом сразу после обучения содержание радиоактивной метки было особенно высоким в левом IMHV и в левом LPO. Иначе говоря, несмотря на двустороннюю симметрию куриного мозга, состоящего, как и у млекопитающих, из двух внешне идентичных полушарий, эффект обучения был асимметричен: научением у цыплят в большей мере ведало левое полушарие [5]1.
*1) Существует множество усердно распространяемых мифов и почти мистических истолкований асимметрии человеческого мозга, от радикально-феминистских взглядов и идей биологического детерминизма о левосторонней рассудочной природе мужского мозга и правосторонней эмоциональной природе мозга женщин до утверждений нейропсихолога сэра Джона Эклса - католика и лауреата Нобелевской премии - о том, что функциональная асимметрия свойственна только человеку и что левое полушарие служит пристанищем души [6]. Хотя в наши дни этот почти нездоровый интерес к возможной роли и уникальности асимметрии нашего мозга облечен в изощренные формулировки современной неqробиологии, своими корнями он уходит во вторую половину XIX века. Именно тогда, исходя из результатов посмертного вскрытия людей, утративших дар речи (афазия) в результате инсульта или иных поражений мозга, французский нейроанатом Поль Брока установил локализацию «речевого центра» в левой лобной доле. На этом основании Брока, в вслед за ним и многие другие разработали целый спекулятивный аппарат для доказательства уникальности функциональной асимметрии (латерализации) мозга у человека и значительно большей ее выраженности у мужчин и белых по сравнению с женщинами, детьми и чернокожими. И тогда, и теперь это обычно не более чем идеологические фантазии [7]. Но если Эклс прав и функциональная латерализация действительно нужна для существования души, то любой из моих цыплят может в такой же степени претендовать на обладание ею, как и сам сэр Джон.
Эти результаты были важны для нас по нескольким причинам. Во-первых, было очень интересно найти изменение в IMHV после выработки пассивного избегания, потому что Габриел Хорн раньше уже показал ключевую роль этой области мозга в импринтинге. Результаты экспериментов с пассивным избеганием и импринтингом начинали совпадать, что было хорошей новостью для обеих лабораторий. Но ни его, ни наша лаборатория не имела ни малейшего понятия, какой может быть функциональная связь (если она вообще существует) между IMHV и LPO или какова роль каждой из этих областей в деятельности мозга. Насколько мы знали, у цыплят IMHV представляет собой нечто вроде «ассоциативной коры» млекопитающих - области, где сходятся и, вероятно, интегрируются сигналы от многих сенсорных систем. Еще меньше ясности было в отношении LPO. Некоторые исследователи считали эту долю в основном «выходной» областью, координирующей двигательные реакции, в том числе клевание. По мнению других, она имела больше отношения к эмоциональным реакциям птиц, во всяком случае к чувству опасности и к ощущению неприятного вкуса (рис. 10.2).
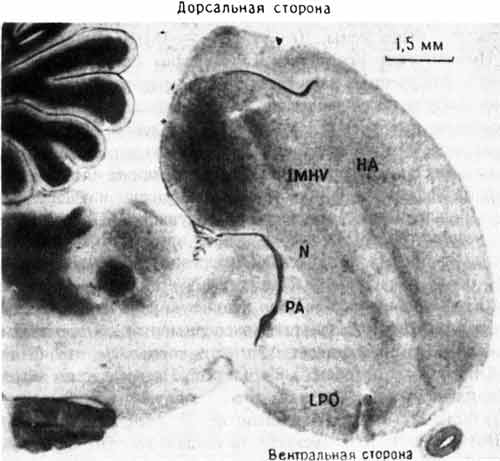
Рис. 10.2. Разрез переднего мозга цыпленка. На этой микрофотографии показано расположение IMHV и LPO. Другие отделы мозга: НА - hyperstriatum accessorium; N - neostriatum; PA - paleostriatum augmentatum. Темноокрашенная древовидная структура слева вверху - мозжечок.
Во-вторых, полученные результаты подтвердили то, о чем мы уже начинали догадываться: выраженную функциональную разницу между левой и правой частями мозга у кур. Накапливалось все больше данных о латерализации функций в мозгу у птиц; в частности, цыплята ведут себя по-разному, реагируя на предметы, которые видят правым или левым глазом [8], тогда как у певчих птиц, таких, как канарейки и зебровые амадины, «центр пения» расположен в одном из отделов левого полушария довольно близко к IMHV [9]. Но в то время мы не представляли себе, о чем могут говорить эти различия между двумя половинами мозга. Некоторые догадки появятся в конце следующей главы.
В-третьих, эти результаты имели и практическое значение: теперь мы узнали, где следует искать другие возможные изменения. Сконцентрировав внимание на IMHV и LPO и отбрасывая «ненужные» нам ткани, мы могли надеяться усилить любой изучавшийся эффект путем снижения уровня фонового шума. Обе указанные области очень малы; иссеченные из мозга, они весят не более двух миллиграммов каждая. Андраш придумал специальную пластмассовую форму, в которую мы помещали мозг, делали его срезы бритвенным лезвием, а потом тонким скальпелем вырезали под микроскопом нужные участки. Теперь мы были готовы двигаться дальше.
Второй критерий: ход изменений во времени.
А. Биохимия
Если выводы Мэри Гиббс о фазах памяти (см. рис. 10.1) были верны, то следовало ожидать, что в первые минуты или часы после клевания горькой бусины в левых, а возможно, и в правых IMHV и LPO будет происходить ряд клеточных изменений, связанных с этими фазами. Поскольку в следующих абзацах речь пойдет о чистой биохимии и я не вижу способа избежать этого, читатель, который не переносит всех этих подробностей, может найти обобщенную схему описываемых процессов на рис. 10.3, а потом перепрыгнуть сразу на страницу 34. Но биохимия - мой хлеб, и я искренне надеюсь, что все эти детали заслуживают хотя бы беглого знакомства с ними.
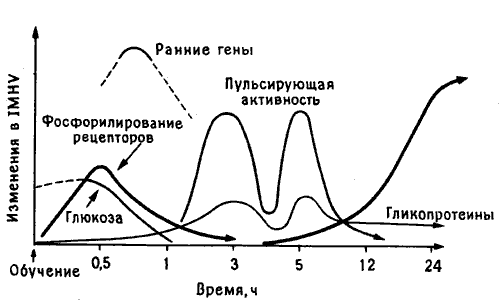
Рис. 10.3. Молекулярный каскад памяти. Кривые схематически показывают последовательность молекулярных изменений, наблюдаемых в IMHV цыпленка в разные сроки после опыта с горькой бусиной.
Мы еще раньше обнаружили кратковременное повышение активности мускариновых рецепторов ацетилхолина. Если бы я работал, как полагается, систематически, то я должен был бы вернуться назад и подробно выяснить, что происходит с этими и другими рецепторами в IMHV. Но я сделал это лишь спустя несколько лет и показал тогда, что сильнее всего изменялось содержание NMDA-рецепторов для глутамата, о которых я говорил в предыдущей главе (и не буду касаться их снова). Но сначала мое внимание привлекли полученные на гиппокампе данные о роли фосфорилированных белков в синаптических мембранах (см. гл. 9). Я не мог устоять перед искушением изучить их у цыплят, может быть потому, что много лет назад моя собственная диссертация была посвящена этим белкам, хотя тогда я не осознавал в полной мере их значение (см. гл. 3).
Пре- и постсинаптические мембраны можно выделить из IMHV методом центрифугирования, примерно так, как описано в главе 3, и исследовать их в чистом виде. Разумеется, они содержат и белки, и фосфорилирующий их фермент протеинкиназу С. Если к ничтожному количеству мембранного материала добавить радиоактивный АТФ и несколько минут инкубировать полученную смесь в крошечной пробирке, мембранные белки окажутся мечеными и фосфорилированными. Другой простой, но остроумный метод позволяет выделить отдельные белки и измерить количество радиоактивной метки в каждом из них. В этом методе используются различия в молекулярном весе и электрических свойствах между сотнями присутствующих в мембранах белков, каждый из которых несет на себе специфический набор положительных и отрицательных зарядов. Для того чтобы разделить такие белки, берут небольшую прямоугольную полоску из студенистого инертного материала - крахмального или акриламидного геля, наносят на один ее конец каплю раствора с белковой смесью и пропускают через гель электрический ток. Белки перемещаются под действием тока с разной скоростью, зависящей от их молекулярного веса и электрического заряда, и через несколько часов распределяются по всей длине полоски. Эта процедура называется, гель-электрофорезом. Гель пропитывают красителем, который окрашивает белки, и они становятся видны на бесцветном фоне геля как последовательность синих полос, похожих на линии, проведенные чернилами. Участки геля, содержащие разные белки, вырезают бритвенным лезвием и определяют их радиоактивность, или же весь гель накладывают на рентгеновскую пленку и получают радиоавтограф, точно так же как в опытах с 2-дГ1.
В итоге получается то, что представлено на рис. 10.4.
*1) Моя самая первая книга, вышедшая много лет назад, была посвящена вопросам биохимии. Пытаясь рассказать, как проводятся биохимические исследования, я рискнул сравнить лабораторию с кухней. Мне казалось, что по-настоящему необычное в нашей работе состоит в том, что мы используем такие мощные аппараты, как центрифуги, способные создавать гравитационное поле порядка полумиллиона g и больше, такие чрезвычайно опасные агенты, как радиоизотопы и высокоактивные токсины, можем измерять неуловимо малые количества вещества в миллиардные доли грамма, тогда как наши общие принципы разделения и манипуляций с материалами прекрасно знакомы любой хозяйке, умеющей приготовить соус или испечь пирог.
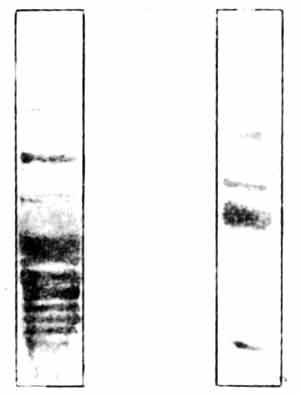
Рис. 10.4. Белки синаптических мембран. На рисунке показаны два геля. Пробы синаптических мембранных белков наносили на верхние концы гелей и в течение нескольких часов подвергали электрофорезу. При этой процедуре тысячи различных белков с разной скоростью мигрируют вдоль геля. Гель слева обработан красителем, выявляющим белки. Обратите внимание на множество полос, каждая из которых представляет один или большее число мигрирующих белков. Справа показан гель, в котором методом радиавтографии установлена локализация продуктов фосфорилирования белков левого геля. Из множества белков фосфорилированию подверглись лишь около четырех. Наиболее интенсивно окрашенная полоса в средней части геля - белок В50 с мол. массой около 50 000; это специфический пресинаптический белок, и именно он изменяется в результате обучения.
Мы измеряли фосфорилирование белков в синаптических мембранах из мозга цыплят в разные сроки после обучения и установили, что спустя 30 минут после клевания горькой бусины усиливалось фосфорилирование одного из ключевых пресинаптических белков. Это изменение не было долговременным и через три часа после обучения уже исчезало. Спустя полчаса после обучения возрастала также активность протеинкиназы С в мембранах левого IMHV [110].
Таким образом, при обучении происходило временное изменение фосфорилирования какого-то пресинаптического мембранного белка, регулируемое ферментом протеинкиназой. Но это было всего лишь преходящим сдвигом: если он и необходим для формирования долговременной памяти, его все же нельзя считать ее единственной биохимической основой. Необходимо какое-то более продолжительное событие, способное вызвать длительную перестройку синапсов. Именно для такой перестройки может понадобиться синтез новых белков.
Биосинтез белков определяется информацией, заключенной в ДНК, т. е. в генах клеточного ядра. Для образования новых белков необходимо, чтобы активировалась ДНК и нужные гены включились в работу. Поэтому изменение фосфорилирования синаптической мембраны, по-видимому приводящее к поступлению в клетку кальция, должно служить своего рода сигналом для ядерной ДНК. Сейчас мы не знаем всех деталей работы этого механизма, но к концу восьмидесятых годов стало ясно, что поступление такого сигнала в ядро активирует группу «генов раннего действия». Этот феномен впервые наблюдали в быстро делящихся раковых клетках, но вскоре была показана его универсальная природа. «Ранние» гены обеспечивают активацию других («поздних») генов и выработку в клеточном ядре инструкций для последующего синтеза ключевых структурных белков - тех, что в конце концов включаются в состав синаптической мембраны, изменяя ее строение. Структурные белки кодируются поздними генами, тогда как ранние гены ответственны лишь за образование группы промежуточных сигнальных пептидов, получивших такие варварские наименования, как c-fos и c-jun. Эти и другие подобные им пептиды воздействуют на ядерную ДНК, включая в работу надлежащие поздние гены. Этот сложный каскад сигналов схематически представлен на рис. 10.5.
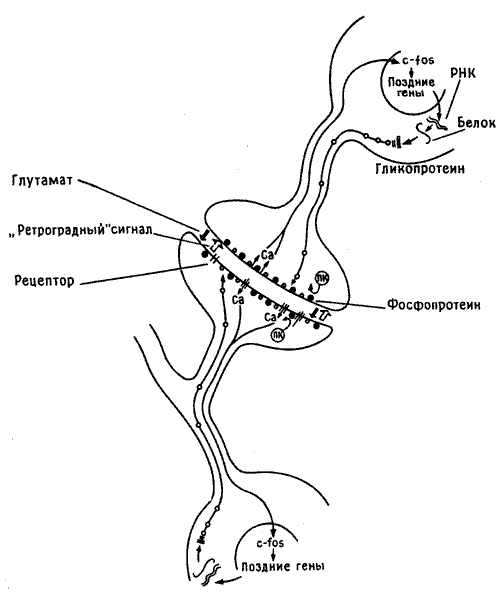
Рис. 10.5. Сигналы между синапсом и ядром. На рисунке изображен синапс на шипике дендрита (разумеется, без соблюдения масштаба), а также тела пресинаптического и постсинаптического нейронов. В процесе формирования памяти нейромедиатор (глутамат, показан черной стрелкой) освобождается из пресинаптического участка и взаимодействует с рецептором на постсинаптической клетке, что приводит к фосфорилированию мембранных белков (черные кружочки) протеинкиназой С (ПК) и поступлению внутрь клетки ионов кальция (Са). Кальций служит сигналом для ядра, где начинается синтез «ранних» (c-fos) и «поздних» генов, которые через РНК кодируют синтез белковых и гликопротеиновых молекул (белые кружочки), а те в свою очередь транспортируются к мембране и включаются в нее, изменяя ее форму и размеры. Параллельно аналогичный процесс запускается под действием ретроградного сигнала (светлая стрелка) в пресинаптической клетке).
Наиболее интересны структурные белки, ибо именно они непосредственно изменяют клетку, а ранние гены и механизм их действия относятся уже к молекулярио-биологическому «подсобному хозяйству», которое представляется таинственным не только большинству людей, далеких от биохимии, но и самим биохимикам. Пептиды c-fos и c-jun тоже представляют интерес, но не просто потому, что служат одним из связующих звеньев между ранними процессами в клеточной мембране и синтезом структурных белков, а потому, что становятся активными только в клетках, претерпевающих пластические изменения; их содержание и локализацию внутри клеток можно с высокой точностью определять с помощью той или иной разновидности радиоавтографического метода, описанного выше. Когда в 1989 году мы начали исследовать роль этого механизма в выработке пассивного избегания, в литературе по молекулярной нейробиологии уже высказывалось немало соображений о том, как можно было бы выявить специфическую активацию c-fos и с-jun при образовании следов памяти. Никто, однако, не поставил ключевого решающего эксперимента.
Я не молекулярный биолог, и мне никогда не пришло бы в голову осваивать методы, необходимые для оценки активности ранних генов, если бы к нам в лабораторию не приехал вдруг из Москвы молодой специалист в этой области Костя Анохин (внук ученика Павлова, психолога и физиолога Петра Анохина, чью «теорию функциональных систем» я упоминал в главе 9). В распоряжении Кости были специфические «зонды», используемые в таких методах, и он проявлял большую тягу к экспериментальной работе. В течение нескольких недель после его приезда мы показали, что через полчаса после обучения (т. е. примерно в то же время, когда изменялось фосфорилирование мембранных белков) в клетках IMHV резко возрастало образование пептидов c-fos и c-jun. Таким образом, мы обнаружили жизненно важный этап на пути от синапса к ядру [11]. Если не считать этих сложностей, вся остальная биохимическая часть работы сравнительно проста. В одной из моих первых серий экспериментов на модели пассивного избегания (после того как я закончил работу с Мэри и еще не установил, что изменения происходят в IMHV и LPO) я исследовал влияние обучения на общий белковый синтез с использованием метода предшественников, описанного в одной из предыдущих глав. Спустя 30 минут после обучения и на протяжении последующих суток я наблюдал усиление синтеза белков в областях мозга, включавших и IMHV. Этот результат согласовался с известным амнестическим эффектом ингибиторов белкового синтеза. Однако я полагал, что значительная часть этого синтеза могла быть связана с образованием новых синапсов или модификацией старых, поэтому нужно было исследовать не белки вообще, а белки синаптических мембран.
Многие из самых важных и характерных белков синаптических мембран относятся к классу гликопротеинов, которые можно описать как молекулы, состоящие из двух частей: длинной цепи аминокислот, погруженной в клеточную мембрану, и еще одной цепочки из молекул сахаров (например, глюкозы, фукозы и галактозы), выступающей из мембран во внеклеточное пространство. Цепочки сахаров «липкие»: когда одна из них находит подходящую цепочку, выступающую над мембраной соседней клетки, они «узнают» друг друга и соединяются. Таким образом, гликопротеины служат узнающими молекулами, и я полагал, что если синапсы — специфические места узнавания и соединения клеток — действительно изменяются при обучении, то гликопротеины должны играть в этом не последнюю роль. Эксперимент, которым я был занят, когда начал писать эту книгу, и о котором рассказал в главе 2, как раз и проводился с использованием фукозы — одного из предшественников гликопротеинов.
Еще в 1980 году мы показали, что наряду с включением аминокислот в белки в первые сутки после обучения усиливается и включение фукозы в гликопротеины пре- и постсинаптических мембран. Сложность состояла в том, что гликопротеины чрезвычайно трудно поддаются анализу и, кроме того, в этих мембранах существует множество различных типов гликопротеинов. В последнее десятилетие мы потратили очень много времени на трудоемкие и зачастую весьма неблагодарные попытки идентифицировать эти белковые соединения (мы пытались даже получить специфические антитела, способные их узнавать). Все, что я на данный момент знаю, во всяком случае все, о чем стоит упомянуть, — это то, что в пре- и постсинаптических мембранах имеется целый ряд гликопротеинов разного молекулярного веса, участвующих в формировании у цыплят реакции на бусину [12].
Ход изменений во времени.
Б. Биохимия переходит в морфологию
Если верна гипотеза об участии гликопротеинов в той или иной форме перестройки синапсов, то нельзя ли в самом деле наблюдать эти изменения в нейронах IMHV? Не так уж трудно приготовить препараты мозговой ткани для изучения в обычном микроскопе (максимальное увеличение в несколько тысяч раз) или с помощью электронного микроскопа (увеличение в сотни тысяч раз). Гораздо сложнее перейти от визуальной качественной оценки микроскопического изображения к количественным характеристикам тех или иных компонентов в изучаемом объекте. Если при обучении не образуется чего-то совершенно нового, на препаратах будут скорее всего заметны лишь небольшие изменения в числе, форме или распределении уже существовавших структур, в частности синапсов. При световой микроскопии нельзя увидеть отдельные синапсы, но можно окрасить нейроны и рассмотреть строение их дендритов, чтобы выявить возникшие изменения. Однако если изменения появятся в нервных окончаниях с пресинаптической стороны, то для их количественной оценки понадобятся методы электронной микроскопии, поскольку световой микроскоп не дает достаточного увеличения.
Такие количественные морфологические наблюдения, т. е. определение формы, числа и величины клеток в мозгу, даже сегодня, при наличии компьютерных систем и весьма совершенных способов анализа изображений, требуют больших затрат времени и, если наблюдатель недостаточно внимателен, таят в себе опасность неверного истолкования. Какую долю клеток из сотен тысяч, имеющихся в каждом крошечном участке мозга, нужно исследовать, чтобы получить репрезентативную картину?
Как можно быть уверенным, что наблюдаемые под микроскопом изменения «действительно» происходят в живом мозгу, а не являются артефактом — искусственно вызванным результатом применения того или иного метода фиксации, приготовления срезов или окрашивания мозговой ткани с целью сделать видимым ее строение? Как можно перенести результаты измерений на двумерных срезах на трехмерную живую ткань? Все эти технические вопросы встали передо мной и моим коллегой Майком Стюартом в начале нашей работы на цыплятах, когда стало ясно, что нам понадобятся измерения такого рода. Майк настолько увлекся этой задачей, что создал действительно первоклассную лабораторию количественной морфологии. Но что именно следовало измерять у цыплят, учитывая множество открывающихся возможностей?
В конце XIX века миланский анатом Камилл о Гольджи почти что неожиданно для себя открыл краситель на основе солей серебра, который окрашивал в срезах очень небольшую (по-видимому, случайную) выборку нейронов, настолько четко выделяя отдельные клетки, что видны были и мельчайшие детали клеточного тела, и дендриты, и даже мириады крошечных шипиков, усеивавших поверхность дендритов. Любопытно, что сам Гольджи, получивший Нобелевскую премию (отчасти и за эту работу), не верил в существование в мозгу отдельных нейронов, представляя себе его ткань как непрерывную сеть волокон. Он упорствовал в этом заблуждении вопреки всем данным, которые доставляла его же собственная методика окрашивания. Значение открытия Гольджи было оценено лишь знаменитым нейроанатомом из Мадрида Раман-и-Кахалом, который тоже стал Нобелевским лауреатом (хотя Гольджи отказывался не только принять его доводы, но даже разговаривать с ним). Каждого, кто видит препараты нейронов, окрашенных по Гольджи, восхищают сложность и изящество их ветвления. Даже сейчас, через десятки лет после того, как я впервые увидел такие препараты, они кажутся мне необычайно красивыми, и я погружаюсь в созерцание клеточной чащи, которая выглядит тем более таинственной, что окраска придает препарату какую-то осязаемость, почти трехмерность. Она делает видимыми лишь некоторые из множества нейронов, так что клетки выступают на общем фоне как облетевшие деревья в тумане (рис. 10.6).
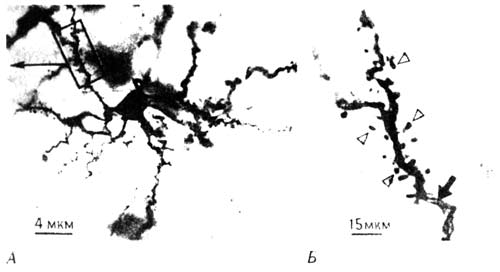
Рис. 10.6. Нейроны IMHV. А. Отдельный нейрон, окрашенный по Гольджи. Б. Дендрит при большем увеличении с шипиками на его поверхности.
Но одно дело восхищаться красотой таких изображений и совсем другое — давать их структуре количественную оценку. Что нужно измерить, чтобы отличить нейрон, изменившийся после обучения? Поверхность всех дендритов, отходящих от тела клетки, покрыта синапсами, возможно, числом до десятка тысяч, которые принадлежат другим нейронам и обеспечивают связь между клетками. Одни синапсы размещаются прямо на самих дендритах, другие на крошечных шипиках, отходящих от их поверхности (они видны на рис. 10.6). Перестройка синаптических связей между нейронами в соответствии с гипотезой Хебба может быть связана с изменением длины дендритов, характера их ветвления или количества шипиков.
Насколько сильно каждый из синапсов будет воздействовать на постсинаптическую клетку, зависит от разных факторов: от близости синапса к телу нейрона, от локализации его на стволе дендрита или многочисленных шипиках и т.д. В синапсе медиатор, выделяемый на пресинаптической стороне, связывается с постсинаптическим рецептором, что приводит к изменению электрических свойств постсинаптической мембраны и возбуждению вокруг нее слабого электрического тока. Действие этого тока на остальную часть дендрита, а потом и на тело клетки в большой степени определяется геометрией участка, окружающего синапс. Расчеты биофизиков показали, что от синапсов, расположенных на шипиках, электрическая реакция распространяется эффективнее, чем от синапсов на самих дендритах, а ток в отдельных шипиках зависит от их формы. Поэтому любое изменение в структуре дендритов или в расположении на них синапсов может изменять нейрофизиологические взаимодействия между пре- и постсинаптическими клетками. Иначе говоря, характер межнейронных связей может изменяться не только при увеличении или уменьшении каждого отдельного синапса (например, синапс может переместиться со ствола дендрита на шипик).
Есть веские основания полагать, что форма и характер ветвления дендритов тоже имеют важное значение и могут изменяться под воздействием обучения или других форм приобретения опыта. Приготовление микроскопических препаратов неизбежно связано с фиксацией и окраской ткани, поэтому то, что мы видим, всегда выглядит как очень жесткая структура. Но в живом организме сеть дендритов подвижна, как ветки деревца при легком ветре [13], и нетрудно предвидеть, что их взаимное расположение будет меняться. Однако анализировать эти изменения не так-то просто. Гораздо проще подсчитывать число дендритных шипиков, и именно этим занимался в середине 80-х годов Санджай Пател, один из диссертантов, работавший в лаборатории Майка Стюарта. Он обучал цыплят и спустя сутки приготовлял препараты правого и левого IMHN, окрашенные по методу Гольджи. После этого он отбирал нейроны определенного типа с длинными аксонами, измерял длину каждой ветви дендрита и подсчитывал на ней шипики, а затем вычислял количество последних на один микрометр (одну миллионную долю метра) длины дендрита.
К нашей общей радости (и, должен сказать, к моему удивлению), результаты подсчета оказались весьма впечатляющими. Через 24 часа после обучения число шипиков на дендритах в левом IMHV увеличивалось на 60% (но практически не изменялось в правом IMHV). Форма шипиков тоже несколько менялась: создавалось впечатление, что кончик у каждого из них раздувался, словно маленький воздушный шарик. Именно это и должно было происходить, согласно биофизической теории, в случае усиления электрической связи между пре- и постсинаптическими областями системы у цыплят, клевавших горькую бусину. К точно такому же изменению должен был приводить повышенный биосинтез гликопротеинов [14].
Итак, мы получили четкие данные о весьма значительном изменении постсинаптических структур в процессе приобретения опыта. Но в арсенале морфологических методов Майка Стюарта была не только световая, но и электронная микроскопия. При том увеличении электронного микроскопа, которое мы обычно используем, ноготь большого пальца имел бы 250 метров в ширину, а упорядоченная картина, выявляемая при окраске по Гольджи, обращается в хаос, истолковать который может только очень дисциплинированное воображение. Электронная микроскопия не позволяет просто увеличить окрашенное изображение и от начала до конца рассмотреть каждую отдельную клетку и все ее связи; изменения шипиков, видимые в обычный микроскоп, трудно отнести к определенным синапсам, выявляемым с помощью электронной микроскопии. Впрочем, опыт и верный глаз помогают разобраться в хаосе электронно-микроскопической картины и различить отдельные синапсы, клеточные тела, аксоны и дендриты, чтобы измерить их. На рис. 10.7 показана электронная микрофотография синапса из IMHV с обозначениями, которые помогут понять, что на ней видно. Если говорить точно, то синапс — это то место, где пресинаптическое окончание тесно сближено с постсинаптической мембраной. На фото это место имеет вид утолщенной, темной полоски, где мембраны двух клеток практически (хотя и не совсем) соприкасаются. Это утолщение представляет собой тот участок постсинаптической мембраны, где имеются рецепторные молекулы, связывающие нейромедиатор после его высвобождения из мелких пузырьков, плотно упакованных в пресинаптическом окончании. В качестве параметров, заслуживающих измерения, сами собой напрашиваются число таких окончаний в данном объеме ткани, их средняя величина (объем) и длина синаптического утолщения. Запасшись временем и терпением (если вы собираете материал для диссертации или просто горите энтузиазмом), можно даже подсчитать число пузырьков в каждом окончании.
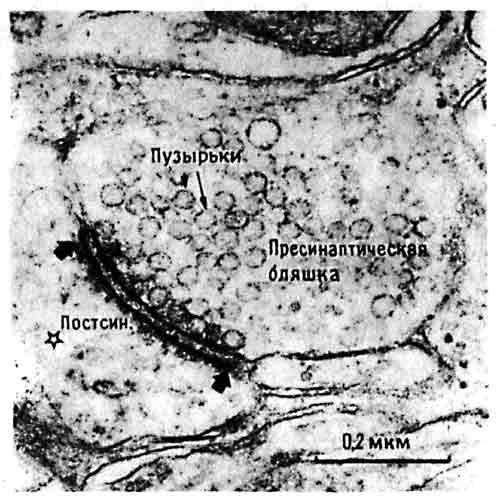
Рис. 10.7. Синапс в IMHV. Отдельный синапс с пузырьками. Звездочкой отмечен синаптический контакт с головкой дендритного шипика. Широкими стрелками показано утолщение постсинаптической мембраны. (Фото любезно предоставил Майк Стюарт.)
Майк, работавшие у него выпускники университета и приезжие стажеры определяли все эти параметры в синапсах IMHV и LPO. В начале наших исследований это делали через сутки после обучения цыплят, исходя их того, что для любого структурного изменения нужно время. В последующем Майк убедился, что изменения можно впервые обнаружить уже через час после клевания бусины. Полученные им данные ясны: происходило увеличение числа синапсов в LPO, числа пузырьков в каждом синапсе и даже длины постсинаптического утолщения в левых IMHV и LPO. Все это наряду с изменением числа и величины шипиков на дендритах было именно тем, чего следовало ожидать, если у цыплят, клевавших бусину и запоминавших связь между этим действием и ощущением горького вкуса, перестраивались синапсы в IMHV и LPO. Такая перестройка кодировала (или отображала) эту новую ассоциацию и связанное с ней изменение поведения — «не клевать» вместо «клевать», когда цыплята вторично видели бусину [15].
Резюмируем все сказанное до сих пор. Как видно из рис. 10.3, можно думать, что клевание горькой бусины запускает у цыпленка каскад биохимических процессов в двух, специфических участках мозга. Вначале происходят кратковременные изменения мозгового кровотока и использования энергии; при этом быстро усиливаются взаимодействия между нейромедиатором и его рецепторами, что ведет к изменению свойств синаптических мембран и к повышению эффективности связи между пре- и постсинаптическим нейронами. Эти изменения в свою очередь порождают сигналы для клеточного ядра, в котором сначала активируются несколько «ранних» генов, а потом и гены, необходимые для синтеза новых компонентов синаптических мембран, особенно гликоцротеинов. В последующие часы эти гликопротеины включаются в синаптические мембраны, увеличивая число шипиков на дендритах и размеры зон синаптического контакта в левом IMHV и в левом и правом LPO. Не так уж мало, если учесть, что цыпленок всего лишь однажды клюнул горькую бусину!
Третий критерий: необходимость и достаточность
Пока все идет хорошо, но самый факт сопутствующих изменений не доказывает, что они необходимы для образования следов памяти. Иными словами, я должен еще проверить ситуацию на соответствие моему третьему, редукционистскому критерию. Пока я этого не сделал, вся сложная последовательность событий, установленная за десять лет работы, может оказаться просто результатом неприятного вкуса во рту цыпленка, не имеющим ничего общего с научением и памятью.
Одним из способов такой проверки мог бы служить довольно грубый опыт Мэри Гиббс, которая помещала метилантранилат в клюв цыплятам с закрытыми глазами и не находила после этого никаких изменений в рецепторах для синаптического медиатора. Однако лишение птенцов способности видеть само по себе отнюдь не безразлично для их реакции, поэтому результаты таких опытов не слишком убедительны. В идеале мне были бы нужны две группы успешно обученных цыплят, в одной из которых цыплята в последующем забывали бы усвоенную связь, а в другой помнили ее. Во втором случае у них должны были выявляться все описанные выше процессы на уровне синапсов, а в первом их не было бы.
Размышляя над решением этой проблемы, я натолкнулся на статью Ларри Беновица, нейробиолога из Гарвардского университета, опубликованную в начале семидесятых годов. В ней описывалось, как цыплят обучали пассивному избеганию и сразу после этого пропускали через голову слабый электрический разряд, что, по-видимому, заставляло их забыть связь между видом и вкусом бусины: при повторном предъявлении они клевали ее так же энергично, как и в первый раз. Но если ток пропускали не ранее десяти минут после обучения, память о приобретенном опыте сохранялась и цыплята избегали повторно клевать бусину [16]. Это можно бьшо объяснить тем, что ранние этапы образования энграмм связаны с электрической активностью нейронов, а она нарушалась при воздействии тока сразу после обучения; при более позднем пропускании тока эти этапы успевали завершиться и процесс мог беспрепятственно идти дальше.
Это сразу же подсказало мне план дальнейших экспериментов. Нужно было обучить цыплят, используя горькую бусину, воздействовать на них электротоком сразу или через несколько минут после обучения и сравнить биохимические изменения у птенцов, забывших связь между видом и вкусом бусины, и у сохранивших это воспоминание. Мы сконструировали небольшое и очень простое устройство, которое позволяло пропустить слабый ток через голову цыпленка, когда его держали в руках; прохождение разряда я контролировал на собственном пальце —- это бьшо всего лишь короткое покалывание, и цыплята едва замечали его. Таким образом я смог проверить данные Беновица. Он оказался прав: если ток пропускали уже через минуту после обучения, у большинства цыплят развивалась амнезия, а при задержке на десять минут цыплята избегали клевать бусину повторно.
Но двух групп было недостаточно для хорошего эксперимента: нужны были шесть групп. Обозначим их буквами. В трех группах, В, ВЭ и В—Э, цыплятам предлагали для обучения бусину, смоченную водой (В), а в трех других, М, МЭ и М—Э, бусину с метилантранилатом (М). В группах В и М цыплят не подвергали электрическому (Э) воздействию (точнее, подвергали «ложному» воздействию — проделывали все те же манипуляции, но при выключенном токе). В группах ВЭ и МЭ ток пропускали сразу после обучения, а в группах В—-Э М—Э несколько позже. Если показателем нейрохимических изменений служило, скажем, повышенное включение фукозы в часы после тренировки, то можно бьшо ожидать различий между группами В и М вследствие обучения и между группами В—Э и М—Э, поскольку цыплята, получавшие шок не сразу после тренировки, клевали бусину и сохраняли память. Наиболее важно сопоставление групп ВЭ и МЭ: цыплята группы МЭ клевали горькую бусину, но не помнили об этом и снова клевали ее при повторном предъявлении. Если биохимические изменения в мозгу отражают лишь факт клевания горькой бусины, то включение фукозы у цыплят группы МЭ будет таким же, как в группах М и М—Э, и выше, чем у всех цыплят, клевавших бусину, смоченную водой (группы В, ВЭ, В—Э). Если же повышенное включение связано с запоминанием, то его изменение в группе МЭ будет таким же, как в группе ВЭ, и слабее, чем в группах М и М—Э. Разумеется, для получения надежных результатов опыты следовало бы повторить на достаточно большом числе цыплят — до 12 в каждой группе, но при анализе данных они уже оказались вполне однозначными, и я не могу удержаться, чтобы не привести их на рис. 10.8 [17].
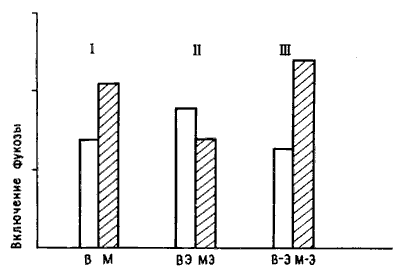
Рис. 10.8. Память и включение фукозы. Высота каждого столбика соответствует количеству включившейся фукозы. Светлые столбики показывают включение у цыплят, клевавших бусину, смоченную водой, а темные — бусину с метилантранилатом. Буквы под каждым столбиком соответствуют обозначению групп в тексте. I — цыплята, не подвергавшиеся шоку, с ожидавшимся повышением включения фукозы после клевания бусины с метилантранилатом; II — цыплята, подвергавшиеся шоку сразу после обучения (включение не повышено); III — цыплята, подвергавшиеся шоку позднее (включение повышено после клевания бусины с метал антран ил атом). Обратите внимание на отсутствие достоверного различия между всеми группами цыплят, клевавших бусину, смоченную водой. Это говорит о том, что сам по себе шок не влиял на включение фукозы.
Повышенное включение фукозы наблюдали только в тех группах, где цыплята помнили предшествующий опыт. У обученных, но забывших об этом цыплят такое повышение отсутствовало. Кроме того, оказалось, что само по себе электрическое воздействие не влияло на этот биохимический показатель, как было видно при сравнении подвергавшихся и не подвергавшихся ему цыплят, клевавших безвкусную бусину. Я был так доволен возможностью иметь столь простой и точный контроль, что использовал его и при изучении некоторых других ключевых стадий каскада; я обнаружил, например, что увеличение числа шипиков на дендритах происходит только у помнящих, но отсутствует у непомнящих цыплят [18].
У меня еще оставались сомнения, но не потому, что я ставил под вопрос разумную логику этого эксперимента, а потому, что было бы лучше провести опыт так, чтобы избежать воздействия на цыплят даже слабым током. Что я имею в виду, говоря о «лучшем» варианте? Эксперименты с использованием электрошока логичны и изящны, но такое воздействие на цыплят неприятно с эстетической (моральной? — я не уверен) точки зрения, каким бы слабым ни было вызываемое им ощущение. Поэтому пару лет назад мы с Костей Анохиным разработали иную процедуру, избавляющую цыплят от малейших неприятных воздействий, даже от клевания горькой бусины. Цыплят помещают на поверхность, усыпанную смесью гранулированного корма с гравием примерно тех же размеров и цвета. Сначала цыплята без разбора клюют и корм, и гравий, но через несколько минут замечают разницу и начинают выбирать кормовые гранулы, избегая гравия (особенно если его частицы приклеены к полу!). Мы разделяли цыплят на две группы и растягивали опыт на два дня. План эксперимента показан на рис. 10.9. Группа К в оба дня служила «спокойным контролем». В первый день цыплят групп Л и М помещали на пол с гравием, но без корма. Цыплят группы Н испытывали в таком же числе сеансов, что и две предыдущие группы, но при наличии корма, так что они учились отличать корм от гравия. На второй день опыт с группами Л и Н повторяли, а цыплятам группы М впервые предлагали и гравий, и корм. Таким образом, на второй день эксперимента только цыплята группы М обучались в первый раз, тогда как в группе Н они повторяли такие же, но усвоенные ранние действии. Во второй день мы сразу по окончании опыта оценивали у цыплят активность одного из «ранних» генов — гена c-jun. У цыплят обеих «деятельных» групп, М и Н, активность этого гена усиливалась по сравнению со «спокойным контролем» (К), но у обучавшихся птенцов (группа М) это усиление было намного более выраженным, чем у цыплят, просто воспроизводивших поведение, усвоенное ранее (группа Н), хотя последние с большей жадностью поедали корм [19].
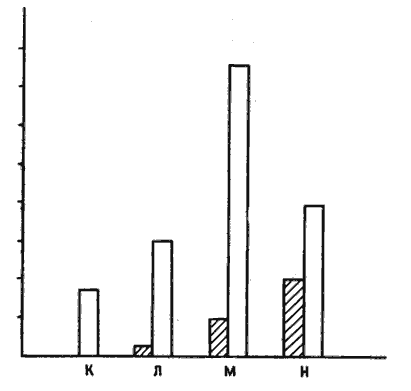
Рис. 10.9. Эксперимент с расспанным по полу гравием. Четыре группы птенцов (К, Л, М и Н) обучали в течение двух дней, как описано в тексте. Темные столбики — частота клевания, а светлые — активность c-jun. Хотя больше всего клюют уже обученные цыплята группы Н, активность c-jun наиболее высока в обучавшейся группе М.
Четвертый критерий: приводит ли подавление биохимических процессов к подавлению памяти?
Логика экспериментов с ингибированием самоочевидна, но на протяжении ряда лет я отказывался от их проведения, так как мне оставалось не ясно, что конкретно может дать применение ингибиторов с широким спектром действия, например ингибиторов белкового синтеза, для познания биохимических процессов, которые я пытался расшифровать. Но когда мы подошли к более детальному изучению отдельных звеньев биохимического каскада, я убедился, что использование достаточно специфических ингибиторов может пролить свет на молекулярные механизмы. Например, мы обнаружили, что если перед началом обучения вводить вещества, блокирующие долговременную потенциацию в гиппокампе и пространственное научение (ингибиторы рецепторов глутамата NMDA-типа), то у цыплят развивается амнезия. К таким же последствиям приводит инъекция в левое полушарие протеинкиназы С перед самым обучением или сразу после него [20].
Но, может быть, самым интересным с моей точки зрения оказался ингибитор, предложенный Рейнхардом Йорком, который работал вместе с Ханс-Юргеном Маттиесом в Магдебурге (тогда еще в ГДР). Группа Маттиеса, как и наша, изучала гликопротеины и продемонстрировала увеличение их синтеза при различных более традиционных формах обучения крыс. Йорк, просматривая литературу в поисках специфических ингибиторов биосинтеза гликопротеинов, натолкнулся на сахар, называемый 2-дезоксигалактозой (2-ДГал) и находящийся в таком же отношении к галактозе, как 2-дГ к глюкозе. 2-дГал очень специфическим образом подавляет синтез тех гликопротеинов, в которых связаны между собой два сахара — галактоза и фукоза; при этом блокируется включение в них фукозы. Вместе с Мапиесом Йорк установил, что введение крысам 2-дГал вызывает амнезию. Я предложил Рейнхарду провести параллельные эксперименты на цыплятах. К нашему восторгу оказалось, что введение 2-дГал перед самым обучением или в первые два часа после него подавляет включение фукозы в гликопротеины мозга; тестирование цыплят спустя сутки выявило амнезию. Таким образом, эксперименты как с электрошоком, так и с ингибиторами показали, что для образования следов памяти необходим биосинтез специфических гликопротеинов [21].
Шестой критерий1: биохимия коррелирует с нейрофизиологией
1
Занятия нейрофизиологией требуют целого ряда навыков: не только умения искусно оперировать мелких животных, но и довольно основательных познаний в электронике, что недоступно простым биохимикам вроде меня. Мои возможности в электротехнике ограничиваются тем, что я могу подсоединить провод к штепселю, но и это нам запрещается (официально) делать в лаборатории: инструкция по технике безопасности требует, чтобы столь квалифицированную работу выполнял электрик-профессионал. Для подхода к шестому критерию мне был нужен человек, владевший техникой осциллоскопии, но только в середине 80-х годов к нам поступил для подготовки диссертации на степень доктора философии толковый, хотя и несколько чудаковатый Роджер Мейсон, заядлый аквалангист.
*1) Я прекрасно знаю, что за четвертым должен следовать пятый. Причина, по которой я откладываю обсуждение пятого критерия, скоро станет понятной.
Милтон-Кинс находится настолько далеко от моря, насколько это возможно в Англии, и я никогда не мог до конца понять, что заставило Роджера избрать именно это место (думаю, не вполне понимал это и он сам, потому что после четырех лет напряженных исследований он написал «черновик» своей диссертации на нескольких сотнях страниц — гораздо больше, чем требуется, но так и не представил ее к защите). По прибытии в лабораторию Роджер тут же исчез среди проводов и проблесковых ламп, звуковых сигналов, бесконечных рулонов регистрационных лент с десятками метров разноцветных записей. Приближаться к его рабочему месту было просто опасно, потому что приходилось прокладывать путь через свисающий откуда-то привод к аквалангу и валяющиеся на полу остатки разобранных велосипедов1. Но примерно после 18 месяцев технического затворничества он предстал перед нами, успешно справившись с задачей обеспечить эксперименты оборудованием.
*1) Сочетание современной оснащенности и домашнего беспорядка весьма типично для многих лабораторий. Непосвященного это просто изумляет, и он вправе усомниться, что из всего виденного вообще может получиться что-нибудь путное. Недавно я посетил один из ведущих мировых центров позитронно-эмиссионной томографии. В этом комплексе, сооружение которого обошлось в миллионы фунтов стерлингов, ничтожные объемы воды или органического вещества помещают в центральную камеру циклотрона и бомбардируют потоками разогнанных до огромной скорости ионов, что приводит к образованию короткоживущих изотопов. Эти изотопы по защищенным свинцовым покрытием трубопроводам перекачивают в радиохимическую лабораторию, где на автоматической установке в считанные мгновения осуществляется сложный синтез высокочистых меченых соединений. Затем полученные вещества передаются в комнату, где находится больной, голова которого окружена кольцом детекторов позитронов, которые в свою очередь соединены с системой компьютерных банков данных. Прежде чем вступить в этот мир научной фантастики, приходится облачаться в лабораторный халат и надевать на обувь защитные чехлы. Но, войдя в лабораторию, натыкаешься то на оставленные в беспорядке скамьи, то на другие тривиальные следы повседневной работы и жизни: шпатели и ножницы, торчащие из пустой банки из-под меда; кофеварку, кем-то поставленную прямо у экранированного шкафа; тайком курящего техника, обслуживающего оборудование. Как уживается весь этот хаос с фантастическим миром, где все измеряется наносекундами и пикограммами?
В сущности, мы собирались делать очень простые вещи. Нужно было предложить цыпленку бусину, смоченную водой или метилантранилатом, а потом усыпить его. Затем его помещали в так называемый стереотаксический аппарат с миниатюрной системой жизнеобеспечения. Здесь наркотизированного птенца аккуратно, но жестко закрепляли таким образом, чтобы в его обнаженный мозг в соответствии с заданными координатами можно было ввести электроды (конечно, теперь это уже не животное, а «препарат», у которого исчезнут признаки жизни, стоит только отключить систему жизнеобеспечения). Есть разные типы электродов: тонкие стеклянные трубочки, заполненные растворами солей или активных веществ, которые требуется подвести к определенным клеткам мозга, или так называемые «стимулирующие электроды», с помощью которых подводят залпы электрических импульсов. Наконец, электродами могут служить тонкие металлические проволочки, назначение которых — всего лишь регистрировать электрическую активность близлежащих клеток. В наших экспериментах использовались электроды этого последнего типа: мы хотели выяснить, изменяется ли электрическая активность нейронов в IMHV в результате ознакомления цыпленка с бусиной, смоченной метилантранилатом.
Все это выглядит довольно просто, но скрывает массу сложностей. Очень трудно оказалось подобрать подходящее наркотизирующее средство, которое не мешало бы поддерживать жизнь цыпленка в течение нескольких часов. Другая сложность состояла в интерпретации электрических сигналов и отделения их от посторонних «шумов». Каждый отдельный эксперимент может занять много часов, так как требует предварительной подготовки животного и аппаратуры; поэтому нейрофизиологи в еще большей степени, чем другие известные мне лабораторные исследователи, склонны трудиться по ночам (во всяком случае, когда работают над диссертацией) и плохо приспособлены для нормального человеческого общения.
Моя роль в этом эксперименте была несложной. Я только предлагал цыплятам клевать бусину, смоченную метилантранилатом или водой, и потом передавал их Роджеру, а тот исчезал с ними в нейрофизиологической лаборатории и много часов спустя выныривал с ворохом записей, которые начинал анализировать. До завершения первой серии экспериментов я не говорил ему, к какой группе принадлежит тот или иной цыпленок (это обычная практика в нашей лаборатории: по возможности, особенно если опыт проводят два сотрудника, мы стараемся работать «вслепую» до завершения анализа полученных данных, чтобы избежать подсознательной предвзятости в оценке). После регистрации данных для шестнадцати птенцов Роджер сообщил, что выявил закономерные различия между ними, столь значительные, что может подразделить всех цыплят на две группы без моей подсказки. Когда я попросил его сделать это, он правильно определил 14 цыплят из 16.
Как мы и ожидали, во всех случаях регистрировался постоянный «фон», отражавший спонтанные разряды нейронов IMHV. Но на этот фон накладывались кратковременные «вспышки» высокочастотной активности — ритмического синхронного возбуждения целых ансамблей клеток (рис. 10.10). Эта активность у цыплят, клевавших бусину с метилантранилатом, была выражена намного (иногда вчетверо) сильнее, чем у контрольных особей, клевавших бусину, смоченную водой. Превышение могло сохраняться на протяжении суток после тренировки. Все это действительно несколько напоминало эффект ДВП, только вызывалось не искусственным пропусканием тока, а приобретенным поведенческим опытом [22]. Возможно, что существует и полная аналогия: спустя пару лет другим исследователям удалось получить ДВП-подобные явления при стимуляции срезов IMHV in vitro [23]. Чтобы окончательно убедиться в специфичности «вспышек», мы с Роджером повторили опыт, используя описанную выше индукцию амнезии электрошоком.
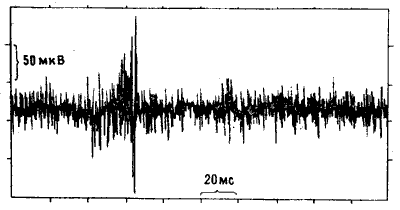
Рис. 10.10. Пульсирующая активность нейронов IMHV. Запись активности группы нейронов IMHV у наркотизированного цыпленка. По вертикальной оси отложены потенциалы, по горизонтальной — время. Можно видеть интенсивную фоновую активность с довольно низкой амплитудой и высокочастотный разряд с амплитудой до 300 микровольт. Такая пульсирующая активность резко усиливается после обучения.
И снова ритмические вспышки, подобно биохимическим и структурным изменениям, отмечались только у тех цыплят, которые помнили усвоенную задачу [24].
Конец рассказа?
Итак, для того чтобы в мозгу цыпленка сформировалась ассоциативная связь между клеванием бусины и горьким вкусом, приводящая к стойкому изменению поведенческой реакции, в определенной области переднего мозга должен произойти ряд последовательных событий. Эти события завершаются структурной модификацией синапсов и дендритов, и в итоге проявляются также в изменении электрических свойств клеток, в частности в характере их ритмической активности на протяжении нескольких часов после обучения. Все это, видимо, удовлетворяет шестому критерию.
Таким образом, узнал ли я, наконец, как и где образуются у цыплят следы памяти? Отчасти, уважаемый читатель, только отчасти. Вся эта биохимия и нейрофизиология, все структурные изменения — прекрасны: десять лет славной экспериментальной работы, внесшей некоторый порядок в кажущийся хаос живого мира. Я чувствую, что меня не ввели в заблуждение артефакты и что я правильно интерпретировал свои результаты, хотя даже мне самому, не говоря уже о посторонних критиках, ясно, что, анализируя цепь событий, я формально не подтвердил еще наличия всех необходимых биохимических звеньев. Некоторые из моих доводов балансируют на той опасной грани, где исследователя подстерегает классическая ловушка «post hoc ergo propter hoc», хотя из того, что фосфорилирование предшествует синтезу гликопротеинов, не следует автоматически, что последний зависит от первого. Однако это, вероятно, не самый существенный вопрос. Гораздо важнее выяснить, действительно ли, даже без всей этой биохимии, память — столь простой механический процесс, незамысловатое связывание нейронов в новую сеть в IMHV, нечто вроде переключения элементов компьютера. Значит ли это, что прав был Хебб? Специфичны ли обнаруженные мною эффекты для кур и даже только для цыплят, запоминающих горький вкус бусины, или же я могу с полным правом утверждать, что они иллюстрируют какие-то общие принципы формирования следов памяти? Не должен ли удивлять сам масштаб наблюдавшихся явлений? Четырехкратное усиление ритмической активности, 60%-ное увеличение числа шипиков на дендритах — и все это только для того, чтобы запомнить маленькую бусинку? Если такое будет случаться всякий раз, когда курице придется что-то запоминать на протяжении всей ее жизни, то где в ее крошечном мозгу найдется место для всех этих синаптических перестроек?
Если бы сам я не пытался ответить на такие вопросы, их, несомненно, поставил бы кто-нибудь другой. Правда, моя повседневная лабораторная работа проходит в мире артефактов, создаваемых техническим оснащением. У меня нет возможности непосредственно наблюдать природу хотя бы на примере моих цыплят. Подобно всем научным данным, мои данные на самом деле не что иное, как результаты регистрации измерений, записи на бумажных лентах, цифры на шкале или экране приборов (философ-позитивист и физик Эрнст Мах в начале века назвал такие наблюдения «показателями стрелок», я манипулирую ими, пытаясь понять их значение, а поняв, произвожу обратную экстраполяцию, чтобы сделать выводы о поведении молекул, клеток и организмов в реальном мире. Вместе с тем меня совершенно не трогает текущая полемика в кругах философов и социологов относительно статуса реализма и науки. Я придерживаюсь того, о чем уже писал раньше; это правда о том, что я наблюдал в изучаемой мною материальной вселенной. Всякий, кто возьмется организовать такую лабораторию, как моя, и провести те же эксперименты, получит сходные результаты, ибо они не плод тайного искусства или трюкачества, и наука, по мнению страстно приверженных ей философов — это все же публичное знание. Но то, что описано мною, — это правда в моем истолковании, и люди, получившие от меня новое знание, должны будут усвоить и мои представления (или по крайней мере значительную их часть) о том, как следует его интерпретировать. К тому же это не вся правда: описание экспериментов избранным мною способом (как я говорил в начале этой главы) является лишь логическим вариантом подачи материала, еще не получившим достаточного теоретического обоснования. Это был риторический прием, хотя и необходимый (как убеждают меня мои друзья-литераторы, потому что именно так распространяется научное знание), но все же риторический прием. Теперь позвольте мне начать новую главу и поведать еще одну историю.
Глава 11
Порядок, хаос, порядок: критерий пятый
Пятый критерий
В восьмидесятые годы результаты наших экспериментов так хорошо согласовались с представлениями о каскаде клеточных процессов, что мне на ум снова и снова приходил мой пятый критерий: удаление анатомического участка, в котором происходят биохимические, клеточные или физиологические изменения, должно препятствовать образованию следов памяти и/или вспоминанию в зависимости от того, когда по отношению к времени тренировки произведено удаление.
Для этого были три причины. Во-первых, я знал, что нам нужно будет провести соответствующий эксперимент, который потребует освоения совершенно новых методов. Во-вторых, я не мог без волнения думать о возможных результатах. И наконец, в-третьих, как я говорил раньше, меня всегда тревожила эстетическая и отчасти даже моральная сторона опытов, связанных с травмированием живых существ, а также проблема интерпретации получаемых данных. Эту проблему мне рано или поздно придется решать. В 1988 году Сэри Дейвис, бывший студент Габриела Хорна, работающий сейчас в Лондоне, опубликовал статью об экспериментах с повреждением левого и правого IMHV у цыплят. Он производил операцию в день их вылупления, а на следующий день обучал пассивному избеганию; после этого они клевали бусину, проявляли недовольство ее вкусом и во всем остальном вели себя нормально, однако у них обнаруживалась амнезия: они вторично клевали горькую бусину [I]1. Нечто в этом роде наблюдал и сам Габриел при изучении импринтинга. Всего этого можно было ожидать, исходя из биохимии, морфологии и нейрофизиологии IMHV после обучения, но мы должны были провести более систематические эксперименты. Я решил уделить этому большую часть 1989 и 1990 годов, так как получил исследовательский грант, позволивший мне намного сократить объем преподавательской и административной работы. Ниже излагается история этих двух лет с их итогами.
*1) Меня не перестает удивлять, что цыплята, у которых повреждена (или удалена, что безразлично) такая сравнительно большая область мозга, все же не погибают и по видимости сохраняют нормальное поведение. Скептики могли бы задаться вопросом, что же делает этот мозг большую часть времени. На это фермер-птицевод мог бы ответить, что единственная функция мозга состоит в том, чтобы удерживать птиц от непрерывной беготни, — это известно с незапамятных времен, с тех пор как первый крестьянин отрубил голову первому петуху, чтобы положить его горшок.
Мы смогли воспроизвести результаты Сэри, а потом продолжить исследования на их основе благодаря приезду в лабораторию двух очень разных физиологов, уже имевших ученую степень, — Терри Паттерсон и Дейва Гилберта. Терри только что защитила диссертацию, работая на цыплятах с Марком Розенцвейгом в Беркли. Карьера Дейва после получения степени в Бирмингеме была не совсем гладкой, и к тому времени, как я получил субсидию, он явно недоиспользовал свои возможности в качестве доктора философии, перебиваясь мытьем витрин, поскольку получить деньги на научную работу в Англии восьмидесятых годов было довольно трудно. Практически с момента появления Терри и Дейва в лаборатории между ними возникла личная неприязнь, но и как экспериментаторы, и в теоретическом плане они составляли великолепную пару. Мы спланировали эксперименты так, чтобы один производил повреждение мозга, второй обучал цыплят, не зная о характере повреждения, а третий (обычно это был я) проводил последующие испытания, опять-таки не зная о сделанном двумя другими.
Мозг повреждали так же, как в нейрофизиологических экспериментах. Цыпленка наркотизировали и стереотаксически вводили в мозг электрод (тонкую проволочку) так, чтобы его кончик оказался в нужном месте. После этого пропускали ток, разогревавший кончик электрода. Под действием повышенной температуры (или высокочастотных колебаний) клетки вокруг электрода погибали; размеры повреждения контролировали, изменяя силу тока и продолжительность воздействия. Затем электрод извлекали, кожу на голове зашивали и цыпленку давали возможность оправиться от наркоза в течение ночи. Для оценки влияния самой операции и наркоза в каждой подопытной группе имелись цыплята, подвергавшиеся «ложной» операции: с ним проделывали все, что и с остальными, но через электрод не пропускали ток. Все это тонкая работа, но при необходимых навыках за рабочий день можно прооперировать до дюжины цыплят. Они хорошо переносили операцию и наркоз: придя в себя, цыплята с поврежденным IMHV или LPO выглядели совершенно нормальными и не отличались ни от ложно оперированных, ни от интактных контрольных особей. После оценки поведения цыплят забивали, а поврежденные участки мозга исследовали под микроскопом. Как и в других случаях, для получения статистически достоверных результатов эксперимент многократно повторяли, чтобы в каждой опытной (не контрольной) группе насчитывалось двенадцать или более цыплят. При четырех рабочих днях в неделю (это дни, когда вылупляются цыплята) с учетом времени, затрачиваемого на ложные операции и на проверку локализации повреждений, для получения одной серии результатов требуются примерно три недели; практически же на это уходит около месяца, поскольку что-то всегда идет не так: то цыплята не вылупляются, то нужно идти на какое-то заседание и т.п.1.
*1) Я давно уже на собственном печальном опыте убедился, что при планировании эксперимента нужно взять максимальное потребное время, удвоить его и добавить еще немного — тогда ваши расчеты окажутся более или менее верными. Следует учитывать еще один важнейший момент если вы налаживаете метод, которым раньше не пользовались, а позаимствовали из чьей-то статьи, он обычно начинает работать не раньше чем с третьей попытки; в двух первых вы каким-то непонятным образом обретаете в кончиках пальцев ту магическую, не поддающуюся описанию силу («безмолвное знание», как назвал ее Майкл Полани, некогда химик, а потом философ), которая позволяет освоить метод не только в теории, но и на практике.
Потратив нужное число месяцев и сделав достаточно ошибок, чтобы освоить методику повреждения мозга, мы смогли приступить к первому этапу — к проверке результатов Сэри. В начале 1989 года мы подтвердили их. Сомнений быть не могло: цыплята с поврежденным IMHV явно обучались пассивному избеганию, т. е. клевали горькую хромированную бусину, так же, как их ложно оперированные собратья, трясли головами, ощутив ее вкус, и отворачивались при повторном предъявлении. Но спустя несколько часов при вторичном испытании они полностью забывали приобретенный опыт и клевали сухую бусину столь же энергично, как и контрольные цыплята, которым раньше давали бусину, смоченную водой. Таким образом, повреждение мозга не влияло на поведение птенцов (клевание бусины), на чувство вкуса или общую подвижность — они лишь не помнили, что следует избегать бусин определенного вида. Теперь нужно было пойти дальше Сэри и производить одностороннее повреждение. И снова мы получили ожидавшийся результат. У цыплят с поврежденным левым IMHV реакция избегания отсутствовала, а при правостороннем повреждении полностью сохранялась. Все было нормально — в полном соответствии с прогнозом, основанным на ранее полученных данных, и с пятым критерием, для запоминания необходим был левый, но не правый IMHV (рис. 11.1).
Рис. 11.1. Повреждение IMNV. На этом и следующих рисунках затемненные участки — места повреждения.
По логике нашего подхода следовало теперь проверить, что произойдет, если повредить мозг после обучения. Это можно было сделать не раньше чем через час, так как иначе на результатах испытаний могло бы сказаться действие наркоза. К нашему удивлению, даже двустороннее повреждение мозга спустя час после обучения не приводило к амнезии. Итак, первый парадокс: для запоминания необходим интактный левый IMHV, но коль скоро цыплята уже усвоили задачу (по крайней мере в первый час после обучения), IMHV оказывался ненужным [2].
Куда же переместилась память? Учитывая все полученные ранее биохимические и морфологические данные, следовало искать ее следы в LPO. Эксперимент подтвердил это. Двустороннее повреждение LPO через час после обучения действительно вызывало амнезию, которой не было при одностороннем правом или левом повреждении. По-видимому, в норме след памяти после обучения каким-то путем мигрирует из IMHV в LPO, чем и объясняется отсутствие амнестического эффекта повр
Дата добавления: 2016-03-05; просмотров: 775;
