Естественное течение легочной тромбоэмболии
Острые проявления заболевания. Непосредственный результат тромбоэмболии — это полная или частичная обструкция легочных артерий. При этом острые проявления ТЭЛА условно могут быть разделены на «респираторные» и «гемодинамические».
Респираторные нарушения при ТЭЛА. Эмболическая обструкция сопровождается появлением неперфузируемого, но вентилируемого участка легочной ткани, т. е. внутрилегочного «мертвого пространства» (гл. 200). Поскольку этот участок легкого исключен из газообмена, его вентиляция становится «бесполезной» в функциональном смысле. Возможным последствием эмболической закупорки легочных артерий является также спадение респираторных отделов легких и бронхиальная обструкция в зоне поражения. Этот феномен пневмоконстрикции может быть рассмотрен как своеобразный гомеостатический механизм, препятствующий «бесполезной» вентиляции.
Следствием эмболизации легочных артерий является также нарушение выработки альвеолярного сурфактанта. Как известно, этот поверхностно-активный протеин обеспечивает стабильное состояние альвеол. В случае же его отсутствия или недостатка происходит спадение респираторных отделов легких. Уже спустя 2—3 ч после прекращения капиллярного кровотока начинается снижение секреции сурфактанта альвеолярным эпителием, достигающее наибольшей выраженности через 12—15 ч после эмболического эпизода. Ателектаз легочной ткани как морфологическое отражение альвеолярной нестабильности появляется к исходу 1—2-х суток после прекращения регионарного легочного кровотока.
Достаточно часто при ТЭЛА выявляют артериальную гипоксемию, связываемую с нарушениями вентиляционно-перфузионных взаимоотношений, сердечной недостаточностью со снижением Ро2, в смешанной венозной крови и «облигатной» перфузией гиповентилируемых участков легочной ткани. Последняя объясняется тем, что повышенное вследствие эмболической обструкции давление в легочной артерии «преодолевает» существующую в нормальных условиях вазоконстрикцию невентилируемых (гиповентилируемых) участков легких.
Гемодинамические нарушения при ТЭЛА. Уменьшение вследствие тромбоэмболии емкости сосудистого русла приводит к повышению легочного сосудистого сопротивления, развитию легочной гипертензии и острого легочного сердца (острой правожелудочковой декомпенсации). Достаточно часто при этом наблюдаются также тахикардия и снижение сердечного выброса.
В отношении патогенетических факторов, определяющих выраженность гемодинамических нарушений при ТЭЛА, не существует единого мнения. Очевидно, что ключевой фактор — это выраженность эмболической обструкции. Однако здесь необходимо учитывать значительные резервные возможности емкости артериокапиллярного русла легких. Лишь выключение из активного кровотока более 50% сосудистого пространства приводит к значимому повышению легочного артериального давления. Учитывая тот факт, что у части пациентов с артериальной окклюзией меньшей выраженности наблюдается легочная гипертензия, в происхождении последней предполагают участие и рефлекторных, и/или гуморальных вазоконстрикторных механизмов. Впрочем и сегодня отстаивают то положение, что определяющим патогенетическим фактором гемодинамических нарушений при ТЭЛА некоторые авторы считают степень выраженности эмболической закупорки легочных артерий. Они полагают, что известная диссоциация между локализацией легочной тромбоэмболии и ее симптоматикой обусловлена недооценкой клинического течения ТЭЛА. Другие же исследователи представляют убедительные свидетельства развития легочной вазоконстрикции при тромбоэмболии. При этом высказывается предположение, что вазоконстрикция, как правило, ассоциируется с эмболической окклюзией мелких, а не крупных ветвей легочной артерии. Полагают также, что из тромбоцитов, покрывающих поверхность эмболов, высвобождаются гуморальные вещества, обладающие выраженными вазо- и бронхоконстрикторными эффектами, — серотонин и тромбоксан. Иными словами, эмболы вызывают не только механическую закупорку легочных артерий, но и обладают известным фармакологическим (гуморальным) потенциалом.
Учитывая эти обстоятельства, становится понятным тот факт, что нередко выраженность нарушений легочной гемодинамики при ТЭЛА «превосходит» анатомический субстрат болезни, что объясняется патогенетическим «вкладом» гуморальных и/или рефлекторных механизмов.
Важное значение в формировании актуальной клинической картины при легочной тромбоэмболии имеет предшествующее состояние сердечно-сосудистой и бронхолегочной систем. Так, в частности, небольших размеров тромбоэмболы могут вызывать минимальные патологические проявления у бывших до этого практически здоровыми лиц, тогда как на фоне хронических заболеваний сердца и легких нередко наблюдаются выраженные гемодинамические расстройства.
Как экспериментальные, так и клинические исследования свидетельствуют, что инфаркт легкого достаточно редко—менее чем в 10% случаев—осложняет течение ТЭЛА. Как известно, легочная ткань обеспечивается кислородом через систему легочных, бронхиальных артерий и воздухоносные пути. В этой связи наряду с эмболической окклюзией ветвей легочной артерии для развития инфаркта легкого необходимы регионарные нарушения кровотока в бронхиальных артериях и/или бронхиальной проходимости. К числу таких, предрасполагающих к развитию инфаркта легкого (в программе ТЭЛА), заболеваний или патологических состояний относятся левожелудочковая недостаточность, стеноз левого атриовентрикулярного отверстия (митральный стеноз), хронические обструктивные заболевания легких. У данной категории пациентов частота инфаркта легкого возрастает до 30%, существенно превосходя таковую у лиц, не страдающих сердечно-сосудистыми и/или бронхолегочными заболеваниями.
Подавляющее большинство эмболов, попав в сосудистое русло легких, лизируется. При этом растворение «свежих» эмболов начинается уже в первые дни болезни и продолжается в течение последующих 10—14 сут. В развитии глубокого венозного тромбоза задействованы два основных механизма восстановления сосудистой проходимости —фибринолиз и организация тромботических сгустков. Следует заметить, однако, что эндогенный фибринолиз более эффективен при растворении эмболов, нежели венозных тромбов. Вместе с тем трудно объяснить тот факт, что не все эмболы подвергаются лизису. Отчасти это может быть связано с дефектами самой эндогенной фибринолитической системы. Иногда, возможно, происходит достаточно быстрая организация тромбоэмболов, что и объясняет неэффективность фибринолиза. В противоположность этому может иметь место рецидивирующая эмболизация, и недостаточность тромборастворения скорее является кажущейся, чем реальной.
Важное значение при развитии ТЭЛА приобретает и формирующийся коллатеральный кровоток через систему бронхиальных артерий. Так, если эмболическая обструкция легочных артерий сохраняется в течение продолжительного времени (несколько недель), то резко возрастает кровоток через бронхиальные артерии, что характеризуется нормализацией (улучшением) регионарной перфузии. С восстановлением капиллярного кровотока увеличивается продукция сурфактанта и подвергаются обратному развитию ателектазы легочной ткани.
Диагностика
Внезапно возникающая «необъяснимая» одышка — наиболее частый, а нередко и единственный симптом легочной тромбоэмболии. Плеврогенные боли в грудной клетке и кровохарканье свидетельствует о развитии инфаркта легкого, а поскольку последний нечасто осложняет течение ТЭЛА, то эти симптомы достаточно редки. При массивной ТЭЛА больной может испытывать дискомфорт или боли загрудинной локализации, что, возможно, обусловлено ишемией правого желудочка сердца. У части пациентов наблюдаются синкопальные эпизоды, связываемые с неврологическими нарушениями. В ряде случаев «оккультная» ТЭЛА манифестирует повторными пароксизмами суправентрикулярных тахиаритмий, появлением или прогрессированием симптомов застойной сердечной недостаточности (гл. 182), внезапно возникающими обострениями хронических обструктивных заболеваний легких. И все же, как уже говорилось выше, наиболее характерный симптом ТЭЛА—это одышка. Если одышка приобретает выраженный характер, достигая степени удушья, то это, как правило, указывает на массивность эмболической окклюзии легочных артерий.
Физикальное обследование. Нередко данные физикального обследования весьма скудны, либо оно вообще не выявляет какой-либо патологии. Иногда при аускультации легких могут выслушиваться локальные влажные хрипы. Шум трения плевры или ограниченный плевральный выпот, указывающие на развитие инфаркта легкого, весьма редки.
Достаточно часто единственным патологическим признаком при исследовании сердечно-сосудистой системы оказывается тахикардия. В ряде случаев при массивной ТЭЛА удается выслушать правосердечный ритм галопа, громкий тон закрытия клапанов легочной артерии; по левому краю грудины пальпируется приподнимающий толчок правого желудочка; на яремной флебограмме регистрируется высокоамплитудная волна а. Иногда над проекцией легочной артерии выслушивается грубого тембра систолический шум. У некоторых больных обращает на себя внимание систолический или протяженный шум над легкими, усиливающийся на высоте вдоха. Этот своеобразный акустический феномен обусловлен турбулентным током крови в эмболизированных легочных сосудах и исчезает после растворения тромбоэмболов и восстановления регионарного легочного кровотока. Нередко при массивной ТЭЛА отмечается расщепление II тона, что указывает на развитие выраженной легочной гипертензии. Однако отсутствие акцентированного тона закрытия клапанов легочной артерии не исключает массивного характера легочной тромбоэмболии, поскольку при этом снижается величина легочного выброса.
Обнаружение глубокого венозного тромбоза является ключом к установлению диагноза ТЭЛА, но отсутствие клинико-инструментальных признаков флеботромбоза не исключает возможности легочной тромбоэмболии. Даже при самом тщательном обследовании клинические симптомы тромбофлебита (флеботромбоза) выявляются менее чем у 50% больных, переносящих ТЭЛА. Лихорадка не является характерным признаком легочной тромбоэмболии при отсутствии таких ее осложнений, как инфаркт легкого или пневмония. При развитии инфаркта легкого температура тела (оральная) может повышаться до 37,8—38,3°С; фебрильная лихорадка (более 39°С) заставляет проводить дифференциальную диагностику между инфарктом легкого и инфекционными осложнениями.
Следует подчеркнуть, что достоверный диагноз ТЭЛА, основывающийся лишь на учете клинических признаков, установить не удается, в связи с чем клиническое подозрение в отношении легочной тромбоэмболии нуждается в соответствующем инструментальном подтверждении (рис. 211-1).
Результаты лабораторных исследований. Клинические анализы крови имеют весьма ограниченное значение в диагностике ТЭЛА. Лейкоцитоз и ускорение СОЭ могут наблюдаться лишь при развитии инфаркта легкого. Используемые в диагностике легочной тромбоэмболии другие лабораторные тесты — специфические фибринопептиды, продукты деградации фибрина, ферменты, — не являются сколько-нибудь чувствительными или специфичными.
На ЭКГ у большинства больных, помимо тахикардии, не удается выявить патологических отклонений. При развитии массивной ТЭЛА и острой легочной гипертензии обнаруживаются ЭКГ-признаки гемодинамической перегрузки правых отделов сердца — отклонение электрической оси сердца вправо, P-pulmonale, изменения конечной части желудочкового комплекса в правых грудных отведениях (гл. 178). Эти изменения нередко достаточно скоротечны—от нескольких минут до нескольких часов; однако если они сохраняются более продолжительное время, то это указывает на выраженную эмболическую обструкцию легочных артерий.
На рентгенограмме органов грудной клетки в случае развития инфаркта легкого могут визуализироваться пневмоническая инфильтрация и плевральный выпот. Характерны инфильтративные изменения в плевре. Размеры и форма легочной инфильтрации различна и, как правило, рентгенологические изменения выявляются лишь спустя 12—36 ч от начала заболевания. Плевральный выпот обычно ограниченный, представляет собой геморрагический экссудат.
Рентгенологические признаки легочной тромбоэмболии сами по себе малоспецифичны и нередко имеют минимальную выраженность. Подозрительным в отношении эмболической обструкции являются различия диаметра легочных сосудов. Например, при эмболии правой главной легочной артерии может наблюдаться дилатация левой главной легочной артерии вследствие перераспределения кровотока. В части случаев имеет место «обрыв» контура легочного сосуда. Тромботический сгусток имеет схожую с кровью рентгеновскую плотность; прекращение же кровотока дистальнее места эмболической обструкции и создает скиалогическую картину внезапного «обрыва» сосуда.
Организация тромбоэмбола может привести к ретракции сосудистой стенки, в связи с чем относительно нормальный в проксимальном отделе просвет сосуда вдруг резко сужается. Наконец, вследствие прекращения или резкого уменьшения кровотока выявляются локальные изменения прозрачности легочной ткани, лучше заметные при сравнении обоих легочных полей. Если ТЭЛА не осложняется инфарктом легкого, то на рентгенограмме уже в первые 24 ч наблюдаются тени дисковидных ателектазов, обусловленных регионарными нарушениями выработки сурфактанта. Важно подчеркнуть, однако, что интактная рентгенограмма органов грудной клетки не исключает диагноза ТЭЛА. Более того, у большинства больных какие-либо характерные рентгенологические изменения отсутствуют.
Газовый состав артериальной крови. Массивная легочная тромбоэмболия ассоциируется, как правило, с развитием гипоксемии, гипокапнии и дыхательного алкалоза. Помимо этого, различия между Рсо2 в альвеолах и Рсо2 артериальной крови (РАсо2 — Расо2) указывают на увеличение мертвого альвеолярного пространства (гл. 200). Однако нормальные значения Ро2 артериальной крови не исключают диагноза ТЭЛА.
Перфузионное и вентиляционное сканирование легких. Диагностическая значимость лабораторных методов исследования оценивается весьма невысоко ввиду того, что при легочной тромбоэмболии они не несут какой-либо специфической информации. В этой связи для достоверной диагностики ТЭЛА необходимо перфузионное и вентиляционное сканирование легких. Перфузионное сканирование легких (сцинтифотография) представляет собой изображение распределения в сосудистом русле легких вводимого внутривенно радиофармпрепарата, получаемое с использованием гамма-камеры. Чаще всего при этом используют микросферы или микроагрегаты альбумина, меченные гамма-излучающими изотопами, в частности 99mТс. Радиоактивные частицы диаметром 50—100 мкм фиксируются в капиллярном русле легких, поскольку внутренний диаметр капилляров составляет около 10 мкм. Используют также радиоактивный инертный газ 133mХе в солевом растворе. Однако данный тест применяют при задержке дыхания. Распределение в легких названных радиофармпрепаратов позволяет надежно оценить состояние легочного кровотока и выявить его возможные нарушения. Интактные сканограммы легких характеризуются равномерным гомогенным распределением препарата и как бы воспроизводят нормальную анатомию легких. Любые отклонения от нормальной сканографической картины легких требуют своего объяснения, ибо указывают на нарушения легочного кровотока.
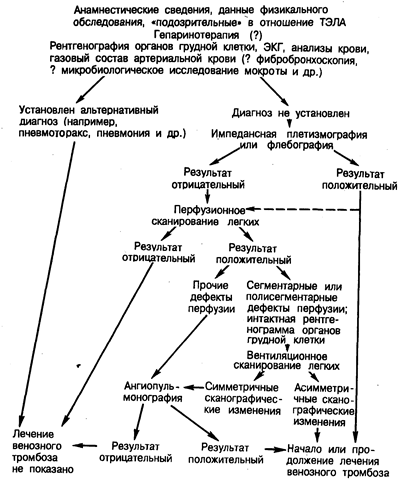
Рис. 211-1. Диагностический алгоритм при подозрении на тромбоэмболию легочной артерии.
Перфузионное сканирование легких при ТЭЛА характеризуется высокой разрешающей способностью. Интактная сканограмма легких позволяет отвергнуть диагностически значимую легочную тромбоэмболию. С другой стороны, выявление регионарных нарушений легочной перфузии позволяет предположительно диагностировать ТЭЛА, дифференцируя ее от некоторых других заболеваний и патологических состояний. Важно отметить, что сканирование легких — простая, безопасная и быстро выполнимая диагностическая процедура. При этом повторное сканирование легких позволяет судить о возможном улучшении (восстановлении) кровотока либо о появлении новых зон сосудистой обструкции. Обязательным является осуществление полипозиционного исследования. Однако перфузионное сканирование, характеризуя состояние легочного кровотока, не дает сколько-нибудь определенной анатомической информации. А как известно, помимо ТЭЛА, существует значительное число заболеваний, сопровождающихся нарушениями перфузии легочной ткани. Так, в частности, при пневмонии, ателектазе, пневмотораксе наряду с вентиляционными наблюдаются и перфузионные нарушения. Эмфизема легких, саркоидоз, бронхогенная карцинома, туберкулез характеризуются изолированными расстройствами легочного кровотока. Иными словами, обнаруживаемые на сканограмме перфузионные дефекты являются малоспецифичными.
Параллельное использование в этой связи вентиляционного сканирования с ингаляцией 127Хе или 133Хе позволяет существенно повысить специфичность радиологической диагностики ТЭЛА. Весьма важными при этом являются размеры выявляемых дефектов перфузии, а также характер патологических изменений в легких, обнаруживаемых при рентгенографии органов грудной клетки. Если все дефекты оказываются субсегментарными либо ограничиваются размерами рентгенологически выявляемой инфильтрации легочной ткани, то тогда показано проведение ангиопульмонографии. Если же дефекты перфузии достигают размеров сегментов, либо превышают их, либо выявляются в рентгенологически интактных зонах, то можно ограничиться вентиляционным сканированием. В случаях отсутствия вентиляционных расстройств в зонах перфузионных дефектов — своеобразная диссоциация перфузионного и вентиляционного сканирования—весьма вероятно предположение о ТЭЛА (рис. 211-2). Однако если в участках олигемии отмечаются и вентиляционные нарушения, то высказаться в пользу конкретного диагностического заключения весьма сложно, что вынуждает к проведению ангиопульмонографии.
Ангиопульмонография. Данная методика является по существу единственной, дающей анатомическую информацию о состоянии сосудистого русла легких. Рентгеноконтрастное вещество обычно вводится через сердечный катетер, располагающийся в просвете легочной артерии. При проведении ангиопульмонографии осуществляется также манометрия полостей сердца и легочной артерии с определением таких гемодинамических параметров, как давление в легочной артерии, легочное давление «заклинивания», сердечный выброс. При анализе ангиопульмонограмм специалист сталкивается с рядом трудностей, ограничивающих диагностическую ценность данной методики. Во-первых, это так называемые инъекционные артефакты, обусловливающие отсутствие контрастирования отдельных сосудистых зон. Исключить их можно путем повторного целенаправленного введения рентгеноконтрастного вещества. Во-вторых, при рентгеноконтрастировании артериального русла легких не удается получить изображения мелких сосудов, а значит, и высказаться с определенностью о наличии или отсутствии дистальной (периферической) эмболической обструкции. В-третьих, интерпретация ангиопульмонограмм может быть затруднена ввиду отсутствия характерных признаков поражения сосудов. Таким образом, при ТЭЛА диагностически значимыми являются два признака. Один из них—это внезапный «обрыв» сосудистого изображения (по ходу сосуда). Однако полная эмболическая обструкция встречается относительно редко; гораздо чаще наблюдаются дефекты наполнения, т. е. зоны эмболизации как бы окружаются рентгенонегативными тенеобразованиями. Пожалуй, основным противопоказанием для проведения ангиопульмонографии служит отсутствие квалифицированного медицинского персонала, способного осуществить данную диагностическую процедуру и оценить ее результаты. В опытных же руках возможные негативные последствия рентгеноконтрастного изучения артериального русла легких сводятся к минимуму.
При этом следует отказаться от введения больших объемов рентгеноконтрастного вещества непосредственно в просвет основного ствола легочной артерии, отдавая предпочтение введению небольших его количеств непосредственно в просвет легочных артерий, кровоснабжающих патологически измененные (по данным перфузионного сканирования) участков легочной ткани.
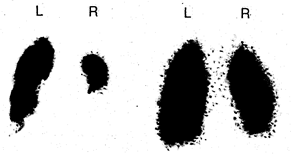
Рис. 211-2. Перфузионная сканограмма легких, задняя проекция (слева) —визуализируются множественные сегментарные и полисегментарные дефекты перфузии в верхней и нижней долях правого легкого, а также в язычковых сегментах и нижней доле левого легкого. Вентиляционная сканограмма того же больного демонстрирует нормальное и равномерное распределение 133Хе. Диагноз множественной тромбоэмболии ветвей легочной артерии подтвержден в ходе ангиопульмонографического исследования.
Обозначения: L —левое легкое; R — правое легкое.
Сложности в диагностике ТЭЛА обусловлены прежде всего наличием или отсутствием доказательств глубокого венозного тромбоза, выраженностью симптомов, а также опасностью пассивной (выжидательной) тактики ведения больного. Если в ходе импедансной плетизмографии или флебографии удается подтвердить факт глубокого венозного тромбоза, то это обстоятельство уже само по себе является веским основанием для начала антикоагулянтной терапии; проведение же при этом в последующем перфузионного сканирования легких оказывается необходимым лишь в редких случаях. Таким образом, диагностический поиск венозного тромбоза — составная часть комплексного обследования при ТЭЛА. Так, более чем у 20% больных, перенесших легочную тромбоэмболию, не удается обнаружить признаков флеботромбоза, возможно, потому, что тромботические массы могут полностью мобилизоваться. В этой связи при наличии выраженных клинических проявлений и/или возможного развития осложнений от проводимого медикаментозного лечения больным, безусловно, показано проведение ангиопульмонографии.
Лечение
Прежде всего больному необходимо внутривенно ввести гепарин. При наличии серьезных подозрений в отношении легочной тромбоэмболии, основанных на анализе клинической картины и данных рутинных инструментальных исследований, гепаринотерапия должна быть начата немедленно, не дожидаясь подтверждения диагноза. Исключение составляют лишь больные с продолжающимся или недавно закончившимся кровотечением, а также имеющие известные дефекты системы гемостаза.
Основными направлениями терапии как при легочной тромбоэмболии, так и при глубоком венозном тромбозе являются: 1) быстрое подавление тромбообразования; 2) активация лизиса тромбоэмболов; 3) предотвращение дальнейшего тромбообразования. Гепарин непосредственно воздействует на процесс роста тромбов; он способствует также их растворению и, хотя и опосредованно, профилактирует рецидивы тромбообразования. Помимо этого, гепарин тормозит агрегацию тромбоцитов, а значит, и высвобождение тромбоксана, серотонина. Однако до настоящего времени нет единого мнения о режиме гепаринотерапии, обеспечивающим наибольшую эффективность и безопасность; перечне необходимых лабораторных тестов, контролирующих состояние свертывающей системы крови в период введения гепарина; длительности и характере поддерживающей терапии; отборе пациентов, у которых введению гепарина предшествовала бы тромболитическая терапия.
Лечебная тактика. При глубоком венозном тромбозе гепаринотерапия может проводиться в виде непрерывного или прерывистого внутривенного, а также прерывистого подкожного введения. В рамках непрерывной инфузионной гепаринотерапии препарат вводят в дозе 1000 ЕД/ч. При прерывистом внутривенном введении дозы гепарина составляют 5000 ЕД каждые 4 ч или 7500 ЕД каждые 6 ч. Подкожно гепарин вводят в дозе 5000 ЕД каждые 4 ч, 10000 ЕД каждые 8 ч или 20000 ЕД каждые 12 ч. При этом показано, что каждый из перечисленных лечебных подходов характеризуется высокой терапевтической эффективностью и относительно безопасен. Однако независимо от способа и кратности введения гепарина суммарная суточная доза должна составлять 30000 ЕД. В настоящее время чаще применяют непрерывную внутривенную инфузию. Внутримышечных инъекций гепарина следует избегать ввиду высокого риска развития гематом.
При легочной тромбоэмболии больному вначале внутривенно струйко вводят 10000—20000 ЕД препарата, а спустя 2—4 ч переходят на один из стандартных протоколов лечения.
Лабораторный контроль. Лабораторный контроль при проведении гепаринотерапии осуществляют, используя традиционные тесты — тромбиновое время (ТВ), активированное частичное тромбопластиновое время (АЧТВ) и ряд других. Однако риск развития геморрагических осложнений в большей степени коррелирует с такими сопутствующими заболеваниями или патологическими состояниями, как язва желудка или двенадцатиперстной кишки, коагулопатии, уремия, нежели с отклонениями гемостазиограммы. Помимо этого, достижение требуемого эффекта гепарина (прекращение роста тромботических масс), как правило, не отражается на анализируемых лабораторных показателях. В этой связи остается нерешенным вопрос о выборе адекватных тестов для мониторинга при проведении гепаринотерапии. Согласно экспериментальным исследованиям, поддержание величины АЧТВ на уровне, превосходящем в 1,5 раза исходные значения этого показателя, предотвращает рост венозных тромбов. К сожалению, эти результаты не имеют соответствующего клинического подтверждения. И все же самым надежным среди лабораторных тестов контроля гепаринотерапии остаются ТВ и АЧТВ; при этом оптимальным считают повышение величины ТВ и АЧТВ в 1,5 раза по сравнению с исходным уровнем в ходе внутривенного прерывистого введения (забор крови для исследования должен осуществляться непосредственно перед очередным введением препарата) либо в 1,5—2 раза—при внутривенной непрерывной инфузии.
Длительность лечения. При глубоком венозном тромбозе один из перечисленных выше «полнодозных» режимов гепаринотерапии проводится в течение 7—10 дней, поскольку именно в эти сроки происходит растворение и/или организация тромботических масс. Такова же продолжительность лечения и при легочной тромбоэмболии. До разрешения кардиореспираторных симптомов и локальных нарушений венозного кровотока нижних конечностей больному предписывается постельный режим. Рекомендуется также носить эластичные чулки (сразу после прекращения болей в нижних конечностях), что способствует улучшению венозного кровотока. После купирования острых проявлений заболевания перед врачом встает следующий круг задач: отмена гепарина, переход на поддерживающее лечение малыми дозами препарата или назначение, протромбопенических лекарственных средств. При этом весьма важно решить вопрос о необходимости длительной профилактики рецидивов глубокого венозного тромбоза, а следовательно, и легочной тромбоэмболии. Если непосредственный фактор риска глубокого венозного тромбоза — ТЭЛА — ликвидирован, состояние больного вполне удовлетворительное, а по результатам импедансной плетизмографии отсутствуют какие-либо патологические отклонения, то может быть рекомендован следующий лечебный подход — с 7-го дня лечения переходят на введение малых доз гепарина (как правило, уже в амбулаторных условиях), осуществляемое в течение последующих 9—10 дней. Если же больной не отвечает этим критериям, то ему показана длительная профилактическая гепаринотерапия. При этом нет единства взглядов на оптимальную продолжительность лечения. Если факторы риска венозного тромбоза носят преходящий характер (например, иммобилизация в связи с переломом костей нижних конечностей), лечение следует проводить вплоть до ликвидации последних. Если же имеющиеся факторы риска развития флеботромбоза необратимы (например, застойная право- и/или левожелудочковая недостаточность) либо, по данным импедансной плетизмографии, выявляются признаки венозного тромбоза, то тогда вопрос о длительности профилактического лечения решается в известном смысле эмпирически. Минимальная длительность лечения составляет не менее 3 мес, поскольку именно этот период считается наиболее опасным в плане развития рецидивов глубокого венозного тромбоза и ТЭЛА. По прошествии же данного срока вопрос о целесообразности продолжения лечения решается с учетом наличия факторов риска флеботромбоза, результатов импедансной плетизмографии в динамике и наличия возможных осложнений самой терапии.
Протромбинопенические препараты в качестве инициальной терапии при легочной тромбоэмболии не используют. Их роль иная — в течение длительного времени поддержать антикоагулянтное состояние. Если больного планируют перевести на профилактический прием протромбинопенических препаратов, то за 3—5 дней до предполагаемой отмены гепарина стремятся контролировать протромбиновое время, в 1,5—2 раза превосходящее исходные значения этого показателя. Приемлемой альтернативой протромбинопеническим средствам служит подкожная гепаринотерапия. При этом введение препарата в дозе 7500—10000 ЕД каждые 12 ч является адекватным способом профилактики флеботромбоза, хорошо переносится и не требует динамического лабораторного контроля.
Тромболитические (фибринолитические) препарты (стрептокиназа, урокиназа) способствуют растворению венозных тромбов и легочных тромбоэмболов, но они не в состоянии заменить антитромботическое лечение. По окончании тромболитической терапии необходимо провести стандартный курс гепаринотерапии. Однако, несмотря на многочисленные исследования, не удалось продемонстрировать сколько-нибудь отчетливого влияния тромболитических препаратов на показатели ранней и поздней летальности у больных, переносящих глубокий венозный тромбоз и легочную тромбоэмболию. Тромболитическая терапия сопровождается определенным риском геморрагических осложнений, особенно у лиц, подвергнутых таким инвазивным исследованиям, как венопункция, артериальная пункция, установка катетера Свана — Ганца. Препараты этой группы показаны прежде всего больным с распространенным глубоким венозным тромбозом (илиофеморальным); яри массивной легочной тромбоэмболии со стойким снижением системного артериального давления, особенно в том случае, если невозможно осуществить эмболэктомию. Роль и место новых тромболитических препаратов (в частности, активаторов тканевого плазминогена), характеризующихся, как полагают, меньшей частотой геморрагических осложнений, в лечении по поводу глубокого венозного тромбоза и ТЭЛА требуют дальнейшего изучения.
Хирургическое лечение (тромбэктомия) при глубоком венозном тромбозе в настоящее время используют достаточно редко ввиду его .ограниченной эффективности. При ТЭЛА хирургическое лечение может быть рассмотрено как резервный подход при отсутствии должного эффекта гепаринотерапии. Хирургическое прерывание венозного кровотока и легочная эмболэктомия могут быть осуществлены у больных с геморрагическими диатезами, в случае невозможности провести антикоагулянтное лечение, а также при критическом состоянии пациентов, требующем неотложного вмешательства.
Объективно прерывание венозного кровотока способно предотвратить рецидив тромбоэмболии. Лигирование поверхностной бедренной вены, однако, не в состоянии профилактировать эмболический рецидив из глубоких вен бедра; лигирование же общей бедренной вены чревато серьезными нарушениями венозного оттока. Более того, это оперативное вмешательство должно быть двусторонним. В этом контексте более оправданным представляется прерывание венозного кровотока на уровне нижней полой вены, что может быть реализовано простым лигированием сосуда, прошиванием его стенки с формированием нескольких узкопросветных каналов, установкой специальных клипс или фильтров. Нехирургическое прерывание венозного оттока заключается в имплантации через катетер в просвет нижней полой вены различного рода фильтров (в частности, зонтичных фильтров) или баллонов. Каждый из перечисленных подходов имеет свои положительные и отрицательные стороны. Так, например, полное прекращение кровотока через нижнюю полую вену приведет к падению сердечного выброса и развитию отеков нижних конечностей; прошивание стенки сосуда не способно предотвратить рецидив тромбоэмболии мелких ветвей легочной артерии; внутрипросветные кава-фильтры могут смещаться вверх. Более того, практически ни один из используемых сегодня подходов не способен гарантировать от рецидива ТЭЛА. Последнее объясняется следующими причинами: спустя недели или месяцы от момента лигирования нижней полой вены формируются венозные коллатерали, через которые тромбоэмболы попадают в систему легочной артерии; блокада венозного оттока, естественно, не предотвращает развития тромбоэмболии из полостей правого сердца; сама по себе хирургическая манипуляция может привести к образованию пристеночного тромба в нижней полой вене, а значит, и к развитию легочной тромбоэмболии; установка различных модификаций фильтров, клипс, прошивание стенки сосуда не в состоянии предотвратить мелкую тромбоэмболию и, наконец, установленные в просвете нижней полой вены фильтры, баллоны и т. д. сами могут стать источником тромбообразования. Учитывая все вышеизложенное, а также тот факт, что основная масса легочных эмболов растворяется, блокаду кровотока на уровне нижней полой вены можно считать жизненно важной операцией у больных с высоким риском повторной тромбоэмболии, документированным глубоким венозным тромбозом и наличием противопоказаний к проведению антикоагулянтной терапии. Из этого правила, впрочем, есть одно исключение. Речь идет о больных с септическим тромбофлебитом вен малого таза, осложненным множественными септическими легочными эмболами. Если в данной клинической ситуации не удается добиться сколько-нибудь отчетливого эффекта от применения гепарина и антибиотиков, необходимо лигировать нижнюю полую и левую овариальную вены.
Показанием к проведению экстренной легочной эмболэктомии служат выраженные гемодинамические нарушения вследствие тромбоэмболии и прежде всего стойкая медикаментозно некорригируемая системная гипертензия; необходимым условием является наличие обученного персонала и необходимого медицинского оборудования.
Специальные замечания. Полное растворение легочных эмболов происходит не у всех больных. Нередко вследствие сохраняющейся резидуальной (остаточной) обструкции артерий малого круга кровообращения спустя месяцы или годы после перенесенного эпизода легочной тромбоэмболии появляются одышка и «необъяснимая» легочная гипертензия с явлениями правожелудочковой декомпенсации. В подобных случаях нередко ошибочно диагностируются бронхиальная астма, хронические бронхолегочные заболевания, первичная легочная гипертензия (гл. 210) или легочное сердце неустановленной этиологии (гл. 191). Здесь необходим точный дифференциальный диагноз, поскольку существующие методы хирургического лечения (тромбэндартерэктомия) главных или долевых легочных артерий нередко дают отчетливый эффект при этой в принципе некурабельной форме легочной гипертензии.
Прогноз. Прогноз в отношении пациентов с легочной тромбоэмболией, получавших адекватное и своевременное лечение, в целом благоприятный. Из десяти легочных тромбоэмболии лишь одна заканчивается летально. При этом смерть, как правило, наступает внезапно, и избежать ее можно, лишь осуществив известные профилактические мероприятия (см. выше). В тех же случаях, когда больной пережил острый эпизод тромбоэмболии и в последующем получал адекватную гепаринотерапию, его прогноз оценивается достаточно оптимистично.
К сожалению, сведения о частоте рецидивов легочной тромбоэмболии спустя месяцы и годы после имевшего место эмболического инцидента с учетом проводимой или непроводимой длительной антикоагулянтной терапии весьма ограничены. При отсутствии факторов риска венозного тромбоза, интактной плетизмографии вероятность рецидива ТЭЛА, как правило, невелика, однако эти данные нуждаются в уточнении.
Дата добавления: 2016-03-05; просмотров: 1078;
