Первичный амебный менингоэнцефалит
Первичный амебный менингоэнцефалит — это заболевание, вызываемое свободноживущими амебами рода Naegleria или Acanthamoeba. Первые чаще всего поражают детей и взрослых людей молодого возраста, заражение ими происходит, по-видимому, во время купания в пресной теплой воде, заболевание почти неизменно заканчивается летальным исходом. Заражение акантамебами встречается у лиц зрелого возраста, и в некоторых случаях отмечается спонтанное выздоровление.
В природных условиях свободноживущие амебы распространены повсеместно, обычные места их обитания — почва и вода. Хотя в целом они считаются безвредными, некоторые их разновидности обладают четко выраженной патогенностью для млекопитающих с поражением преимущественно центральной нервной системы. В тех случаях, когда от людей, заболевших менингоэнцефалитами, удавалось выделить и культивировать возбудителя, им, за редким исключением была, амеба Naegleria fowleri.
В различных странах мира, включая Австралию, Бельгию, Бразилию, ЧСФР, Великобританию, Ирландию, Новую Зеландию, Замбию и США, описано в общей сложности более 100 случаев заболеваний, вызванных представителями рода Naegleria. Серологические исследования свидетельствуют о том, что значительно чаще встречаются инаппарантные случаи инфекции. Большая часть из 50 выявленных в США случаев отмечена в юго-восточных штатах, в частности во Флориде, Джорджии и Вирджинии. Характерно, что заболевание начинается в летние месяцы, примерно через 1 нед после купания в водоемах с пресной или солоноватой водой. В ЧСФР 16 случаев заболевания возникли после плавания в закрытом бассейне с хлорированной водой при температуре 24°С и в 6 случаях заражение произошло, очевидно, после купания в водах горячего минерального источника. В странах Африки южнее Сахары заражение больных происходило, по-видимому, при вдыхании содержащего цисты воздуха в период сухого ветреного сезона харматтан. Гистологические данные свидетельствуют о том, что входными воротами инфекции служит непосредственно слизистая оболочка носа в области решетчатой кости. Клинически заболевание начинается остро, протекает быстро и заканчивается летально. Первым симптомом болезни является резкая, упорная головная боль в области лба с последующей тошнотой, рвотой, лихорадкой и ригидностью затылочных мышц. Возможно изменение вкуса или обоняния. Далее появляются сонливость, спутанность сознания, судороги и кома. По ходу болезни могут возникнуть признаки очагового поражения нервной системы.
Акантамебы вызывают более доброкачественную, хроническую форму менингоэнцефалита. По-видимому, они попадают в мозг и другие органы с кожных покровов или дыхательных путей. Клинически болезнь чаще проявляется у людей более старшего возраста, имеющих иммунные нарушения; в анамнезе у них могут отсутствовать указания о купании в пресноводных водоемах; в подобных случаях возможно спонтанное выздоровление. Патоморфологически данное заболевание отличается от такового, вызванного представителями рода Naegleria, развитием гранулематозных воспалительных реакций и наличием в тканях как трофозоитов, так и цист. К сожалению, идентификация возбудителя болезни не всегда бывает бесспорной, поскольку его редко удается выделить путем культивирования. Возможно, что данное заболевание вызывают несколько видов свободноживущих амеб. Описано около десятка случаев кератита, вызванного акантамебами.
Единственным точным методом диагностики является тщательное исследование спинномозговой жидкости (СМЖ). При инфекции, вызванной Naegleria, СМЖ кровянистая или гнойно-кровянистая и содержит множество нейтрофилов. Содержание белка повышено, глюкозы—понижено. В обычных посевах грамотрицательные возбудители не обнаруживаются. При микроскопическом исследовании свежих нативных нецентрифугированных препаратов спинномозговой жидкости обычно обнаруживаются живые трофозоиты диаметром 10—20 мкм, с зернистой цитоплазмой, четкой эктоплазмой и выступающими псевдоподиями. При охлаждении препарата трофозоиты могут потерять подвижность и распознать их становится значительно труднее. Диагноз подтверждается с помощью прямой реакции флюоресцирующих антител (ПРФА). Хотя Naegleria можно легко выращивать на обычных культуральных средах с добавлением кишечной палочки, этот метод непригоден для клинических целей, поскольку заболевание весьма быстро прогрессирует. При заболеваниях, вызванных акантамебами, в спинномозговой жидкости обычно находят множество моноцитов. Культивирование или микроскопия нативных препаратов не позволяют обнаружить трофозоиты. В немногих случаях наблюдалась положительная прямая реакция флюоресцирующих антител. Лечение с помощью стандартных антипротозойных препаратов является, по-видимому, совершенно неэффективным. Однако Naegleria высокочувствительны к действию амфотерицина В, миконазола, тетрациклина и рифампицина. В настоящее время известны только четыре случая излечения больных с заболеванием, вызванным Naegleria. Во всех этих случаях диагноз был установлен своевременно, в процессе лечения трое больных получали амфотерицин В, а один — амфотерицин В, миконазол и рифампицин. Вероятно, чтобы быстро получить эффективный уровень препарата в спинномозговой жидкости, весьма существенно вводить амфотерицин В внутривенно и субокципитально. Дозировка препарата при внутрижелудочковом введении составляет 0,5—1,0 мг в течение первых нескольких дней. В случае внутривенного введения дозировка препарата такая же, как при криптококкозном менингите (см. гл. 146). Акантамебы чувствительны к сульфаниламидам, клотримазолу, 5-FC и полимиксину В, однако клинических исследований такого рода не проводилось.
При обнаружении источника инфекции следует запретить купание в зараженном водоеме, что поможет предотвратить дальнейшее распространение болезни.
ГЛАВА 154. МАЛЯРИЯ
Джеймс Дж. Плорд, Николае Дж. Уайт (James J. Plorde, Nicholas J. White)
Определение. Малярия — это протозойная болезнь, передаваемая человеку при укусах комаров рода Anopheles, сопровождающаяся лихорадкой, ознобами, спленомегалией, анемией и характеризующаяся хроническим рецидивирующим течением. Несмотря на впечатляющие результаты начатой в 1956 г. по инициативе Всемирной организации здравоохранения программы по ликвидации малярии, технические и социально-экономические трудности вновь привели к появлению болезни во многих странах мира. Вследствие этого в настоящее время малярия, как и на протяжении многих веков, представляет собой одну из самых серьезных проблем для инфекционистов.' В США и Европе ежегодно отмечается несколько тысяч завозных случаев малярии среди лиц, прибывающих из эндемичных районов.
Этиология. Возбудителями малярии являются простейшие рода Plasmodium. Для человека патогенны Р. vivax, P. ovale, P. malariae и Р. falciparum. Человек заболевает в момент инокуляции самкой малярийного комара спорозоитов возбудителя в лимфогематогенную систему при кровососании. После кратковременного пребывания в периферической крови спорозоиты проникают в гепатоциты, давая тем самым начало доклинической печеночной (экзоэритроцитарной) стадии болезни. В процессе бесполого размножения, называемого шизогонией, из одного спорозоита в конечном счете образуется от 2000 до 40 000 печеночных мерозоитов. В большинстве случаев эти дочерние клетки через 1—6 нед снова попадают в систему кровообращения. При инфекциях, вызываемых некоторыми северными штаммами Р. vivax, выход в кровь мерозоитов из печени происходит примерно через 10 мес от момента заражения, в сроки, совпадающие с кратковременным периодом выплода комаров в следующем году. При инфекциях, вызываемых Р, falciparum и Р. malariae, печеночная стадия на этом заканчивается. Если инфекция вызвана остальными видами возбудителей, печеночные стадии (гипнозоиты) персистируют и вызывают, спустя месяцы и годы новые эпизоды выхода паразитов в кровь.
Эритроцитарная, или клиническая, стадия малярии начинается с прикрепления попавших в кровь мерозоитов к специфическим рецепторам на поверхности эритроцитов. Эти рецепторы, по-видимому, неодинаковы для разных видов малярийных паразитов; так, для Р. vivax они связаны с антигенами группы крови Даффи (Fy8 или FyY В этой связи существует предположение, что лица, не имеющие антигена Даффи (FyFy) (к ним относятся большинство населения Западной Африки и их потомки), устойчивы к заражению трехдневной малярией. Считают, что рецептором для Р. falciparum является гликофорин, сиалогликопротеин мембраны эритроцита. После прикрепления мерозоит инвагинирует мембрану эритроцита и постепенно оказывается внутри клетки. Там возбудитель переходит на стадию кольцевидного трофозоита, который, затем, увеличиваясь в размерах, приобретает неправильную или амебовидную форму. Далее начинается деление ядра на несколько фрагментов и трофозоит превращается в многоядерный шизонт. Наконец, цитоплазма концентрируется вокруг каждого дочернего ядра, при этом формируется новое поколение мерозоитов. Через 48 ч (72 ч в случае Р. malariae) после начала инвазии эритроцит разрывается, высвобождая от 6 до 24 мерозоитов, каждый из которых способен положить начало новому эритроцитарному циклу. При повторении такого цикла в некоторых эритроцитах образуются имеющие характерные морфологические признаки половые формы возбудителей малярии (гамонты); они не вызывают разрыва эритроцита и не способны к дальнейшему развитию, если не попадут при кровососании в организм комаров соответствующего вида. В кишечнике комара происходит оплодотворение, образуется зигота, которая инцистируется в наружной стенке кишки и высвобождает десятки тысяч спорозоитов. Последние проникают в слюнные железы комара и инокулируются человеку при очередном кровососании.
Эпидемиология. Малярия сохраняется только в тех районах мира, где плотность популяций как малярийных комаров, так и инвазированных людей поддерживается выше определенного критического уровня, необходимого для стойкой передачи болезни. Мероприятия по борьбе проводятся с.целью уменьшения плотности обеих популяций до уровней, достаточно низких для того, чтобы прервать цепь передачи возбудителя болезни. В число важных мер борьбы входят дренирование или ликвидация мест выплода переносчика, обработка инсектицидами остаточного действия, использование пологов и кожных репеллентов, эффективное лечение больных, а также проведение крупномасштабных программ подавляющей химиотерапии среди некоторых групп населения.
В результате активного сотрудничества по осуществлению международной программы по ликвидации малярии в 1956—1968 гг. было достигнуто значительное снижение заболеваемости. На более чем 75% пораженной территории болезнь была ликвидирована либо было начато активное осуществление программ по ее ликвидации. Однако в настоящее время малярия все еще поражает 250—300 млн жителей 104 стран Африки, Латинской и Южной Америки, Азии и Океании. Ежегодно на долю только одной тропической Африки приходятся 200 млн случаев заболевания малярией и большая часть из 1 млн случаев смерти от этой болезни. Наличие мигрирующих групп населения, значительная распространенность переносчиков и высокий уровень передачи болезни — все это ставит под сомнение возможность успешной ликвидации малярии в этих районах. Более того, развитие устойчивости к инсектицидам, равно как и различные административные и социально-экономические проблемы, привело к утрате результатов, достигнутых при осуществлении ранее успешных программ ликвидации малярии в ряде стран. К указанным выше трудностям добавилось продолжающееся распространение лекарственной устойчивости у штаммов малярии в ряде районов Южной Азии, Западной части Тихого океана, Центральной и Южной Америки. Устойчивые штаммы обнаружены в восточных и центральных районах Африки и на Индийском субконтиненте, где раньше этой проблемы не существовало.
В США эндемическая малярия встречалась до 50-х годов текущего столетия. В последующие годы в США продолжали регистрироваться завозные случаи болезни и в результате передачи возбудителя комарами-переносчиками спорадические вспышки малярии (интродуцированная малярия). Однако до 1966 г. их общее число не превышало 200 случаев в год. Однако это число стало быстро возрастать по мере возвращения инфицированных военнослужащих из Юго-Восточной Азии, достигнув пика свыше 4000 случаев в 1970 г. С этой волной завозной малярии был связан небольшой подъем числа случаев малярии, связанных с переливанием крови и внутривенным введением наркотиков. Хотя указанная эпидемия угасла, заболеваемость малярией среди гражданского населения не снизилась (рис. 154-1). С 1970 по 1979 г. число ежегодно регистрируемых случаев малярии среди туристов, деловых людей, учителей, студентов и других гражданских лиц возросло со 151 до 825; в 1984 и 1985 г. в СЩА ежегодно отмечалась примерно 1000 диагностированных случаев малярии. За редким исключением, заражение малярией происходило за рубежами США: примерно 40% в Азии, 30% в Африке и 20% в странах Карибского региона и Латинской Америки. Из числа недавно зарегистрированных случаев малярии на долю граждан США приходится 40%; больше половины из них заразились в Африке. Большая часть случаев малярии среди иностранных граждан была отмечена у иммигрантов из Юго-Восточной Азии. Данные эпидемиологического надзора свидетельствуют о том, что 2—5% лиц этой группы бывают инфицированы к моменту въезда в США. Клинические проявления малярии развиваются обычно в течение 6 мес с момента прибытия в США, однако в 30% случаев трехдневной малярии. они появляются в более поздние сроки. В 1983 г. тропическая малярия составляла 25% всех случаев болезни и все три летальных исхода были вызваны вирулентным штаммом ее возбудителя. Подавляющее большинство этих случаев можно было бы предупредить посредством соответствующей химиопрофилактики. До тех пор, пока туристы не будут получать -достаточно полную информацию об опасностях, связанных с поездками без должной защиты в эндемичные по малярии районы, количество завозных случаев болезни в США будет продолжать увеличиваться.
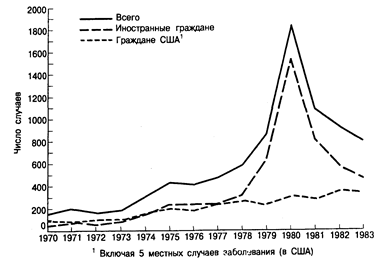
Рис. 154-1. Случаи малярии у граждан США и иностранных граждан, проживающих в США (включая Пуэрто-Рико, Виргинские острова и остров Гуам), 1970—1983 гг. (по данным Эпидемиологического надзора: Ежегодные данные, 1984, Атланта, ДжА, Центр по борьбе с болезнями, 1985 г.).
Патогенез и патологические изменения. Инвазирование, повреждение и разрушение эритроцитов малярийными паразитами, местные и системные нарушения кровообращения и связанные с ними метаболические изменения — все это играет важную роль в патофизиологии малярии.
Изменения эритроцитов. Различные виды малярийных плазмодиев существенно различаются по способности инфицировать эритроциты. Возбудители трехдневной малярии и малярии овале поражают только незрелые эритроциты, возбудители четырехдневной малярии — только стареющие. Поэтому при заболеваниях, вызванных указанными возбудителями, поражается не более 1—2% эритроцитов. Возбудитель тропической малярии, хотя и предпочитает молодые эритроциты, поражает красные кровяные клетки любых возрастов и может вызывать исключительно высокие уровни паразитемии, что и является фактором, обусловливающим высокую летальность при этом заболевании. Однако наличие определенных аномалий эритроцитов является, по-видимому, фактором, ограничивающим интенсивность паразитами и связанной с ней заболеваемости и смертности. Особенно убедительно это было показано у больных с серповидно-клеточной анемией. Развитие паразита замедляется в эритроцитах AS, находящихся в условиях низкого давления кислорода, как, например, в русле капилляров внутренних органов. Тактоиды, формирующиеся при образовании серповидных эритроцитов AS, могут также оказывать негативное воздействие на паразитов и способствовать тому, что деформированные эритроциты становятся более подверженными фагоцитозу. Подобный же эффект, хотя и не столь подробно изученный, наблюдается при талассемии и дефиците глюкозо-6-фосфатдегидрогеназы или пиридоксалькиназы, поскольку эти аномалии обнаруживаются чаше всего в районах распространения малярии. Возможная защита от инвазии отчасти может быть связана с повышенной чувствительностью таких эритроцитов к повреждению окислителями. При талассемии и сходных с ней гемоглобинопатиях постоянная продукция фетального гемоглобина также может иметь определенное значение, поскольку развитие возбудителя тропической малярии замедляется в содержащих гемоглобин эритроцитах. У лиц с меланезийским овалоцитозом своеобразная защита от малярии обеспечивается благодаря ригидности стенки эритроцитов, которая препятствует проникновению в него мерозоитов.
В инфицированных эритроцитах происходит ряд изменений. До 75% гемоглобина в эритроците поглощается и переваривается возбудителем по мере его роста. При паразитировании возбудителя тропической малярии в местах скопления специфического антигена на мембране эритроцита формируются электронно-плотные бугорки. Эти структуры, по-видимому, участвуют в прикреплении инфицированных клеток к эндотелию капилляров и посткапиллярных вен в глубоких тканях, что приводит к внутрисосудистой агглютинации и застою эритроцитов («слэж»). При поражении любым из четырех видов возбудителей малярии эритроциты становятся менее эластичными и, следовательно, более подверженными захвату селезенкой. По мере стимулирования иммунной системы циркуляция эритроцитов по селезеночным тяжам усиливается, захват эритроцитов селезенкой увеличивается, при этом пораженные эритроциты подвергаются тесному контакту с активированными макрофагами. Здесь внутриэритроцитарные плазмодии повреждаются или разрушаются секретируемыми макрофагами цитотоксинами и/или происходит фагоцитоз самих эритроцитов. Избежавшие захвата селезенкой пораженные эритроциты разрушаются в момент меруляции, процесса, вызывающего повышение температуры тела больного. Последнее, как полагают, связано с высвобождением внутриклеточного пирогена, однако участвующие в этом конкретные механизмы остаются неизученными.
Тяжесть анемии при острой малярии часто превосходит степень таковой, которую можно было бы предсказать, учитывая гибель только инфицированных эритроцитов. Это расхождение объясняется рядом факторов. Секвестрация (задержка эритроцитов в селезенке. — примеч. пер.) приводит к заниженной оценке общего числа пораженных эритроцитов, угнетается эритропоэз, и наряду с этим как неинфицированные, так и инфицированные эритроциты исключаются из кровообращения.
Весьма редким, но ярким примером процесса такого рода является гемоглобинурийная лихорадка, сопровождающаяся массивным внутрисосудистым гемолизом. Чаще всего эритроциты разрушаются в рет.икулоэндотелиальной системе печени и селезенки. Иногда отмечается положительная реакция Кумбса. Указанные явления отражаются также и на других компонентах крови. Часто отмечается тромбоцитопения в результате как депонирования крови в селезенке, так и сокращения срока жизни тромбоцитов. Диссеминированное внутрисосудистое свертывание встречается при тяжелом течении тропической малярии, однако в целом отмечается менее чем в 5% случаев. Количество лейкоцитов и лейкоцитарная формула обычно бывают в пределах нормы.
Нарушения кровообращения. За исключением периодов сужения сосудов кожи, которыми сопровождаются приступы озноба при малярии, кожные покровы у лихорадящего больного теплые, кровообращение хорошее, артериальное давление слегка понижено или в пределах нормы, пульс учащен. При тяжелой тропической малярии такое состояние вазодилатации может быть усилено в результате гипотензии и снижения центрального венозного давления. Увеличение пространства, занимаемого сывороточным альбумином, меченным радиоизотопным йодом, и выделения альдостерона и антидуретического гормона свидетельствуют об уменьшении объема эффективно циркулирующей крови вследствие расширения объема сосудистого русла. Функция миокарда сохраняется, несмотря на секвестрацию инвазированных эритроцитов в мелких сосудах сердца. Следует очень тщательно следить за введением больному жидкостей, чтобы избежать двойной опасности, заключающейся в остром некрозе канальцев и отеке легких. Иногда без видимой причины развивается тяжелый шок; такое состояние называется альгидной малярией и, возможно, является вторичным следствием спонтанной бактериемии, вызванной грамотрицательными палочками.
Если малярия заканчивается смертью больного, то почти во всех случаях она наступает в результате окклюзии микроциркуляции во внутренних органах эритроцитами, инвазированными Р. falciparum, что является отражением способности этих возбудителей инфицировать значительную часть эритроцитов у неиммунного больного, а также избирательного прикрепления пораженных эритроцитов к сосудистому эндотелию капилляров и посткапиллярных венул. Хотя указанный процесс охватывает все глубокие ткани, он наиболее выражен в головном мозге. Чаще всего поражаются дети, беременные женщины, туристы, выезжаю щие в эндемичные районы, и другие неиммунные лица или лица с нарушенным иммунитетом, а также лица, у которых уровень паразитемии может превышать 100•109/л.
Метаболические нарушения. Развитие большинства патологических реакций, описанных при тропической малярии, обусловлено местной тканевой гипоксией на участках нарушения микроциркуляции крови. К смертельному исходу может привести молочнокислый ацидоз в результате анаэробного гликолиза в организме хозяина или паразита. У беременных женщин или больных с интенсивной паразитемией значительные метаболические потребности малярийных паразитов могут вызывать выраженную рецидивирующую гипогликемию; индуцированная хинином гиперинсулинемия часто усугубляет эту проблему.
Иммунитет. Иммунный ответ при малярии, контролирующий нелетальные формы болезни и в конечном счете обеспечивающий защиту от реинфекции, изучен недостаточно. Предполагают, что за формирование противомалярийного иммунитетеа у обезьян ответственны как Т-, так и В-лимфоциты. Хотя известно, что. Т-клетки играют важнейшую роль, механизм их действия неясен. Некоторые авторы полагают, что они стимулируют эффекторные клетки, вероятно макрофаги, которые высвобождают при этом неспецифические факторы, способные повреждать или разрушать внутриэритроцитарных паразитов; они могут также способствовать выработке антител.
Штаммоспецифические противомалярийные антитела появляются на раннем этапе паразитемии и затем достигают высоких уровней, что совпадает с падением численности циркулирующих паразитов. Относительная редкость малярии у детей первых месяцев жизни объясняется, наличием у них попавших через плаценту антител IgG. Хотя наличие таких антител не гарантирует полного, иммунитета, исследования in vitro показали, что они способны блокировать инвазию эритроцитов мерозоитами, тормозить внутриклеточный рост паразитов и опсонизировать как мерозоиты, как и инфицированные эритроциты. При малярии у обезьян антигенные изменения плазмодиев приводят к рецидивным циклам паразитемии и выработке вариантоспецифических антител. Представляется вероятным, что аналогичные изменения происходят и у человека, что в конечном счете ведет к исчезновению эритроцитарных форм возбудителя малярии. При тропической малярии в результате этих процессов больной выздоравливает. При малярии трехдневной и овале внутриклеточные печеночные формы возбудителей ускользают от воздействия защитных факторов гуморального иммунитета и позднее могут давать начало новым генерациям малярийных плазмодиев в крови и поддерживать заболевание на протяжении 3—5 лет. Возбудитель четырехдневной малярии вызывает хроническое заболевание исключительно большой длительности (до 53 лет в одном случае), несмотря на отсутствие персистирующей экзоэритроцитарной стадии. Полагают, что это связано с длительным выживанием эритроцитарных форм возбудителя, концентрация которых бывает настолько низкая, что они не обнаруживаются в обычных препаратах крови. Каким образом возбудитель ускользает от воздействия иммунной системы, неизвестно, однако при весьма сходной форме малярии у обезьян спленэктомия быстро ведет к купированию инфекционного процесса, что свидетельствует о возможной защитной роли Т-клеток-супрессоров в селезенке.
Клинические проявления. Общая характеристика. Инкубационный период при трехдневной и тропической малярии составляет обычно 10— 14 дней, четырехдневной малярии — от 8 дней до 6 нед. Однако продолжительность его может увеличиваться при определенных формах трехдневной малярии, приобретенной в зоне умеренного климата, и у лиц, принимавших противомалярийные препараты подавляющего действия (супрессанты). В США интервал между моментом прибытия в страну и началом заболевания превышает 6 мес у 25% больных с трехдневной малярией и 1 мес у такой же части больных с тропической малярией. Имеются некоторые различия в клинических проявлениях малярии, вызванной разными видами возбудителей у неиммунных хозяев, однако для всех форм болезни характерны ознобы, повышение температуры тела, головная боль, боли в мышцах, спленомегалия и анемия. В разгар болезни на губах часто появляются герпетические высыпания. Нередко, особенно при тропической малярии, отмечаются гепатомегалия, умеренная желтушность и отечность. Хроническая малярия часто сопровождается крапивницей.
Отличительным признаком всех видовых форм малярии, кроме тропической, служат лихорадочные пароксизмы. Типичный приступ начинается с озноба, длящегося от 20 до 60 мин — «стадия холода», за которой следует «стадия жара» продолжительностью от 3 до 8 ч с повышением температуры тела до 40—41,7°С. «Стадия пота» характеризуется нормализацией температуры тела, обильным потоотделением, изнеможением больного.
Первые приступы малярии часто бывают тяжелыми и при отсутствии лечения могут повторяться на протяжении нескольких недель. Постепенно они становятся менее регулярными, более редкими и после исчезновения возбудителя из крови прекращаются совсем, знаменуя окончание периода первичных приступов. Рецидивы возникают в тех случаях, когда из персистирующих в печени гипнозоитов снова образуются эритроцитарные стадии возбудителя. В гипер- и голоэндемичных районах (например, в Западной Африке), где имеется интенсивная и постоянная передача возбудителя, дети заражаются малярией впервые в возрасте 6 мес, после снижения уровня материнских антител. Если ребенок переживает период первичных приступов, последующие эпизоды повторных заражений малярией протекают все более умеренно, хотя и при этом может отмечаться определенное ослабление организма, склонное к прогрессированию; у взрослых хронически инфицированных лиц температура тела, как правило, не повышается, причем бывают периоды, характеризующиеся отсутствием каких-либо симптомов болезни. Иммунитет непродолжительный. Если человек выезжает из эндемичных районов и возвращается туда через несколько лет, новое заражение вновь приводит к клинически выраженной форме заболевания. В тех районах мира, где передача малярии происходит с интервалами в случае миграции неиммунных лиц в эндемичные районы, у взрослых людей могут отмечаться клинически выраженные и иногда летальные случаи малярии.
Трехдневная малярия (Р. vivax и Р. ovale). [В нашей стране принято выделять заболевание, вызываемое Р. ovale, в отдельную форму, малярию овале. — Примеч. пер.]. Болезнь характеризуется наличием рецидивов, и, хотя редко заканчивается летально, полностью излечить больного весьма трудно. Началу острого заболевания предшествует продромальный период, сопровождающийся миалгией, головной болью, ознобом и небольшим повышением температуры тела в течение 48—72 ч. В начале лихорадка не носит периодического характера, поскольку циклы Созревания возбудителя не синхронизированы. Синхронизация обычно наступает к концу 1-й недели, вслед за чем приступы начинают повторяться ежедневно. Селезенка становится пальпируемой к концу 2-й недели болезни. При заболевании, вызываемом Р. ovale, симптомы выражены умереннее в период первичных приступов короче, чем при инфекции, вызываемой Р. vivax.
Четырехдневная малярия. Приступы отмечаются каждый третий день и повторяются регулярно. Четырехдневная малярия отличается от всех других форм болезни умеренной тяжестью и выраженной склонностью к хроническому течению; хорошо поддается лечению. Иногда эта форма малярии сопровождается отеками, альбуминурией и гематурией (не гемоглобинурией), клиническим синдромом, аналогичным острому геморрагическому нефриту. Это осложнение не следует путать с гемоглобинурийной лихорадкой. Хроническая четырехдневная малярия может быть связана с развитием уникального с клинической и гистологической точки зрения нефроза. В базальной мембране клубочков наблюдаются гранулярные отложения IgG, IgM, С3-компонента системы комплемента и антигенов возбудителя четырехдневной малярии, что свидетельствует о формировании иммунокомплексной нефропатии. Характерные для этой формы малярии длительные периоды бессимптомной паразитемии объясняют тот факт, что такие случаи часто являются источником трансфузионной малярии. В Африке имеется, по-видимому, положительная связь между паразитемиями, вызванными возбудителями тропической и четырехдневной малярии. В том или ином случае первый из них чаще встречается во время сухого сезона, а последний — в период влажного сезона.
Тропическая малярия. Ввиду асинхронного цикла размножения возбудителя начало болезни может быть постепенным, а лихорадка — постоянной, перемежающейся или нерегулярной. У меньшей части больных отмечаются типичные малярийные приступы. Быстро развивается спленомегалия, от мечаются головные боли, спутанность сознания, постуральная гипотензия, отеки и симптомы поражения желудочно-кишечного тракта. Если при острых приступах лечение проводится своевременно, заболевание протекает в средне-тяжелой форме и заканчивается выздоровлением больного без каких-либо осложнений. У неиммунных лиц при отсутствии лечения секвестрация инвазированных эритроцитов в глубоких тканях может привести к развитию тяжелых осложнений. Угроза появления последних весьма велика, если интенсивность паразитемии превышает 100•109/л возбудителей. К числу угрожающих клинических признаков относятся выраженная анемия, желтуха, гипервентиляция, а также признаки нарушения деятельности центральной нервной системы, такие как делирий, ступор или кома. В зависимости от того, какие преимущественно поражаются органы и системы, возможно развитие одного или нескольких из следующих злокачественных синдромов.
Церебральная малярия, тяжелейшее осложнение тропической малярии, — это симметричная энцефалопатия, протекающая в виде глубокой комы у больного без признаков очагового поражения нервной системы. У 50% взрослых и у большинства детей возможны судороги. Часто встречаются нарушения парного взора, изменяется тонус и разгибательные подошвенные рефлексы; брюшные рефлексы, как правило, отсутствуют. Тело больного может принимать неестественное положение. У 13% больных отмечается кровоизлияние в сетчатку. Давление спинномозговой жидкости обычно в норме, редко наблюдается отек соска зрительного нерва. Летальность у взрослых составляет 20%. Большинство летальных исходов наступает в течение первых 3 дней после госпитализации и обусловлено нарушением функций многих органов. К неблагоприятным прогностическим признакам относятся глубокая кома, уровень паразитемии выше 5%, лейкоцитоз выше 10•109/л и поражение почек. Данное состояние следует прежде всего отдифференцировать от вирусных и бактериальных менингоэнцефалитов, состояний после судорожных припадков на фоне лихорадочных заболеваний у детей, заторможенности и делирия, зачастую сопровождающих значительное повышение температуры тела. У неиммунных лиц исключить указанные состояния относительно нетрудно. Однако, учитывая широкое распространение бессимптомного носительства малярии в эндемичных районах, обнаружение Р. falciparum в мазках крови у иммунного больного, находящегося в коме, не позволяет определенно утверждать диагноз церебральной малярии.
В отличие от большинства угрожающих жизни осложнений тропической малярии, которые, как правило, отмечаются при поступлении больных в лечебные учреждения, острая легочная недостаточность может развиться на 3-й или 4-й день лечения. Тем не менее она служит причиной смерти примерно 80% лиц с этим осложнением. Хотя у некоторых больных причиной данного синдрома является гипергидратация, краевое давление в легочных капиллярах в большинстве случаев остается в норме. Это свидетельствует о том, что основным патогенетическим механизмом можно рассматривать изменения в русле легочных капилляров, не похожие на обнаруживаемые при дистресс-синдроме у взрослых. Как показали патоморфологические исследования, у лиц, умерших от дыхательной недостаточности, отмечаются выраженная отечность клеток легочного эндотелия, сужение просвета капилляров, септальный отек и наличие интерстициальных макрофагов, содержащих фагоцитированный малярийный пигмент.
Возможна обструкция капилляров органов брюшной полости с последующими рвотой, болями в животе, диареей или меленой. В таких случаях иногда возникает подозрение на бактериальную дизентерию или холеру. Нарушение функции печени ведет к' уменьшению синтеза факторов свертывания крови, снижению клиренса противомалярийных препаратов, нарушению гликонеогенеза и способствует развитию желтухи, характерной для тяжело протекающей тропической малярии. Значительно реже отмечаются более глубокие нарушения, ведущие к развитию печеночной недостаточности. Лихорадка у больных с признаками преимущественного поражения желудочно-кишечного тракта может быть невысокой или отсутствовать.
Уровень мочевины крови при тяжелой тропической малярии часто повышается, чему способствуют дегидрация. повышенный катаболизм белков и транзиторное поражение почек. На фоне адекватной регидратации и лечения противомалярийными препаратами уровень мочевины крови и сывороточного креатина у большинства больных снижается до нормы. Если при поступлении уровень сывороточного креатина превышает 3 мкг/мл, объем выделенной в течение первых 24 ч пребывания в стационаре мочи меньше 400 мл и имеются другие признаки злокачественного синдрома, следует в первую очередь предположить развитие у больного острого тубулярного некроза. Функция почек, как правило, восстанавливается, если больной преодолевает острую фазу болезни и в лечебном учреждении имеются условия для проведения интенсивной терапии и гемодиализа.
Гемоглобинурийная лихорадка. Это осложнение, развивающееся только при тропической малярии. Типичный приступ начинается с озноба и лихорадки, за которыми следуют массивный внутрисосудистый гемолиз, желтуха, гемоглобинурия, коллапс, острая почечная недостаточность и уремия. При патоморфологическом исследовании в почках находят некроз канальцев и гемоглобиновые цилиндры. Летальность достигает 20—30%; у лиц, перенесших такой приступ, весьма возможны повторные эпизоды гемолиза в случае последующего заражения малярией.
Хотя гемоглобинурийная лихорадка часто классифицируется как одно из злокачественных осложнений тропической малярии, причины ее остаются неясными. У многих больных в момент гемолиза паразитемии нет. В прошлом гемоглобинурийная лихорадка обычно отмечалась у неимунных или частично иммунных больных с тропической малярией, нерегулярно принимавших хинин; это может свидетельствовать о том, что причиной гемолиза являются аутоиммунные реакции с эритроцитами, подвергшимися воздействию лекарственных препаратов, паразитов либо тех и других одновременно. Однако гемоглобинурийная лихорадка может возникнуть и у больных с дефицитом глюкозо-6-фосфат-дегидрогеназы, принимавших противомалярийные препараты окислительного действия, и у больных с тяжелой малярией до начала лечения. Частота летальных исходов значительно снижается при проведении соответствующего лечения при острой почечной недостаточности.
Прочие осложнения. Разрыв селезенки встречается относительно редко, однако малярия до сих пор самая частая причина спонтанного разрыва и предрасполагающий фактор при травматическом разрыве этого органа. Это осложнение чаще всего отмечается при трехдневной малярии.
Хроническая малярия или повторные заражения в эндемичных районах ведут к развитию анемии, астении, кахексии, а также к иммуносупрессии, опосредованной макрофагами и Т-клетками. Указанные нарушения особенно выражены у детей в возрасте младше 3 лет. Тропическая малярия у беременных женщин представляет крайнюю опасность как для матери, так и для плода. Это объясняется тем, что обусловленная беременностью иммуносупрексия усиливает размножение паразитов. Часто отмечается интенсивная паразитемия с сопутствующими ей осложнениями, особенно гипогликемией и острой легочной недостаточностью. Задержка инфицированных эритроцитов в сосудах плаценты может привести к нарушению кровоснабжения плода и его гибели. У родившихся живыми детей отмечаются низкая масса тела и высокая смертность в неонатальном периоде. Встречаются, хотя и редко, случаи врожденной малярии; чаще это отмечается у потомков неиммунных матерей. Возможно развитие вторичной бактериальной инфекции, в ряде случаев непосредственно ведущей к смерти больного. Часто отмечаются бактериальная дизентерия, холера и пиогенная пневмония. Туберкулезные очаги у больных малярией часто увеличиваются, иногда наблюдаются случаи милиарного туберкулеза.
У больных, проживающих в эндемических по малярии районах, часто выявляется гепатоспленомегалия неизвестной этиологии. У некоторых из них отмечаются инфильтрация лимфоцитами синусоидных капилляров печени, значительное повышение уровней сывороточных антител класса IgM и малярийных антител. Это заболевание, известное как синдром тропической спленомегалии, редко встречается у детей младше 8 лет. В отличие от обычной малярийной гепатоспленомегалии этот синдром редко сопровождается паразитемией. Полагают, что это заболевание является результатом нарушения осуществляемого Т-клетками контроля продукции иммуноглобулинов, что ведет к избыточной их продукции и формированию иммунных комплексов. Длительная противо малярийная терапия ведет к уменьшению размеров селезенки и к исчезновению лимфоцитоза печеночных синусоидных капилляров. Увеличилось количество эпидемиологических данных о том, что малярия является одним из факторов, играющих роль в этиологии лимфомы Беркитта. Полагают, что продолжительная стимуляция лимфоидной системы при хронической малярии способствует тому, что она становится более подверженной неопластическим трансформациям при наличии вируса Эпстайна — Барра.
Лабораторные исследования. Количество лейкоцитов в крови понижено или находится в пределах физиологической нормы. Количество тромбоцитов, особенно при тропической малярии, часто понижено, СОЭ повышена. У подавляющего большинства больных с клинически выраженной малярией в мазках периферической крови обнаруживают малярийных паразитов. При подозрении на малярию необходимо тщательно исследовать должным образом окрашенные препараты крови. Для неопытного лаборанта тонкие мазки крови, взятой из пальца, следует окрасить краской Райта или Гимзы (в нашей стране, принят метод Романовского. — Примеч. пер.). Инфицированные эритроциты чаще обнаруживаются по краю мазка; внеклеточных паразитов нет. Толстые мазки (в нашей стране принят термин «толстая капля». — Примеч. пер.) следует тщательно высушить и окрасить разведенной краской Гимзы или Филда (в нашей стране принят метод Романовского.—Примеч. пер.). Преимущество этого метода заключается в более высокой сконцентрированности паразитов в препарате крови, однако возможны артефакты и для безошибочного исследования таких препаратов требуется большой опыт.
Морфология четырех видов малярийных паразитов человека достаточно специфична, чтобы их можно было идентифицировать в мазках крови. Инфицированные Р. vivax эритроциты увеличены в размере, бледноокрашенные, содержат диффузно расположенные ярко-красные пятнышки (зерна Шюффнера); форма и размеры паразитов при этом могут быть самыми разнообразными; при малярии овале инфицированные эритроциты имеют овальную форму, в остальном они похожи на эритроциты, пораженные возбудителями трехдневной малярии (Р. vivax). Размер эритроцитов, инфицированных возбудетелем четырехдневной малярии (Р. malariae), не изменен, они не содержат зернистости. Паразиты часто принимают лентовидную форму, причем мерозоиты располагаются в виде розетки вокруг находящегося в центре пигмента; возбудители тропической малярии кольцевидной формы, очень мелкие, содержат одно или, чаще, два комочка хроматина, распластаны, как правило, по краю эритроцита. В мазках периферической крови обнаруживаются только кольцевидные стадии бесполых форм паразита, причем могут встречаться случаи присутствия в одном эритроците нескольких микроорганизмов. Гамонты отличаются более крупными размерами, имеют банановидную форму. При уровне паразитов выше 2% есть все основания предполагать наличие тропической малярии.
Исследование препаратов крови имеет такую же диагностическую ценность, как и исследование пунктата селезенки или костного мозга из грудины. Серологические реакции используются главным образом для эпидемиологических, реже для клинических целей, однако они полезны при отборе потенциальных доноров крови. Реакция непрямой иммунофлюоресценции является, по-видимому, наиболее чувствительной и специфической. Показано, что с помощью моноклональных антител и ДНК-зонда можно выявить весьма низкий уровень паразитемии. Окончательная их роль в клинической практике, эпидемиологических исследованиях и отборе донорской крови пока еще не установлена.
Диагностика. Большое значение в диагностике малярии имеет тщательно собранный анамнез. Наличие болезни можно предположить у пациента с лихорадкой, проживавшего или путешествовавшего в течение предшествующих 12 мес в эндемичных районах (на Гаити, в Латинской Америке, Азии или Африке). Если в анамнезе есть сведения о предыдущих эпизодах малярии, типичных приступах болезни или о некоторых манипуляциях (переливание крови, инъекции наркотиков у наркоманов), это также должно вызвать предположение о соответствующем диагнозе. На 2-й неделе болезни часто отмечается спленомегалия. Увеличение количества лейкоцитов нехарактерно для малярии. Диагноз подтверждается посредством обнаружения малярийных плазмодиев в периферической крови. Поскольку интенсивность паразитемии колеблется от часа к часу весьма резко (особенно при тропической малярии), мазки крови необходимо исследовать повторно в течение 2 или 3 дней.
Полное излечение при малярии затруднительно, особенно в случае трехдневной малярии, однако почти все клинические проявления болезни купируются хинином или одним из новых противомалярийных препаратов, поэтому отсутствие эффекта от лечения указанными препаратами является веским доводом против диагноза малярии.
Лечение. Применением соответствующих химиопрепаратов можно подавить клинические проявления малярии у лиц, заразившихся в эндемичных районах, или достигнуть полного излечения. Однако появление лекарственно-устойчивых штаммов возбудителя тропической малярии в Юго-Восточной Азии, включая Бирму, Индонезию и Филиппины, и на Индийском субконтиненте, в Южной Америке, Восточной и Центральной Африке требует использования комбинированных препаратов для лечения больных.
Лечение при острых приступах болезни. Лечение при остром приступе малярии всех видовых форм (за исключением лекарственно-устойчивой тропической малярии) может быть проведено хлорохином (табл. 154-1). Хлорохин полностью купирует клинические проявления болезни и вызывает гибель эритроцитарных форм малярийных плазмодиев. При рвоте хлорохина гидрохлорид следует вводить внутримышечно; при шоке — путем медленного внутривенного вливания. Прием препарата внутрь следует возобновить как можно быстрее. Хотя побочные явления встречаются редко, хлорохин может вызывать тошноту, боли в эпигастрии, агранулоцитоз, а также нейротоксические изменения, включая непроизвольные движения и судороги. Примерно у 50% больных негроидной расы при приеме хлорохина отмечается зуд.
Таблица 154-1. Лечение больных малярией
| Объект лечения | Препарат | Доза |
| Больные с хлорохин-устойчивой тропической малярией | Хинина сульфат' или хинина дигидро-хлорид А2 | 650 г внутрь 3 раза в сутки в течение 10—14 дней 600 мг в 300 мл физиологического раствора внутривенно в течение 1 ч; повторить через 6—8 ч, максимальная доза 1800 мг в сутки3 |
| плюс хлоридин | 25 мг внутрь 2 раза в сутки в течение 3 дней | |
| плюс сульфадиазин или хинин, как указано выше, плюс тетра | 500 мг внутрь 2 раза в сутки в течение 5 дней 250 мг 4 раза в сутки в течение 7 дней | |
| циклин или хинин, как указано выше, плюс клиндамицин | 900 мг 3 раза в сутки в течение 3 дней | |
| Больные с четырехдневной малярией и хлорохинчувствитель-ной тропической малярией | Хлорохина фосфат или хлорохина гидрохлорид2 | 1 г (600 мг основания) внутрь, затем 500 мг через 6 ч, |
| затем 500 г в сутки в течение | ||
| 2 дней | ||
| 250 мг (200 мг основания) внутримышечно или внутривенно через каждые 6 ч; внутривенно препарат вводится, как указано выше для хинина ди-гидрохлорида; максимальная доза 900 мг в сутки | ||
| Больные с трехдневной малярией и малярией овале | Так же как и в случае четырехдневной малярии, плюс прима-хина фосфат | 26,3 мг (15 мг основания) внутрь ежедневно в течение 14 дней |
Если хинина в данный момент нет, вводите хлорохин, затем, получив хинин, продолжайте лечение последним.
2 Используется, когда больной не может принимать препараты внутрь. Переходите к назначению препарата внутрь как можно скорее. Если в данный момент не имеется хинина дигидрохлорида, можно использовать хинидина глюконат в дозе 800 мг, назначаемой, как это описано для хинина (см. текст).
3 В Юго-Восточной Азии начальная доза должна быть 20 мг/кг.
В случае трансфузионной (прививной) малярии или заражения больного в районах распространения лекарственно-устойчивой тропической малярии лечение следует проводить хинином в комбинации с одним или несколькими дополнительными противомалярийными препаратами. При неосложненной малярии внутрь назначается хинина сульфат в дозе 650 мг 3 раза в сутки в течение 3 дней. Если больной не в состоянии принимать препарат внутрь (в случае рвоты, при шоке или развитии одного из злокачественных синдромов), целесообразно медленное внутривенное введение раствора хинина дигидрохлорида, разведенного физиологическим раствором или раствором глюкозы. В США этот препарат не поступает в коммерческую продажу и его следует получать в Центре по борьбе с болезнями. Вполне удовлетворительным заменителем хинина дигидрохлорида оказался другой алкалоид хинина, широкодоступный противоаритмический препарат хинидина глюконат. Хотя кардиотоксическое действие хинидина примерно в 4 раза превосходит аналогичный эффект хинина, его можно использовать для лечения больных малярией при тщательном электрокардиографическом контроле. Если не удалось сразу приобрести хинина дигидрохлорид, лечение следует начать с введения хинидина. В критических ситуациях начальная доза того или другого лекарственного средства должна быть удвоена, чтобы обеспечить паразитоцидный уровень препарата в крови как можно скорее. Следует быстрее переходить к приему препарата внутрь. Поскольку только 20% препарата выводится почками, при острой почечной недостаточности не требуется немедленного снижения его дозы. Однако, с 4-го дня, в том случае, если развивается почечная недостаточность или состояние больного,не улучшается, поддерживающую дозу препарата следует уменьшить на 1/3. При тяжелой форме болезни даже в отсутствие явной почечной недостаточности концентрация как хинина, так и хинидина достаточно высока ввиду уменьшения общего объема циркулирующей крови. Когда концентрация хинина в плазме превышает 5 мкг/мл, у больного появляются шум в ушах, тошнота, дисфония и иногда глухота. У беременных женщин хинин вызывает гиперинсулинемию с последующей гипогликемией. К числу редких побочных явлений относятся тромбоцитопеническая пурпура, нейромышечная блокада и лихорадка. Появление гемолитической анемии с положительной реакцией Кумбса требует немедленной отмены препарата. Эффективным препаратом для лечения больных с хлорохинустойчивой формой тропической малярии является мефлохин (Mefloquine), однако разрешения на его применение в США пока не имеется.
Чаще всего в качестве дополнительного средства используется хлоридин в сочетании с одним из сульфаниламидных препаратов. Хлоридин назначают внутрь в дозе 25 мг 2 раза в сутки в течение 3 дней. Являясь антагонистом фолиевой кислоты, он может вызвать мегалобластическую анемию; поэтому беременным женщинам и лицам с недостаточным питанием следует при этом назначать препараты фолиевой кислоты. Одновременно с хлоридином и хинином следует назначать сульфизоксазол (Sulfisoxazole) или сульфазин сначала в дозе 2 г однократно, а затем по 0,5 г через каждые б ч в течение 5 дней. Хорошие результаты были получены при применении целого ряда других комбинаций антифолатов с сульфониламидами, а также хинина. Особенно эффективным является фансидар (Fansidar), комбинация 25 мг хлоридина и 500 мг сульфадоксина. Применяются также сочетания тетрациклина (в дозе 250 мг 4 раза в сутки в течение 7 дней) или клиндамицина (в дозе 900 мг 3 раза в сутки в течение 3 дней) с хинином.
Больные с неосложненной малярией, способные принимать лекарственные средства внутрь, не нуждаются в обязательной госпитализации, за исключением беременных женщин, лиц с недостаточным питанием или детей. Все больные в течение 1 мес после лечения должны находиться под наблюдением врача на случай развития рецидива болезни. При обнаружении в периферической крови бесполых форм малярийных плазмодиев следует провести повторный курс лечения хлоридином и сульфаниламидным препаратом. Обнаружение в крови только гамонтов не является показанием к повторному лечению.
Радикальное лечение. Р. vivax и Р. ovale персистируют в печени на экзоэритроцитарной стадии, поэтому они не подвержены влиянию препаратов, применяемых для лечения острых приступов. Оставаясь жизнеспособными, экзоэритроцитарные стадии через определенное время образуют дочерние стадии, способные проникнуть в эритроциты. В большинстве случаев радикальное излечение достигается путем применения примахина внутрь в дозе 15 мг в сутки в течение 14 дней. Если после лечения примахином снова возникает рецидив, необходимо повторить прием препарата в удвоенных дозах. Альтернативная схема лечения заключается в назначении 45 мг примахина в комбинации с 300 мг хлорохина 1 раз в неделю в течение 8 нед. Примахин может вызвать окислительный гемолиз у больных с дефицитом глюкозо-6-фосфатдегидрогеназы; вероятность этого уменьшится, если препарат назначать 1 раз в неделю.
Лечение больных с тяжелыми формами тропической малярии. Больные с тяжелой формой тропической малярии требуют интенсивного наблюдения и ухода. Сразу же после подтверждения диагноза и определения уровня паразитемии следует взвесить больного и приступить к внутривенному введению хинина, хинидина или хлорохина. Необходимо сделать посев крови, определить ее группу, гематокрит, а также концентрацию глюкозы, мочевины и креатинина. Если у больного отмечаются признаки гипервентиляции, цианоза или послеприступной аспирационной пневмонии, следует получить результаты анализа газового состава крови. Если больной находится в бессознательном состоянии, необходимо сделать люмбальную пункцию с целью исключения бактериального менингита.
Больных в состоянии комы следует уложить на бок, поскольку у них часто бывают рвота и судороги. Некоторые специалисты назначают больным с тяжелой малярией в профилактических целях противосудорожные препараты, хотя целесообразность введения последних в таких случаях не определена. Ректальная температура не должна превышать 38,5°С; для этого больного обтирают влажной губкой, используют вентилятор и применяют жаропонижающие препараты неаспиринового ряда. Следует обеспечить почасовой контроль за мочевыделением. Если появляются какие-либо сомнения о степени гидратации больного или состоянии водного баланса, вводят центральный венозный катетер и осторожно проводят регидратацию больного для поддержания мочевыделения. Поскольку слишком энергичное введение жидкостей может осложниться отеком легких, центральное венозное давление следует поддерживать на уровне не выше 5 см вод. ст. Больным, у которых олигурия переходит в острую почечную недостаточность, показано проведение перитонеального диализа или гемодиализа (гемо-диализ предпочтительнее, поскольку имеются данные о том, что эффективность перитонеального диализа при тропической малярии невысока), кроме того, выполненный в условиях сельских больниц диализ часто осложняется перитонитом. Показания для диализа аналогичны другим гиперкатаболическим инфекциям, осложненным развитием почечной недостаточности. В случае острой легочной недостаточности больных следует лечить, как и при СОНДВ; при необходимости рекомендуется внутривенное введение диуретических препаратов. Переливание крови показано при снижении показателя гематокрита ниже 20%; предпочтительно вводить свежую цельную кровь. В ряде случаев обменное переливание крови резко увеличивает клиническое состояние больных с тяжелой тропической малярией и гиперпаразитемией. Тяжело протекающая малярия сопровождается желудочно-кишечными кровотечениями, однако частота последних уменьшилась с тех пор, как отказались от использования гепарина и кортикостероидов. Хотя тромбоцитопения — явление достаточно частое, клинически выраженный синдром диссеминированного внутрисосудистого свертывания встречается редко (менее чем у 5% больных с церебральной малярией). Дексаметазон, маннитол, мочевина и гепарин неэффективны при лечении церебральной малярии или отрицательно влияют на состояние больного, поэтому использовать указанные препараты не следует.
Эффективность лечения оценивают по изменению клинического состояния больного (например, по восстановлению сознания при церебральной малярии), снижению температуры тела, исчезновению паразитемии. Определение уровня паразитемии следует проводить два раза в сутки вплоть до ее исчезновения. при рецидиве лихорадки исследование крови на наличие малярийных плазмодиев повторяют. Если состояние больного не улучшается или внезапно ухудшается на фоне проводимого лечения, нельзя исключить возможность гипогликемии или бактериемии. Коррекция гипогликемии затруднена, она склонна к рецидивированию, особенно при наличии вызванной хинином гиперинсулинемии.
Профилактика. Общие принципы. В таких регионах мира, где ликвидация малярии в настоящее время невозможна (например в Африке), рекомендуются использование инсектицидов остаточного действия и проведение химиопрофилактики среди беременных женщин и детей. Возможность ликвидации малярии в будущем зависит от внедрения новых технологий. До недавнего времени разработка практичной и эффективной вакцины тормозилась отсутствием подходящих систем для культивирования возбудителя малярии in vitro, трудностями определения стадий малярийных плазмодиев, вызывающих развитие протективного иммунитета, а также ввиду наличия больших антигенных различий между видами, штаммами и даже стадиями жизненного цикла возбудителя. Разработка способа непрерывного культивирования Р. falciparum в эритроцитах и применение методов с использованием моноклональных антител и рекомбинантной ДНК для характеристики антигенов малярийных паразитов позволили определить последовательность аминокислот в коротких цепях в полипептидном поверхностном слое всех типов спорозоитов Р. falciparum, способных вызывать продукцию протективных антител. В настоящее время эти пептиды синтезируют искусственным путем, соединяют с молекулой-носителем и получают, таким образом, спорозоитную вакцину, полевые испытания которой предполагается провести в ближайшем будущем. Работы по созданию мерозоитной и гамонтной вакцины продолжаются.
Личная профилактика. При посещении малярийных районов следует стараться избегать укусов комаров, особенно в периоды активного кровососания (обычно рано утром или вечером), экранировать дома, использовать прикроватные пологи, применять репелленты и содержащие пиретрум аэрозоли против насекомых, а также носить соответствующую одежду. Наряду с этим, следует проводить химиопрофилактику, как это описана ниже.
Химиопрофилактика (табл. 154-2). Хотя невозможно предупредить заражение малярией с помощью химиотерапевтических препаратов, использование соответствующих лекарственных средств позволяет подавить клинические проявления болезни в период проживания человека в эндемичных районах. Благодаря своей эффективности и безопасности хлорохин остается препаратом выбора для лиц, посещающих районы распространения болезни. Описаны случаи ретинопатии у лиц, принимавших этот препарат в профилактических дозах в течение более 5—20 лет. Однако это осложнение достаточно редкое, и для лиц, планирующих кратковременное пребывание в эндемичных районах, этой опасностью можно пренебречь. Прием хлорохина рекомендуют начинать за 1—2 нед до отъезда в эндемичные районы. Это позволяет проверить наличие ранних побочных явлений и обеспечить создание терапевтической концентрации препарата в крови. Если этого сделать не удалось, профилактическую дозу препарата следует удвоить в первые недели пребывания в эндемичном районе. Но в связи с тем, что защита не является полной, малярию всегда следует иметь в виду при дифференциальной диагностике любого лихорадочного заболевания, возникающего во время пребывания в данной местности. После отъезда из эндемичного района хлорохин следует принимать еще в течение 6 нед. Это позволит ликвидировать инфекцию, вызванную Р. malariae и чувствительными штаммами Р. falciparum. Однако против печеночных форм Р. ovale и Р. vivax хлорохин неэффективен, и последние могут вызвать рецидивы клинических проявлений болезни спустя недели или месяцы после окончания приема препаратов. Рецидивы можно предотвратить, если в течение 2 последних недель хлорохин применять в сочетании с примахином.
Хлорохин неэффективен для лечения больных с хлорохинустойчивой тропической малярией (ХУТМ). Тем не менее он показан лицам, выезжающим в районы распространения ХУТМ, поскольку в этих местах распространены также и другие формы малярии, возбудители которых чувствительны к данному препарату. Для подавления хлорохинустойчивой тропической малярии может быть использовано сочетанное применение хлорохина и таблеток фансидара, комбинации 25 мг хлоридина и 500 мг сульфадоксина. Фансидар противопоказан беременным женщинам, лицам с повышенной чувствительностью к сульфаниламидным препаратам и детям младше 2 мес. При длительном применении хлоридина возможно развитие лейкопении и мегалобластической анемии. Среди американских туристов с профилактической целью, принимавших хлоридин и сульфадоксин, зарегистрировано несколько случаев тяжелых кожных реакций (многоформная эритема, синдром Стивенса—Джонсона и токсический эпидермальный некролиз). Учитывая возможность развития неблагоприятных реакций при профилактическом приеме фансидара, его следует рекомендовать только лицам, выезжающим в районы интенсивной передачи хлорохинустойчивой тропической малярии. К числу таких районов относятся страны Африки, Океании (Папуа, Новая Гвинея, Соломоновы острова и Вануату) и определенные сельские районы Китая, Юго-Восточной Азии и Южной Америки. Если длительность поездки в эти районы не превышает 3 нед, путешественнику рекомендуется иметь в индивидуальной аптечке терапевтическую дозу фансидара для предварительного лечения любого возникающего в период поездки лихорадочного заболевания в случае отсутствия возможности быстрого обращения за квалифицированной медицинской помощью. Упомянутые выше тяжелые кожные реакции, наблюдавшиеся при профилактическом приеме фансидара, не отмечались в случае однократного приема препарата с лечебной целью
Таблица 154-2. Химиопрофилактика малярии
| Цель | Препарат | Доза |
| Подавление клинических проявлений малярии в районах, где отсутствуют хлорохин-устойчивые штаммы | Хлорохина фосфат | 500 мг (300 мг основания) внутрь 1 раз в неделю, затем в течение 6 нед после выезда из эндемичной местности 520 мг (400 мг основания) внутрь 1 раз в неделю, затем в течение 6 нед после выезда из эндемичной местности |
| Подавление клинических проявлений малярии в районах, где имеются хлорохинустойчи-вые штаммы | То же, что указано выше, плюс хлоридин-сульфадоксин' (фан-сидар, Hoffman—La Roche) или мофлохин | 25 мг хлорид ина и 500 мг сульфадоксина внутрь 1 раз в неделю, затем в течение 6 нед после выезда из эндемичной местности 250 мг внутрь 1 раз в неделю, затем в течение 6 нед после выезда из эндемичной местности |
| Предупреждение рецидивов трехдневной малярии и малярии овале | Примахина фосфат2 | 26,3 мг (15 мг основания) внутрь ежедневно в течение 14 дней или 79 мг (45 мг основания) в течение 8 нед; назначают в течение последних 2 нед супрессивной терапии или сразу же после ее окончания |
' Назначают только в районах интенсивной передачи малярии, как это указано в тексте.
2 Рекомендуется только для путешественников, не имеющих дефицита Г-6-ФД и подвергающихся высокому риску заражения.
Из ряда имеющихся препаратов наиболее обнадеживающей альтернативой фансидару при профилактике хлорохинустойчивой тропической малярии является мефлохин, метанолхинолиновое соединение, упомянутое выше в разделе «Лечение». Будучи безопасным и эффективным, мефлохин нашел широкое применение в Юго-Восточной Азии, где часто встречаются случаи фансидарустойчивой тропической малярии. В США разрешения на его применение пока не имеется, и в других странах мира доступность его все еще невелика. Амодиахин, близкое к хлорохину соединение 4-аминохинолина, может обеспечить несколько большую по сравнению с хлорохином защиту от африканских штаммов возбудителей хлорохинустойчивой тропической малярии. В США в продаже этого препарата нет, однако он широко доступен в странах Африки.
Переливание крови. В США продолжают регистрироваться случаи трансфузионной малярии, как правило, вызываемой Р. malariae и Р. falciparum. Соблюдение рекомендаций Американской ассоциации банков крови позволит предупредить большую часть таких случаев.
Дата добавления: 2016-03-05; просмотров: 881;
