Особенности метаболизма эритроцитов при консервировании
Консервирование крови – это комплекс воздействий на кровь, направленных на сохранение ее в течение длительного срока вне организма в полноценном состоянии, пригодном для трансфузии.
Во время хранения крови в эритроцитах продолжают происходить процессы обмена веществ, в результате которых уменьшаются запасы глюкозы, накапливается молочная кислота, снижается рН и ферментативная активность ферментов, уменьшается концентрации АТФ, 2,3-ДФГ, повышается сродство гемоглобина к кислороду, нарушается работа антиокисдантной и трансмембранных систем.
спонтанный гемолиз эритроцитов.
В результате происходящих изменений эритроцит получает повреждения, которые могут быть обратимыми и необратимыми.
Признаками обратимых повреждений эритроцитов являются:
- уменьшение содержания АТФ до 50%;
- резкое снижение концентрации 2,3-ДФГ;
- выход ионов калия из клеток.
Признаками необратимых повреждений эритроцитов являются:
- снижение концентрации АТФ на 80 – 90%;
- проникновение внутрь клетки Са2+;
- истощение запасов липидов в клеточной мембране;
- сфероцитогенез;
- гемолиз. Он начинается с середины третьей недели хранения эритроцитов.
Кровь, в которой присутствуют признаки необратимых повреждений эритроцитов, непригодна для трансфузии.
Для увеличения времени хранения крови ее консервируют:
Для этого используются два метода:
· консервирование при положительных температурах. При таких температурах можно хранить консервированную цельную кровь, эритроцитную массу, нативную плазму; Различные компоненты крови имеют разные сроки хранения. Так, например, эритроциты могут сохранять свои свойства в течение нескольких недель, а лейкоциты и тромбоциты – только несколько дней. Срок хранения нативной плазмы ограничен тремя днями.
· консервирование при отрицательных температурах. Используют умеренно низкие температуры от –40 до–60°С (эритроциты хранятся несколько месяцев) и ультранизкие температуры, около –196°С (эритроциты хранятся 10 и более лет).
Для увеличения продолжительности сроков хранения крови вне организма используют специальные растворы – гемоконсерванты.
· Обязательный компонент всех гемоконсервантов – стабилизаторы (например, лимонная кислота или цитрат натрия). Они связывают ионы кальция, что способствует подавлению гемостаза.
· Глюкоза, она обеспечивает питание эритроцита.
· Для предотвращения осмотического гемолиза используют вещества поддерживающие равновесие осмотического давления (маннит, сорбит, сахароза, лактоза).
· Для поддержания уровня 2,3-ДФГ добавляют пируват, аденин, инозин.
а) инозин + Фн ® рибозо-1ф + гипоксантин (нуклеозид фосфилаза).
б) рибозо-1ф ® рибозо-5ф (фосфорибомутаза).
в) рибозо-5ф ® ® ® 3-ФГА (ПФШ)
г) 3-ФГА ® 1,3-ДФГ ® 2,3-ДФГ.
Добавление пирувата за счёт ЛДГ увеличивает образование НАД+ из НАДН2, что в свою очередь ведёт к большей интенсивности реакции образования 1,3-ДФГ, а следовательно и 2,3-ДФГ.
При заготовке крови обычно используются следующие гемоконсерванты:
- глюгицир (ЦОЛИПК-7б) (цитрат натрия – 2г, глюкоза – 3г, бидистиллированная вода до 100 мл).
- Л-6 (цитрат натрия кислый – 2,5 г, глюкоза – 3 г, сульфацил натрия – 0,5 г, трипафлавин нейтральный– 0,025 г, бидистиллированная вода до 100 мл).
- ЦОЛИПК-12а для экстракорпорального кровообращения.
ГЕМ
Строение гема
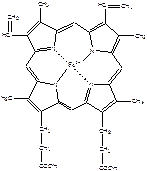
| Гем - это порфирин, в центре которого находиться Fe2+. Fe2+ включается в молекулу порфирина с помощью 2 ковалентных и 2 координационных связей. В зависимости от заместителей различают несколько типов порфиринов: протопорфирины, этиопорфирины, мезопорфирины и копропорфирины. В основе порфиринов находится порфин, который представляет собой конденсированную систему из 4 пирролов, соединенных между собой метиленовыми мостиками (-СН=). Молекула гема имеет плоское строение. При окислении железа, гем превращается в гематин (Fe3+). |
Использование гема
Гем является простатической группой многих белков: гемоглобина, миоглобина, цитохромов митохондриальной ЦПЭ, цитохрома Р450, ферментов каталазы, пероксидазы, цитохромоксидазы, триптофанпироллазы. Наибольшее количество гема содержат эритроциты, заполненные гемоглобином, мышечные клетки, имеющие миоглобин, и клетки печени, содержащие цитохром Р450.
Гемы разных белков могут содержать разные типы порфиринов. В геме гемоглобина находится протопорфирин IX, в состав цитохромоксидазы входит формилпорфирин и т.д.
Синтез гема
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном мозге гем необходим для синтеза гемоглобина, в гепатоцитах — для образования цитохрома Р450.
1). Аминолевулинатсинтаза, пиридоксальзависимый фермент, в матриксе митохондрий катализирует образование 5-аминолевулиновой кислоты из глицина и суцинил-КоА. Суцинил-КоА поступает из ЦТК. Реакцию ингибирует и репрессирует гем. В ретикулоцитах реакцию индуцирует железо (через железосвязывающий белок и железочувствительный элемент (IRE)). Дефицит пиридоксальфосфата снижает активность аминолевулинатсинтазы. Стероидные гормоны и некоторые лекарства (барбитураты, диклофенак, сульфаниламиды), исектициды, канцерогенные вещества являются индукторами. Это связано с возрастанием потребления гема системой цитохрома Р450, который участвует в метаболизме этих соединений в печени.
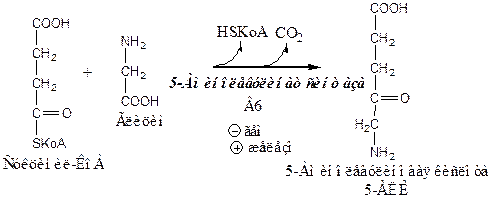
Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму.
2). Аминолевулинатдегидратаза Zn-содержащий фермент, в цитоплазме соединяет 2 молекулы 5-аминолевулиновой кислоты в молекулу порфобилиногена. Реакцию ингибирует гем.
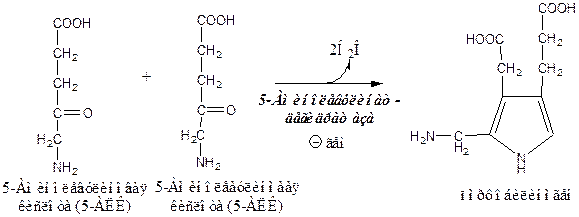
3). Порфобилиногендезаминаза в цитоплазме превращает 4 молекулы порфобилиногена в молекулу гидроксиметилбилана.
4). Уропорфириноген III косинтаза в цитоплазме превращает гидроксиметилбилан в молекулу уропорфобилиногена III. Гидроксиметилбилан может также неферментативно превращаться в уропорфириноген I, который декарбоксилируется в копропорфириноген I.
5). Уропорфириногендекарбоксилаза в цитоплазме декарбоксилирует уропорфобилиноген III до копропорфириногена III. Из цитоплазмы копропорфириноген III опять поступает в митохондрии.
6). Копропорфриноген III оксидаза превращает в митохондриях копропорфириноген III в протопорфириноген IX.
7. Протопорфириногеноксидаза превращает в митохондриях протопорфириноген IX в протопорфирин IX.
8). Феррохелатаза в митохондриях встраивает железо в молекулу протопорфирина IX с образованием гема. Источником железа для синтеза гема служит ферритин.
Дата добавления: 2016-02-13; просмотров: 1095;
