Электрохимия. Законы Фарадея.
Электрохимия — это раздел физической химии, в котором изучают физико-химические свойства ионных систем, а также процессы и явления на границах раздела фаз с участием заряженных частиц.
Проводники электрического тока делятся на электронные (проводники первого рода) и ионные (проводники второго рода).
Проводники первого рода - металлы в твердом и расплавленном состоянии. В них электрический ток осуществляется движением электронов электронного газа. При этом прохождение электрического тока в проводниках первого рода не сопровождается химическими изменениями их материала.
Проводники второго рода — некоторые растворы солей, кислот и оснований, а также некоторые вещества, главным образом соли, в расплавленном состоянии. Электрический ток в них осуществляется движением ионов (как положительных, так и отрицательных).
Электролиты — это химические соединения, которые в растворе (полностью или частично) диссоциируют на ионы. Диссоциация приводит к разъединению, отрыву ионов от молекулы или кристалла в результате взаимодействия ионов с молекулами растворителя.
Молекулы растворителей, обладающих хорошей диссоциирующей способностью, являются сильно полярными, и, следовательно, такие растворители имеют высокую диэлектрическую проницаемость.
Под действием электрических полей, создаваемых ионами электролита, полярные молекулы растворителя притягиваются ионами, ориентируются около них и в свою очередь, притягивая ионы к себе, ослабляют связь между ионами.
Подобным же образом они действуют и на ионы, составляющие решетку, например, ионного кристалла. Число ионов каждого знака определяется стехиометрическими коэффициентами в формуле электролита при соблюдении закона электронейтральности — сумма положительных зарядов равна сумме отрицательных. Таким образом, несмотря на наличие ионов, раствор электролита остается электронейтральным.
Электростатическое взаимодействие иона электролита с молекулами растворителя — сольватация — приводит к образованию вокруг иона молекулярного комплекса — сольвата. Совокупность молекул растворителя, окружающих ион, представляет собой сольватную оболочку. Сольватацию в водных растворах называют гидратацией.
Различают сильные и слабые электролиты.
Сильные электролиты диссоциируют в растворе почти полностью. В водных растворах сильными электролитами являются многие минеральные кислоты (HN03, НС1, НС104 и др.), основания (щелочи), большинство солей.
Слабые электролиты диссоциируют в растворе только частично. К слабым электролитам в водных растворах относятся почти все органические кислоты и основания.
Сильные и слабые электролиты являются двумя различными состояниями химических соединений (электролитов) в зависимости от природы растворителя. В одном растворителе данный электролит может быть сильным электролитом, в другом — слабым.
Процесс диссоциации слабых электролитов является обратимым, поскольку ионы противоположного знака, встречаясь в растворе, могут вновь соединяться в молекулы.
Рассмотрим простейший случай слабого сильно разбавленного бинарного одно-одновалентного электролита, диссоциирующего по схеме
МА <=> М++ А-
Важные характеристики электролита:
— степень диссоциации α — доля продиссоциировавших молекул из числа первоначально взятых
— константа диссоциации Kd, которую, для данного случая можно представить (используя закон действующих масс — при постоянной температуре скорость данной реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени, в простейших случаях равной коэффициенту перед формулой данного вещества в уравнении реакции) в виде
Например, 
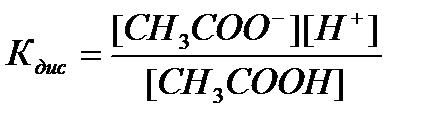
Если 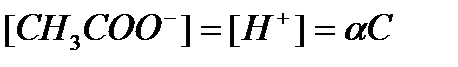
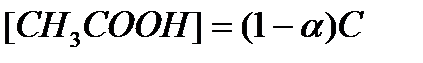 , то
, то 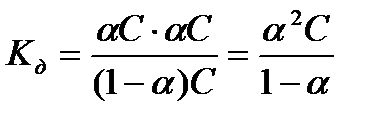 , при малых значениях a<0,03, (1-a) » 1, следовательно
, при малых значениях a<0,03, (1-a) » 1, следовательно 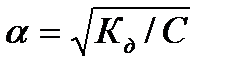 - это математическое выражение закона разбавления Оствальда, который звучит следующим образом:
- это математическое выражение закона разбавления Оствальда, который звучит следующим образом:
Степень диссоциации слабого электролита в растворе тем выше, чем более разбавлен раствор, т.е. в бесконечно разбавленном растворе степень диссоциации любого электролита равна 1.
Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах, состоящих из:
1)проводников второго рода (/) —электролитов,
2) проводников первого рода (//), (///), находящихся в контакте с электролитом.
3) проводников (IV) — внешняя цепь — обеспечивающих прохождение тока между проводниками (7/)и {III). На границе раздела двух фаз ( / - // и I - III) происходит перенос электрического заряда — протекает электрохимическая реакция.
Анодом называется электрод, на котором происходит реакция окисления (Oxidation)
Катодом называется электрод, на котором происходит реакция восстановления (Reduction). Соответственно, в электрохимии реакции восстановления принято называть катодными, окисления — анодными.
В химическом источнике электрического тока — гальваническом элементе — энергия химического процесса переходит в электрическую.
Соотношение между количеством электричества и массами прореагировавших веществ в электрохимических реакциях на электродах выражается законами Фарадея.
1-й закон Фарадея. Масса вещества т, претерпевшего химическое превращение под действием электрического тока, пропорциональна количеству протекшего электричества q
т = k3q
где кэ — электрохимический эквивалент (г/Кл) — масса прореагировавшего вещества при протекании 1 кулона электричества.
2-й закон Фарадея. При прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакция, пропорциональны их молярным массам эквивалентов (Мэкв):
тх : т2 : тъ = Мэкв ] : Мэкв 2 : Мэкв 3
Следствие. Для электрохимического превращения 1 моль-экв любого вещества требуется одинаковое количество электричества F = eNA - 96485 Кл/моль-экв
(или 26,8 А ч/моль-экв), называемое постоянной Фарадея.
Уравнение, объединяющее оба закона Фарадея:
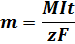
где М — молярная масса вещества, 1 — сила тока, t — время процесса, z — число электронов, участвующих в электрохимической реакции.
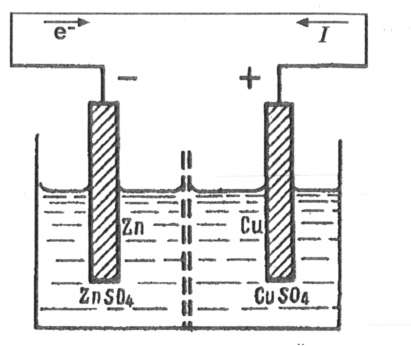 Рассмотрим превращение химической энергии в электрическую на примере гальванического элемента Даниэля-Якоби.
Рассмотрим превращение химической энергии в электрическую на примере гальванического элемента Даниэля-Якоби.
При схематической записи электрохимических систем используют следующие обозначения:
1. граница между электродом и раствором обозначается вертикальной сплошной чертой
2. граница между электролитами обозначается двумя вертикальными линиями.
Элемент Даниэля-Якоби состоит из цинкового и медного электродов, опущенных соответственно в растворы сульфатов цинка и меди, разделенных пористой диафрагмой во избежание их перемешивания.
Правило записи схем электрохимических элементов.
ЭДС электрохимического элемента считается положительной, если электрохимическая цепь записана так, что катионы при работе элемента проходят в растворе от левого электрода к правому и в том же направлении движутся электроны во внешней цепи. Схема элемента Даниэля-Якоби
(-)Zn|ZnSQ4 ||CuS04 |Си(+)
При погружении металла в раствор ионы металла под действием сильно полярных молекул воды начинают переходить в слой воды, прилегающий к поверхности металла.
При этом приповерхностный слой металла обедняется катионами, приобретает избыточный отрицательный заряд, и между ним и катионами в растворе возникает разность потенциалов, препятствующая дальнейшему выходу катионов из металла — устанавливается равновесие.
В элементе Даниэля-Якоби цинковый электрод, обладающий более высокой способностью выделять ионы в раствор, чем медь, приобретает более высокий отрицательный заряд. Если соединить электроды металлическим проводником, то избыточные электроны будут переходить с цинковой пластинки на медную.
Это нарушает равновесие на поверхности каждого из электродов. На цинковом электроде (отрицательном полюсе элемента — аноде) продолжается окисление цинка Zn = Zn2+ + 2е~.
На медном электроде (положительном полюсе элемента — катоде) продолжается восстановление меди Си2+ + 2е~ = Си .
Таким образом реализуется самопроизвольно протекающий процесс, в котором цинковая пластинка растворяется, на медной выделяется металлическая медь, а во внешней цепи протекает электрический ток. Суммарная окислительно-восстановительная реакция:
Cu2+ + Zn —> Си + Zn2+
С другой стороны, если при протекании химической реакции на каждом электроде выделяется или растворяется z моль-эквивалентов вещества (согласно закону Фарадея, во внешней цепи протекает zF Кл электричества), то максимальная работа, которую совершает гальванический элемент по перенесению заряда zF между электродами с разностью потенциалов Е равна zFE.
Электродвижущей силой (ЭДС) элемента Е называется разность потенциалов между полюсами обратимого электрохимического элемента.
Очень часто необходимо рассчитать потенциал в нестандартных условиях в этом случае используют уравнение Нернста, которое описывает зависимость потенциала от концентрации вещества и температуры.
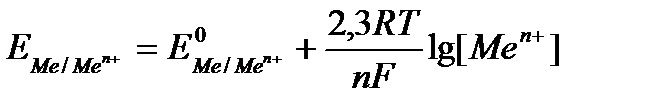 ,
,
где R – газовая постоянная,
F – число Фарадея (96 500 Кл/моль),
Т- абсолютная температура,
n – число электронов участвующих в процессе.
При температуре 298 К данное уравнение принимает следующий вид:
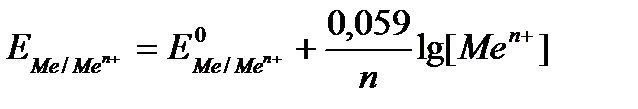 .
.
где Е — условный стандартный электродный потенциал по водородной шкале.
Для определения равновесного электродного потенциала по водородной шкале составляют элемент из этого электрода и стандартного водородного электрода. Который представляет собой платиновую нить, погруженную в
электролит, вдоль которой пропускается газообразный водород, H+|H2,Pt) с
активностью водородных ионов в растворе равной единице и давлением водорода равном 1 атм. Его потенциал при любой температуре условно принят равным нулю.
При этом: стандартный водородный электрод располагают слева.
Например, для определения потенциала цинкового электрода составляют электрохимическую цепь
Pt,H2|H+||Zn2+|Zn
Электродная реакция записывается как реакция восстановления, т.е.
присоединения электронов: в данном примере на водородном (левом)
электроде 2H++2e~=H2, на цинковом (правом) электроде Zn2++2е~ =Zn. Общая реакция записывается как разность между реакциями на правом и левом элементах
Н2 + Zn2+ = 2Н+ + Zn
Стандартный электродный потенциал считается положительным, если электрод заряжен более положительно, чем стандартный водородный электрод. В этом случае электрический ток будет течь внутри элемента слева направо и ЭДС элемента будет положительной.
Стандартный электродный потенциал считается отрицательным, если электрод заряжен более отрицательно, чем стандартный водородный электрод. В этом случае электрический ток будет течь внутри элемента справа налево и ЭДС элемента будет отрицательной.
В рассматриваемом примере Н2 + Zn2+ = 2Н+ + Zn ток в элементе будет течь от цинкового электрода к водородному (справа налево) и ЭДС элемента так же, как и равный ей потенциал цинка, будет иметь отрицательный знак.
Стандартные электродные потенциалы, определенные по водородной шкале при 25 С (298 К) обычно располагают в ряд. Например
| Электрод | Li+|Li | Zn2+|Zn | H+|H2,Pt | Cu2+|Cu | F+|F2,Pt |
| Е°, В | -3,04 | -0,763 | 0,00 | +0,337 | +2,87 |
| Стандартный потенциал, расположенный правее в электрохимическом ряду, является более электроположительным по сравнению с потенциалом, расположенным левее. |
| <== предыдущая лекция | | | следующая лекция ==> |
| Суставной синдром в практике ВОП. Остеопороз. Нарушение функции суставов | | | Стрелочные переводы |
Дата добавления: 2015-12-08; просмотров: 4233;
