Теплоемкость идеальных газов
Теплоемкостью тела в каком-либо процессе изменения его состояния называется количество подведённой (или отведённой) теплоты, необходимое для повышения (или понижения) его температуры на один градус.
В термодинамике газов различают
массовую теплоемкость с, кДж/(кг·град),
объемную теплоемкость с/ , кДж/(м3×град),
мольную теплоемкость 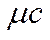 , кДж/(кмоль×град).
, кДж/(кмоль×град).
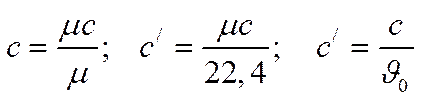 ,
,
где 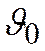 – удельный объем при нормальных условиях.
– удельный объем при нормальных условиях.
Теплота является функцией процесса:
для элементарного термодинамического процесса 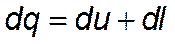 . Как было сказано выше, внутренняя энергия обладает полным дифференциалом, а работа изменения объёма – нет. Значит, сумма
. Как было сказано выше, внутренняя энергия обладает полным дифференциалом, а работа изменения объёма – нет. Значит, сумма 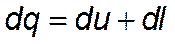 не обладает свойствами полного дифференциала.
не обладает свойствами полного дифференциала.
Поэтому понятие теплоемкости имеет смысл лишь в том случае, когда задан характер процесса, в котором газу сообщается теплота.
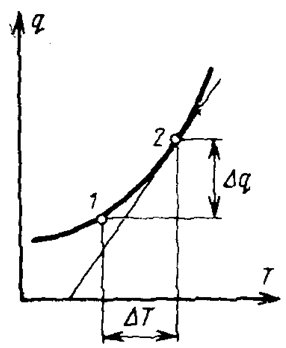
Связь между теплотой процесса и температурой газа
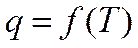 ,
,
Очевидно, что на различных участках такой кривой одному и тому же изменению температуры соответствуют различные количества подведенной теплоты, поэтому и значения теплоемкости на этих участках будут различными.
Вводят понятие о теплоемкости, средней в заданном интервале температур от Т1 до Т2 (т.е. на участке 1–2).
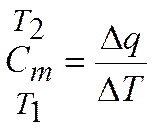
Значение истинной теплоемкости при заданной температуре:
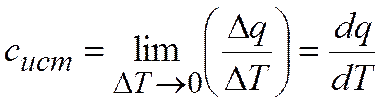
Истинная теплоемкость математически выражается как первая производная теплоты по температуре (при условии, что задан характер процесса).
В термодинамике особо важную роль играют теплоемкость при постоянном объеме
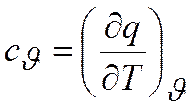
и теплоемкость при постоянном давлении
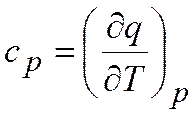
Связь между ними легко устанавливается из первого закона термодинамики
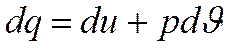 или
или 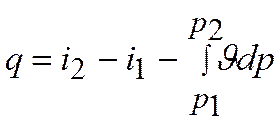
Если теплота подводится при постоянном объеме, то 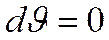 , а следовательно,
, а следовательно,
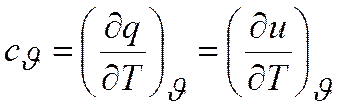
Если теплота подводится при постоянном давлении, то
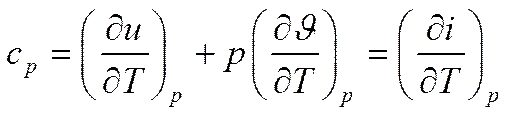
В идеальном газе силы взаимодействия между молекулами отсутствуют, а объём, который они занимают, также равен нулю, т.е. внутренняя энергия u состоит только из кинетической энергии движения молекул 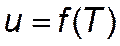 и, значит, не зависит ни от объема, ни от давления:
и, значит, не зависит ни от объема, ни от давления:
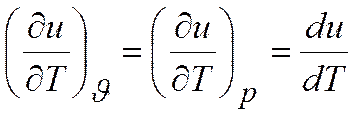 ,
,
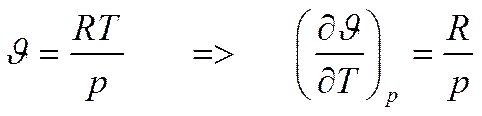
Окончательно 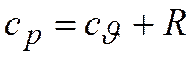
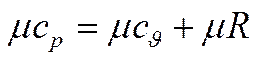
Дата добавления: 2016-02-09; просмотров: 360;
