Диффузионные процессы
Диффузией называется процесс самопроизвольного распространения вещества в какой-либо газообразной, жидкой или твёрдой среде. Явления такого типа, связанные с переносом масс, обуславливаются, главным образом, тепловым движением молекул и атомов.
В газообразном и жидком веществах перемена мест атомов и молекул происходит сравнительно легко вследствие того, что связи между этими частицами ослаблены или полностью нарушены. В твердых кристаллических телах положения атомов фиксированы в узлах кристаллической решетки, и перемещения отдельных атомов вещества происходит менее интенсивно, чем в жидкости или газе.
Для развития диффузии в металле нужно, чтобы диффундирующее вещество образовывало с ним твёрдый раствор. Атомы самого металла также перемещаются и меняются местами при тепловом движении, этот процесс называется самодиффузией.
Чаще всего диффузия протекает в направлении снижения концентрации вещества, но в некоторых условиях может идти и в сторону ее повышения. В первом случае происходит равномерное распределение вещества по объёму растворителя, во втором случае - разделение компонентов.
В твёрдых металлах возможны три пути диффузии атомов в решетке растворителя:
- за счёт простого обмена местами соседних атомов;
- вследствие проникновения атомов в пространство между узлами кристаллической решетки;
- путём перемещения вакансий, в результате которого происходит и перемещение атомов.
Диффузия преимущественно осуществляется по третьему пути.
Скорость диффузии определяется количеством вещества, диффундирующего через единицу площади поверхности раздела фаз за единицу времени. Согласно первому закону Фика:
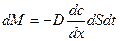 (49)
(49)
количество вещества dM, продиффундировавшего за время dt через элемент поверхности dS пропорционально градиенту концентрации 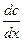 .
.
Закон Фика справедлив для малых концентраций и диффундирующего вещества, далеких от концентрации насыщения.
Знак « - » в уравнении показывает, что диффузия протекает в направлении убывания концентрации (направление градиента концентрации не совпадает с направлением диффузии).
Коэффициент пропорциональности D [см2/с] называется коэффициентом диффузии. Коэффициент диффузии – количество вещества, диффундирующего через единицу площади за единицу времени при перепаде концентрации, равной единице. Зависит он от природы сплава, размера зерна и особенно сильно от температуры. Температурная зависимость коэффициента диффузии подчиняется экспоненциальному закону:
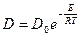 , (50)
, (50)
где Do – предэкспоненциальный множитель, величина которого определяется типом кристаллической решетки; E – энергия активации процесса, ккал/г-ат.; R - газовая постоянная; T – температура, К.
Энергия активации диффузии характеризует энергию связи атомов в кристаллической решётке. Чем выше значение Е, тем больше величина энергии, необходимой для перехода атома из первого равновесного положения кристаллической решетки в другое такое же равновесное положение. Требуемый для перехода избыток энергии приобретается атомом от его соседей благодаря непрерывному обмену кинетической энергией с соседними атомами.
Горение топлива
Процессы горения используются для получения тепла и высоких температур. Для этого реакции горения должны сопровождаться значительным выделением тепла и протекать с высокой скоростью.
В качестве топлива обычно используют горючие вещества органического происхождения: кокс, мазут, горючие газы. Химическая сторона горения топлива сводится главным образом к многочисленным реакциям взаимодействия углерода, водорода и соединений, содержащих эти элементы, с кислородом.
Для металлургических процессов наиболее важны следующие реакции:
1. Полное горение углерода: С(т)+О2(г) = СО2(г); тепловой эффект реакции ΔН1= -393707Дж;
2. Неполное горение углерода: 2С(т) + О2(г) = 2СО(г) ; ΔН2 = -283190Дж;
3. Горение окиси углерода: 2СО(г) + О2(г) =2СО2(г); ΔН3= -110610Дж;
4. Взаимодействие углекислого газа с углеродом: С(т) +СО2(г) = 2СО(г);
5. Горение водорода: 2Н2(г) + О2(г) = 2Н2О(г);
6. Взаимодействие водяного пара с углеродом: Н2О(г) + С(т) = СО(г) + Н2(г);
7. Взаимодействие водяного пара с углеродом с образованием двуокиси углерода: 2Н2О(г) +С(т) = СО2(г) + 2Н2(г);
8. Реакция водяного пара: СО2(г) + Н2(г) = СО(г) + Н2О(г).
Реакции 3, 5, 8 – гомогенные, остальные – гетерогенные.
Горение углерода
Взаимодействие углерода с кислородом описывается реакциями 1-4. Это взаимодействие имеет место во многих металлургических системах. Рассмотрим его на примере процесса ваграночной плавки. В условиях слоевого взаимодействия углерода (кокса) с кислородом и продуктами горения происходит сложный гетерогенный процесс, конечные результаты которого оказывают влияние на особенности химических реакций, физического переноса газообразных компонентов к поверхности твердого топлива и отвода продуктов реакций.
Реакции 1, 2 и 3 могут протекать в окислительных условиях, то есть когда в реагирующем пространстве имеется достаточное количество свободного кислорода. Реакция 4 протекает в восстановительных условиях, то есть когда имеется избыток углерода (или дефицит кислорода). Максимальное выделение теплоты характерно для реакции 1. Причем ΔН1= ΔН2+ ΔН3 (закон Гесса).
Термодинамический анализ рассматриваемых реакций позволяет оценить условия их преимущественного развития и прочность получаемых при этом химических соединений.
Рассмотрим температурную зависимость изменения изобарно-изотермических потенциалов реакций, представленную на рис. 6.

Рис. 6. Температурная зависимость 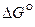 реакций горения углерода
реакций горения углерода
Отрицательные значения 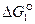 являются показателем того, что реакция 1 самопроизвольно развивается в стандартных условиях. Большое числовое значение
являются показателем того, что реакция 1 самопроизвольно развивается в стандартных условиях. Большое числовое значение 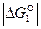 характеризует значительную степень сродства углерода и кислорода и прочность образовавшегося углекислого газа СО2. Реакция 1 завершается с большой степенью полноты, является необратимой, а полученный углекислый газ не может разлагаться с выделение углерода.
характеризует значительную степень сродства углерода и кислорода и прочность образовавшегося углекислого газа СО2. Реакция 1 завершается с большой степенью полноты, является необратимой, а полученный углекислый газ не может разлагаться с выделение углерода.
Числовые значения 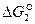 показывают, что при высоких температурах проявляется значительное химическое родство углерода и кислорода с образованием СО. Реакция необратима. С повышением температуры прочность СО возрастает. При понижении температуры прочность СО понижается и возрастает сродство СО и кислорода по реакции 3.
показывают, что при высоких температурах проявляется значительное химическое родство углерода и кислорода с образованием СО. Реакция необратима. С повышением температуры прочность СО возрастает. При понижении температуры прочность СО понижается и возрастает сродство СО и кислорода по реакции 3.
Положение прямой температурной зависимости 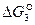 в области пониженных числовых значений сродства СО и О2 и уменьшение ее с повышением температуры является свидетельством неполного завершения реакции и ее обратимости. Следовательно, диссоциация углекислого газа СО2 возможна только с образованием СО и О2, но невозможна с выделением свободного углерода.
в области пониженных числовых значений сродства СО и О2 и уменьшение ее с повышением температуры является свидетельством неполного завершения реакции и ее обратимости. Следовательно, диссоциация углекислого газа СО2 возможна только с образованием СО и О2, но невозможна с выделением свободного углерода.
При диссоциации СО образуется углерод и углекислый газ и невозможно выделение свободного кислорода.
Константы равновесия реакций 1 и 2:
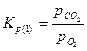
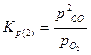
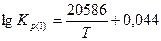
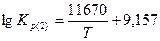
В реальных условиях в той или иной степени получают развитие все четыре реакции. При этом следует учитывать не только химические, но и физические особенности процесса. В газовой фазе, кроме диффузионного взаимодействия, имеет место конвективный перенос О2, СО и СО2. Кокс, используемый в большинстве случаев в качестве топлива в вагранках, характеризуется определенной степенью пористости. Газовые реагенты проникают в макро- и микропоры, в которых развиваются те или иные химические реакции, идет так называемое внутреннее реагирование. В сложной цепи химических реакций имеются звенья, определяющие кинетику всего процесса. В условиях слоевого горения топлива таким звеном является суммарный расход кислорода на химические реакции и диффузионный перенос его в реакционную зону.
Если преимущественным является процесс окисления углерода внутри топлива в порах и трещинах, то узким звеном процесса является перенос кислорода во внутрь кусков топлива, где преимущественно происходит окисление углерода до СО. Если в газовой фазе имеется избыток кислорода, то образовавшийся СО может догореть до СО2. При этом задерживается доставка кислорода во внутренние слои топлива и создается его дефицит.
При слоевом горении твёрдого углеродсодержащего топлива различают две переходящие друг в друга зоны: окислительную и восстановительную.
Окислительная или кислородная зона начинается от границы первичного взаимодействия с дутьем и продолжается вглубь до того места, где в газовой фазе исчезает свободный кислород. В этой зоне образуются СО2 и СО. С понижением в газовой фазе концентрации кислорода в ней увеличивается количество СО. В связи с отсутствием в газовой фазе кислорода в слое топлива развивается эндотермическая реакция 4 взаимодействия СО2 и С.
Максимальной концентрации СО2 в слое топлива соответствует и наибольшая температура. По мере увеличения в газовой фазе СО температура в слое топлива понижается.
Установлено, что длина кислородной зоны мало зависит от скорости дутья. Концентрация СО в газовой фазе в значительной степени зависит от температурного режима.
Изменение состава газовой фазы сопровождается изменением её свойств. При увеличении в ней концентрации СО её восстановительные свойства увеличиваются, а окислительные уменьшаются.
В зависимости от соотношения в газовой фазе СО2 и СО, она в одном случае может быть источником углерода и науглероживать металлы и сплавы, в других - поглощать углерод и обезуглероживать металлы и сплавы.
Горение водорода и оксида углерода СО протекают по цепному механизму. Особенность горения СО состоит в том, что её скорость существенно зависит от содержания в системе водорода и водяных паров. Реакция водяного газа в прямом и обратном направлениях идёт в присутствии твердых катализаторов.
Дата добавления: 2016-02-04; просмотров: 4173;
