Активность. Коэффициент активности
Фугитивностью данного газа или компонента газовой смеси называется величина, которая совершенно также связывается с различными термодинамическими свойствами данного газа, как с этими свойствами в идеальных газах связывается давление газа. Обозначается буквой f, соответственно константа равновесия Kf.
Активностью данного газа или компонента газовой смеси называется такая величина, которая при подстановке её вместо концентрации в соотношения, выражающие связь различных термодинамических свойств идеального газа с его концентрацией, делает эти соотношения применимыми к данному газу или компоненту газовой смеси. Активность характеризует как бы активную концентрацию газа. Обозначается буквой а, константа равновесия Kа. Активность используется при изучении не только газообразного, но и других состояний веществ. Для газов активность и фугитивность равны аi=fi.
Активность характеризует степень связанности молекул компонента. При образовании данным компонентом в растворе каких-либо соединений его активность становится меньше и, наоборот, активность возрастает при уменьшении степени ассоциации компонентов.
Для реальных растворов и газов константа равновесия
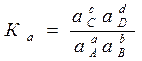 . (37)
. (37)
Величина активности вещества выражается с помощью коэффициента активности:
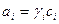 , (38)
, (38)
где 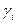 - коэффициент активности,
- коэффициент активности, 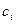 - концентрация вещества.
- концентрация вещества.
Для вещества в идеальном растворе 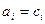 .
.
Образование реальных растворов, в отличие от идеальных, может происходить с выделением или поглощением теплоты:
γi>1 - для эндотермических процессов;
γi<1 - для экзотермических процессов.
Значение γi для реальных растворов определяется опытным путем.
Коэффициент активности характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от свойств его в соответствующем идеальном растворе.
Чем полнее может протекать реакция в прямом направлении, тем больше численное значение константы равновесия.
При неизменных внешних условиях константа равновесия любой химической реакции имеет постоянное числовое значение. Это означает, что при таком соотношении между парциальными давлениями или концентрациями скорости прямой и обратной реакции равны между собой, а изобарный потенциал является наименьшим.
Таким образом, имея равновесную химическую систему и вводя в неё дополнительные количества одного из веществ, участвующих в реакции, можно таким путем увеличить относительное содержание другого из веществ или наоборот уменьшить концентрацию третьего вещества.
Дата добавления: 2016-02-04; просмотров: 2473;
