Механизм действия пептидных гормонов и адреналина
Рецепторы к этим гормонам находятся на наружной поверхности клеточной мембраны, и гормон внутрь клетки не проникает. Действие гормона в клетку передается при помощи так называемых вторых посредников, к которым относятся циклический АМФ (цАМФ), циклический ГМФ (цГМФ), кальций, инозитолтрифосфат, диацилглицерол (диглицерид) и некоторые другие. В системе передачи регуляторного сигнала они называются вторыми посредниками, потому что первым посредником является сам гормон.
Каждый из вторых посредников активирует специфическую протеинкиназу. Протеинкиназы фосфорилируют ферменты, и это изменяет активность ферментов.
Главным вторым посредником является цАМФ (рис. 1). Большинство гормонов действует через него. Другие посредники, действуя через свои протеинкиназы, могут изменять содержание цАМФ в клетке путём повышения или снижения активности ферментов, синтезирующих или разрушающих цАМФ.
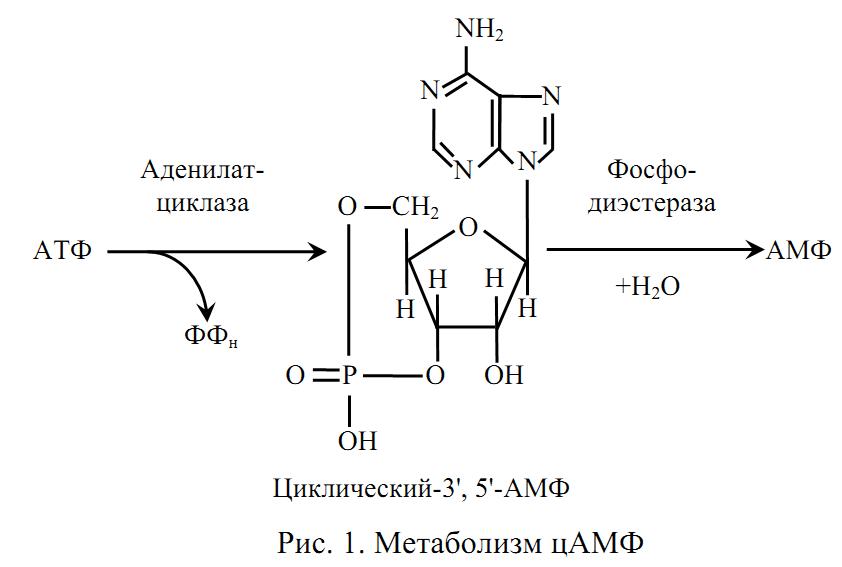
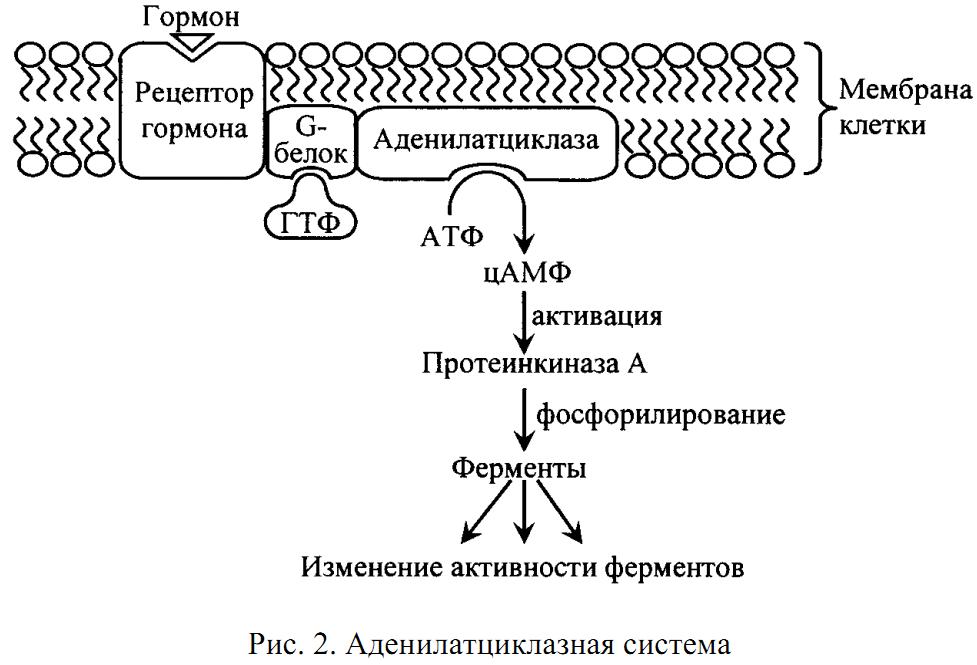
Циклический АМФ образуется в клетке из АТФ под действием аденилатциклазной системы (рис. 2). В состав аденилатциклазной системы входят: рецептор, G‑белок и фермент аденилатциклаза. G‑ белок называется так потому, что он способен связывать гуаниловые нуклеотиды (ГТФ или ГДФ). Существует 2 разновидности G‑белка: Gs – стимулирует аденилатциклазу и увеличивает образование цАМФ и Gi – ингибирует аденилатциклазу и уменьшает образование цАМФ.
Белки Gs и Gi оказывают своё активирующее или ингибирующее действие только когда находятся в! активном состоянии. G‑белок активен, когда он связан с ГТФ, и наоборот, связанный с ГДФ, G‑ белок неактивен.
Пока гормон не действует на клетку, аденилатциклазная система неактивна; все её компоненты разобщены и с G‑белком связан ГДФ. Однако после связывания гормона с рецептором происходит последовательное изменение конформации всех компонентов аденилатциклазной системы, G‑белок обменивает ГДФ на ГТФ, переходит в активное состояние и активирует аденилатциклазу, которая из АТФ синтезирует цАМФ. Циклический АМФ, в свою очередь, активирует специфическую цАМФ‑зависимую протеинкиназу (протеинкиназу А), которая фосфорилирует внутриклеточные ферменты, в результате чего изменяется активность ферментов.
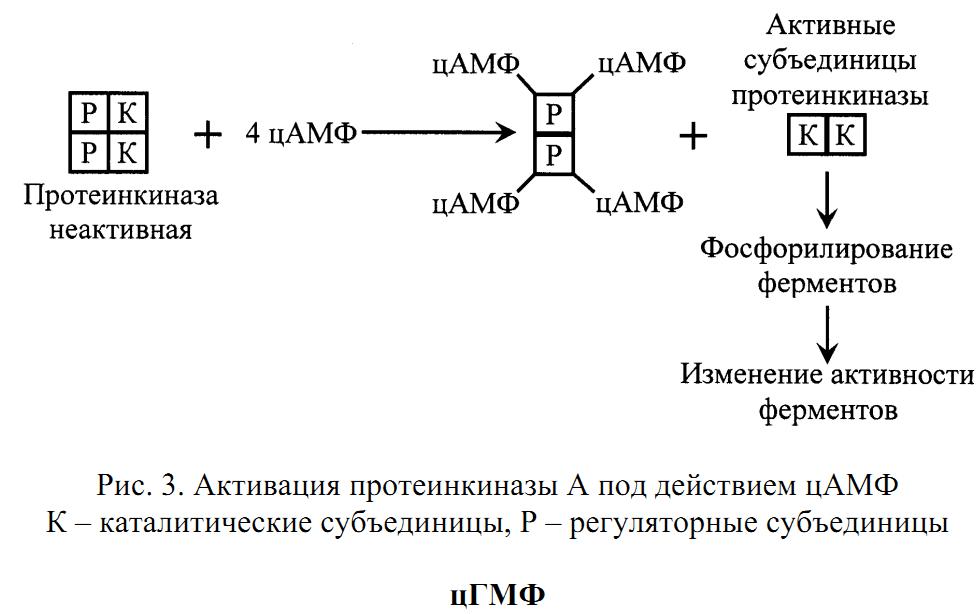
Протеинкиназа состоит из 4 субъединиц (тетрамер), две из которых являются регуляторными, а две – каталитическими (рис. 3. . В таком виде протеинкиназа неактивна. При связывании протеинкиназой 4 молекул цАМФ происходит отсоединение (диссоциация) каталитических субъединиц, которые фосфорилируют белки (ферменты), изменяя их активность.
Разрушается цАМФ фосфодиэстеразой.
Циклический ГМФ образуется из ГТФ под действием гуанилатциклазы по аналогии с синтезом цАМФ. Циклический ГМФ активирует специфическую цГМФ‑зависимую протеинкиназу или протеинкиназу G, которая фосфорилирует ферменты, что сопровождается изменением их активности. Разрушается цГМФ, как и цАМФ, фосфодиэстеразой.
Кальций
Концентрация Са2+ во внеклеточной жидкости в 10 000 раз больше, чем в цитоплазме. Такая концентрация кальция оказалась бы потенциально летальной для клетки. Клетка борется с избытком Са2+ в цитоплазме путём откачивания его наружу с помощью Са2+‑ АТФазы, расположенной в плазматической мембране.
Под действием гормонального сигнала концентрация Са2+ в клетке возрастает в 10 и более раз за счет притока Са2+ из внеклеточной жидкости, а также выхода Са2+ из ЭПР и митохондрий. В клетке Са2+ связывается с белком кальмодулином и активирует специфическую Са2+‑кальмодулин‑зависимую протеинкиназу. В ГЛ 2+ ответ на гормональный сигнал и повышение концентрации Са в клетке специфическая протеинкиназа катализирует фосфорилирование множества внутриклеточных ферментов, регулируя, тем самым, их активность.
Дата добавления: 2016-02-02; просмотров: 5065;
