Получение удобрений
Суперфосфат – эту смесь солей кальция получают обработкой фосфоритов или апатитов рассчитанным количеством технической серной кислоты.
Са3(РО4)2 + 2Н2SО4 = Са(Н2РО4)2 + 2СаSО4 (Р2О5 » 20%)
Полезная часть суперфосфата – растворимый в воде дигидрофосфат кальция, хорошо усваиваемый растениями. Сульфат кальция является балластом. Поэтому выгоднее получать двойной суперфосфат.
Для этого сначала получают фосфорную кислоту
Са3(РО4)2 + 3Н2SO4 = 3CaSO4↓ + 2H3PO4
а затем удобрения
Са3(РО4)2 + 4Н3PO4 = 3Ca(H2PO4)2- концентрированное фосфорное удобрение.
Кроме суперфосфата хорошим фосфорным удобрением кислых почв служит преципитат. Его получают нейтрализацией фосфорной кислоты известью.
Н3РО4 + Са(ОН)2 = СаНРО4↓ + 2Н2О
гидрофосфат кальция нерастворим в воде, но растворяется в почвенных кислотах.
Аммофос –комбинированное удобрение, включает азот и фосфор.
NH3 + H3PO4 = NH4H2PO4
2NH3 + H3PO4 = (NH4)2HPO4
Кислородсодержащие кислоты фосфора делят на 2 группы:
1) со связью Р-Н и 2) без нее.
Со связью Р-Н менее устойчивы (энергия Р-О > энергии связи Р-Н), поэтому легко окисляется кислородом.
Фосфорноватистая Н3Р+1О2 – одноосновная, не имеющая ангидрида (довольно сильная К = 8,5*10-2).
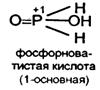
Соли – гипофосфиты – хорошо растворимы в Н2О.
Гипофосфиты и Н3РО2 – энергичные восстановители (особенно в кислой среде).
Ортофосфористая Н3+3 РО3 – Н2[HPO3] – двухосновная, образуется при взаимодействии Р4О6 с холодной Н2О. Это кристаллическое вещество, кислота средней силы К= 8·10-3.
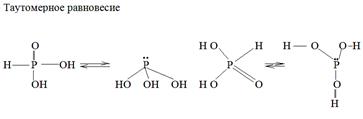
При нагревании Н3РО3 диспропорционирует.
4Н3РО3 ® 3Н3 РО4 + РН3
Пирофосфористая - Н4 Р2О5.
Фосфорноватая кислота Н4Р2О6 –четырехосновная, средней силы (К =6,1·10-3), ангидрид её не известен.
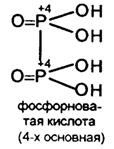
Известно соединение Р2О4, но оно при взаимодействии с Н2О дает Н3РО3 и Н3РО4, т.е. диспропорционирует подобно N2O4
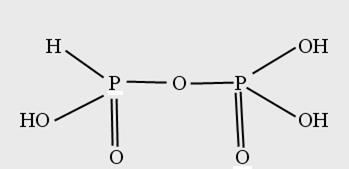
Фосфористофосфорная Н4Р2О6 - трехосновная тот же состав, что и фосфорноватая, но отличается строением.
Биогенная роль
Азотв живом веществе 3·10%, т.е. мы живем в азотной атмосфере, умеренно обогащенной кислородом и в очень малых количествах другими элементами.
Термин «азот» означает безжизненный. Это название он получил за свою инертность к реакциям с другими элементами. В то же время известно, что без азота трудно представить себе жизнь на земле и что азот и жизнь - понятия неотделимые.
В биосфере азот образуется при бактериальном брожении белковых веществ, а также в результате разложения азотсодержащих веществ, входящих в состав горных парод.
Характерно, что растения и животные потребляют не свободный, а связанный азот, находящийся в почве в форме азотнокислых и аммиачных солей.
Функции перевода свободного азота в связанный выполняют азотофиксирующие бактерии, которые, поглощая азот воздуха, используют его для синтеза белков и других органических соединений.
Азотные соединения, особенно нитраты, загрязняют биосферу, вредны для организма и могут быть причиной отравления человека. Азот в почве находится в форме недоступных растениям органических веществ, которые разлагаются бактериями на простые соединения NH3, СО2, Н2О, соли. Процесс выделения аммиака называют аммонизацией. Аммиак с кислотами почвы образуют соли, усвояемые растениями.
Атмосферный азот фиксируется клубеньковыми бактериями, живущими на корнях бобовых растений. Эти бактерии усваивают азот воздуха, создают из него азотные вещества, используемые растениями для синтеза белков.
Фосфор– принадлежит к относительно распространенным элементам земной коры. Кларк его 8·10-2%. Ферсман назвал его элементом жизни и мысли. В организме животных, растений и человека фосфора содержится от сотых-десятых до целых процентов. Наибольшее его количество концентрируется в костной ткани (у человека в костях содержится 5,05 %, в зубной эмали – 17 % фосфора). Относительно много фосфора в тканях мозга и мышцах. Фосфор в организмах обеспечивает энергетические процессы. При недостатке фосфора в организме (ниже 0,1 %) у животных развивается заболевания костей.
Мышьяк – в разных случаях и видах выступает как яд и как целительное средство. История дает немало случаев использования мышьяка в качестве яда для отравления противников. Симптомы мышьякового отравления –металлический вкус во рту, рвота, боли в животе: при сильном отравлении –судороги, паралич, смерть.
В то же время мышьяк ¾ важнейший компонент многих лекарств. В небольших количествах соли мышьяковой и мышьяковистой кислот улучшают питание животных, усиливают процессы ассимиляции и усвоения азота и фосфора.
На основе мышьяка страны НАТО изготавливают смертоносное оружие.
Ортоарсенаты используются в сельском хозяйстве как инсектициды.
Na2НАsO4 , Na3AsO4
CaHАsO4 , Са3(AsO4)2
ЛЕКЦИЯ 6
Тема: р - Элементы VI группы
Дата добавления: 2016-01-30; просмотров: 3283;
