ВЕЛИКИЙ ЗАКОН ПРИРОДЫ
К концу 60‑х годов прошлого века было известно уже 63 химические элемента.
Открытия новых элементов совершались случайно. Изучая те или иные вещества, химик обычно не подозревал, где и когда он может натолкнуться на новый вид атомов.
Так, химик Балар исследовал рассолы соляных промыслов Средиземного моря. Пропуская однажды через рассол газ хлор, он заметил, что цвет рассола изменился, стал бурым. Учёный заинтересовался этим явлением и ему удалось установить, что эту окраску сообщала рассолу неизвестная жидкость бурого цвета с резким неприятным запахом. Оказалось, что им был открыт новый химический элемент, названный бромом.
Столь же случайно открыты были иод, кадмий и другие химические элементы.
Так обстояло дело до 1869 года.
В марте месяце 1869 года на заседании Русского физико‑химического общества в Петербурге была зачитана работа молодого русского химика Д. И. Менделеева об открытой им зависимости свойств химических элементов от их атомного веса. Менделеев был в то время болен; его сообщение прочёл за него известный русский химик Н. А. Меншуткин. Д. И. Менделеев писал, что он создал естественную систему всех химических элементов, в которой они располагались друг за другом в порядке возрастания их атомных весов. В такой системе наблюдается замечательная закономерность: химические свойства элементов повторяются через определённые, правильные промежутки, повторяются периодически. Учёный так и назвал свою систему – периодической системой элементов.
Таким образом, Менделеев показал, что каждый химический элемент – это вид атомов, характеризующийся не только величиной атомного веса, но и местом, занимаемым в периодической таблице.

Великий русский химик Дмитрий Иванович Менделеев (родился в 1834 году, умер в 1907 году).
Менделеев не был первым учёным, который искал единство в разнообразии химических элементов. Мысль о закономерной связи между свойствами химических элементов возникла ещё в XVIII веке. Однако попытки химиков найти закономерность среди химических элементов до Менделеева были безуспешными.
Представьте себе ряд химических элементов, расположенных в порядке возрастания их атомных весов.
При первом взгляде на такой ряд не видно никакой последовательности в изменении свойств химических элементов. Ни один элемент не походит на своих соседей. Сходство, однако, имеется, но не у элементов, стоящих рядом, а у элементов, разделённых другими, несходными химическими элементами.
ОПЫТЪ СИСТЕМЫ ЭЛЕМЕНТОВЪ,
ОСНОВАННОЙ НА ИХЪ АТОМНОМЪ ВѢСѢ И ХИМИЧЕСКОМЪ СХОДСТВѢ,
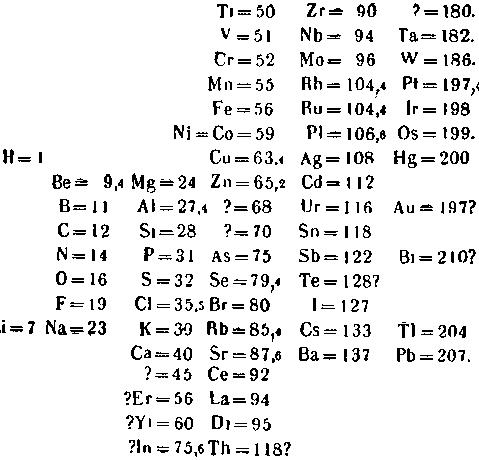
Д. Менделеев!» Рис. 1. Периодическая система химических элементов в том виде, в каком она была впервые опубликована (в 1869 году).
На рисунке 1 приведена периодическая система элементов в том виде, как она была впервые опубликована Д. И. Менделеевым. Вторым по порядку в этой таблице стоит элемент литий (Li). Это – лёгкий, так называемый щелочной металл; соединяясь с водой, он образует щёлочь. За ним следуют шесть элементов, свойства которых иные, чем у лития. Но седьмой элемент, натрий (Na), снова повторяет свойства лития; это – тоже щелочной металл. Ещё через шесть элементов, через период элементов, мы видим новый щелочной металл – калий (К).
Посмотрим, как повторяются свойства соседа лития – лёгкого металла бериллия (Be) – третьего по счёту химического элемента в таблице Менделеева. Оказывается, и здесь его свойства повторяются через тот же период – через шесть элементов находится химический элемент магний (Mg), тоже лёгкий металл, повторяющий в основных чертах свойства своего «родственника». Пропустите ещё шесть элементов, и вы увидите кальций (Са), напоминающий по своим свойствам бериллий и магний.
Таким же образом повторяются свойства бора (В) у элемента алюминия (Al), стоящего на седьмом после него месте, свойства фтора (F) – у хлора (Cl) и т. д.
Такая закономерность наблюдается, однако, не во всём ряду элементов. Начиная с калия, элементы с одинаковыми химическими свойствами располагаются уже не через шесть, а через шестнадцать мест друг от друга [1].
Подметив эти закономерности, Менделеев разделил весь ряд химических элементов на несколько частей – периодов – и затем расположил эти части одну под другой таким образом, что элементы со сходными свойствами поместились друг под другом, образуя вертикальные столбцы – группы сходных элементов:
литий – 7
бериллий – 9,4
бор – 11
углерод – 12
азот – 14
кислород – 16
фтор – 19
натрий – 23
магний – 24
алюминий – 27,4
кремний – 28
фосфор – 31
сера – 32
хлор – 35,5
и т. д. (цифры обозначают атомные веса элементов).
Свойства элементов в одном периоде изменяются также не случайно. И здесь имеется вполне определённая закономерность. Возьмём тот же период – от лития до фтора. Первым в нём стоит химически активный металл (литий); он легко вступает в соединения с другими веществами; за ним идёт металл, менее химически активный (бериллий); далее стоит элемент ещё менее активный, его металлические свойства выражены ещё слабее (бор). Затем мы видим уже переход от металлов к неметаллам (углерод, азот). Здесь химическая активность элементов идёт по восходящей линии: первый из элементов – азот – наиболее неактивный, следующий – кислород – уже значительно более активный металлоид (металлоид – значит неметалл) и последним стоит очень активный металлоид – фтор.
Чтобы яснее представить, как именно изменяются в периодической таблице свойства элементов по мере увеличения атомного веса, посмотрим, как изменяются некоторые их химические свойства.
Возьмём, например, такое важное химическое свойство, как валентность. Валентностью называется способность атома какого‑либо элемента соединяться с определённым числом атомов другого элемента. Наименьшей валентностью обладает атом водорода, поэтому его валентность принята за единицу.
Валентность других химических элементов выражается числом, показывающим, сколько атомов водорода может присоединять или замещать атом того или иного элемента. Если атом элемента присоединяет или замещает один атом водорода, его валентность также равна единице; другими словами, говорят, что данный химический элемент одновалентен; если атом элемента присоединяет или замещает два атома водорода, элемент двухвалентен, и т. д.
Однако не все элементы обладают постоянной валентностью.
Так, например, углерод в окиси углерода (СО) – двухвалентен, а в углекислом газе (СО2) он четырёхвалентен. Это зависит от условий, при которых образуется соединение. Здесь валентность углерода определяют по кислороду, так как кислород всегда двухвалентен. Если с одним атомом кислорода соединяется один же атом какого‑то другого элемента (как в случае СО), то, значит, этот элемент двухвалентен. Если же один атом элемента соединяется с двумя атомами кислорода (как в случае СО2), – валентность элемента равна четырём.
Кислород вступает в химические соединения с большинством химических элементов. Такие соединения носят название окислов. Изучая окислы, можно определить и валентность этих элементов, установить, как она изменяется в зависимости от положения элементов в периодической таблице.
Менделеев нашёл, что среди кислородных соединений можно выделить восемь основных групп. В соответствии с этим химические элементы можно разбить на группы, имеющие однотипные окислы. Так, литий, калий, натрий и некоторые другие образуют окислы, в которых с одним атомом кислорода соединяются два атома металла – Li2O, Na2O, К2O и т. д. Это – группа одновалентных элементов. Все они и входят как раз в первый вертикальный столбец периодической таблицы (см. табл, на стр. 20–21).
В другой группе элементы дают окислы, у которых на один атом кислорода приходится один атом металла, например CaO, ZnO. Эти элементы составляют второй столбец таблицы Все они имеют наивысшую валентность в кислородных соединениях, равную двум. В третий столбец входят трёхвалентные элементы и т. д.
В каждом периоде располагаются все восемь основных типов окислов Если мы рассмотрим вышеприведённые периоды – от лития до фтора и от натрия до хлора, то увидим, что наивысшая валентность в кислородных соединениях у этих элементов будет увеличиваться в периоде слева направо: 1, 2, 3, 4 и т. д, а затем в последней группе – инертных газов (см рис. 2) – она падает до нуля.
Такую же картину мы наблюдаем в других периодах. Таким образом, в то время как атомные веса в таблице беспрерывно растут, валентность элементов периодически колеблется.
Окислы различных элементов, имеющие отличные друг от друга химические свойства, размещаются в периодической таблице также закономерно. В первых двух группах располагаются окислы металлов, которые при химическом соединении с водой дают особую группу химических соединений, так называемые основания. Большинство оснований в воде нерастворимо. Но немногие, растворяясь, образуют щёлочи, например:
Na2O + H2O = 2NaOH
окисел натрия + вода = две молекулы едкого натра
К2O + Н2O = 2КОН
окисел калия + вода = две молекулы едкого кали
Щёлочи называются едкими потому, что они разрушают большое число органических веществ, например жиры, сахар и многое другое.
Окислы металлоидов, соединяясь с водой, образуют другие химические соединения – кислоты, которые обладают кислым вкусом и разъедают металлы. Все кислоты имеют в своём составе атомы водорода, например:
SO3 + Н2O = H2SO4
окисел серы + вода = серная кислота
CO2 + Н2O = H2CO3
окисел углерода + вода у + угольная кислота
К кислотным окислам относятся главным образом окислы IV–VIII групп периодической таблицы элементов.
Таким образом, в таблице Менделеева слева располагаются щелочные окислы, а справа – типичные кислотные. У серединных элементов наблюдается постепенное снижение щелочных и нарастание кислотных свойств. Так, у элементов III и IV групп слабо выражены как кислотные, так и основные свойства.
Периодическая система элементов Д. И. Менделеева, объединив в одно целое разрозненные до этого химические элементы, показала их естественную последовательность. До открытия Менделеева химические элементы казались ничем не связанными друг с другом, независимыми друг от друга. Периодический закон показал, что это не так. Все химические элементы взаимно обусловливают друг друга; именно поэтому они располагаются в периодической таблице в определённом естественном порядке.
Закон Менделеева показал, что химические элементы, т. е. основные вещества, из которых строятся все окружающие нас тела, едины по своей природе.
Вместе с тем периодическая система элементов позволила научно предсказывать существование в природе новых, ещё не известных химических элементов и их свойств! Слепым поискам неизвестных простых тел природы был положен конец.
Дата добавления: 2016-01-26; просмотров: 1175;
