Нарушения сердечного ритма и проводимости (с указанием формы). 20 страница
АВ-блокада III степени (полная) может развиться в первые часы и дни ИМ. В целом это нарушение предсердно-желудочкового проведения имеет неблагоприятный прогноз, хотя многое зависит от локализации нарушенного проведения и характера замещающего ритма.
При проксимальной АВ-блокаде III степени эктопический водитель ритма располагается обычно в АВ-соединении ниже места блокады. На ЭКГ при этом регистрируют полное разобщение предсердного и желудочкового ритмов, ЧСС превышает 40 ударов в мин, а желудочковые комплексы QRS не изменены (“узкие”). Такая блокада часто сочетается с заднедиафрагмальным (нижним) ИМ и высоким тонусом блуждающего нерва. В большинстве случаев она исчезает через несколько дней от начала заболевания, мало осложняя прогноз ИМ.
При дистальной (трифасцикулярной) форме АВ-блокады III степени нарушение проведения локализуется ниже АВ-соединения, и на ЭКГ фиксируется редкий (< 40 в мин) идиовентрикулярный ритм с широкими деформированными комплексами QRS. Дистальный тип блокады чаще развивается при обширном переднем ИМ с поражением МЖП и имеет очень неблагоприятный прогноз: летальность может достигать 80%, если не предпринимаются соответствующие лечебные мероприятия. Блокада способствует резкому снижению сердечного выброса и развитию отека легких и кардиогенного шока.
 Запомните
Во всех случаях внезапно возникшей АВ-блокады III степени у больных острым ИМ показана временная ЭКС. Запомните
Во всех случаях внезапно возникшей АВ-блокады III степени у больных острым ИМ показана временная ЭКС.
| ||
| 6.5.3. Аневризма левого желудочка | ||

| ||
Аневризма левого желудочка — это локальное ограниченное выбухание истонченного и не сокращающегося участка стенки ЛЖ, состоящего из некротизированной или рубцовой ткани. Аневризма развивается при обширных трансмуральных ИМ, преимущественно в области верхушки и передней стенки ЛЖ. Аневризма ПЖ встречается крайне редко.
Ограниченное выпячивание некротизированной стенки желудочка во время его систолы (дискинезия) наблюдается в остром периоде заболевания практически у всех больных ИМ с зубцом Q. Это так называемая динамическая аневризма ЛЖ, которая хорошо выявляется при эхокардиографическом исследовании или вентрикулографии, являясь одним из важнейших признаков трансмурального ИМ. Со временем в этой области происходит формирование полноценного плотного рубца, локальное систолическое выпячивание стенки желудочка (дискинезия) у большинства больных исчезает, и в этой зоне остаются лишь эхокардиографические признаки локальной акинезии (отсутствия движения стенки желудочка). Только в 15–20% случаев трансмурального ИМ аневризма сохраняется.
Основными факторами, способствующими образованию истинной аневризмы ЛЖ, являются:
- обширное трансмуральное поражение ЛЖ;
- сопутствующая АГ;
- повышение внутрижелудочкового давления любого генеза;
- чрезмерная физическая активность больного в острой и подострой стадиях ИМ;
- нарушения процесса консолидации (уплотнения) рубца.
Формирование аневризмы ЛЖ может иметь ряд неблагоприятных последствий:
1. Увеличение и деформация полости ЛЖ, согласно закону Лапласа (см. главу 1), сопровождаются ростом внутримиокардиального напряжения неповрежденных участков сердечной мышцы, увеличивая тем самым общую потребность миокарда в кислороде испособствуя возрастанию признаков коронарной недостаточности.
2. При аневризме еще больше усугубляются систолическая и диастолическая дисфункции ЛЖ, снижается сердечный выброс, возрастает КДД ЛЖ и, соответственно, давление наполнения желудочка. Это повышает риск возникновения застоя крови в малом круге кровообращения и других признаков сердечной недостаточности.
3. В большинстве случаев в области аневризмы формируется пристеночный тромб, что может приводить к развитию тромбоэмболических осложнений.
Наличие аневризмы способствует формированию повторного входа и патологической циркуляции волны возбуждения (macro-re-entry) с развитием жизнеопасных желудочковых нарушений ритма (пароксизмальной ЖТ и ФЖ).
В целом летальность больных трансмуральным ИМ, осложненным аневризмой ЛЖ, в 4–5 раз выше, чем больных без аневризмы.
Диагностика
Диагностика аневризмы ЛЖ основывается на выявлении нескольких клинических и инструментальных признаков.
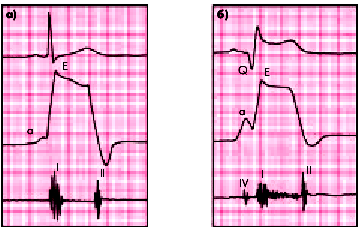
1. Обнаружение при пальпации сердца отчетливой локальной прекардиальной пульсациивIII–IV межреберье слева от грудины или появление ранее отсутствовавшей пульсации в области верхушечного толчка. В этом последнем случае (аневризма верхушки) часто пальпируется так называемый “двойной” верхушечный толчок, отражающий пассивное движение тонкой аневризматической стенки как во время систолы желудочка, так и в период систолы левого предсердия, что бывает хорошо видно на кривой верхушечной кардиограммы (апекскардиограммы), отражающей механическое движение верхушки сердца во время сердечного цикла (рис. 6.56). При аускультации сердца в этих случаях часто определяется пресистолический ритм галопа.
|
| Рис. 6.56. Кривая верхушечного толчка (апекскардиограмма) в норме (а) и при аневризме ЛЖ (б). В последнем случае наблюдается значительное увеличение предсердной волны «а» и появление IV дополнительного тона сердца. Сверху вниз: ЭКГ, апекскардиограмма, ФКГ |
2. Отсутствие типичной динамики ЭКГ в остром, подостром и постинфарктном периодах (“застывшая” ЭКГ). На ЭКГ выявляются признаки обширного трансмурального ИМ (патологический QS или Qr) с подъемом сегмента RS–Т, сохраняющимся более 2–3 недель от начала заболевания. Последний признак является наиболее надежным для диагностики аневризмы, свидетельствуя о наличии вокруг аневризмы обширной зоны повреждения тканей, вызванного постоянным механическим растяжением этих участков миокарда, возникающим при каждом сокращении сердца и выбухании стенки аневризмы (В.Н. Орлов, В.В. Мурашко и А.В. Струтынский и др.) (рис. 6.57).
| Рис. 6.57. Изменения ЭКГ при хронической аневризме левого желудочка. Объяснение в тексте | 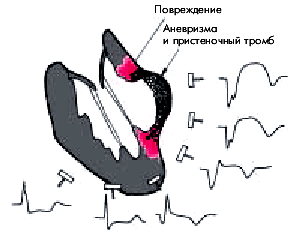
|
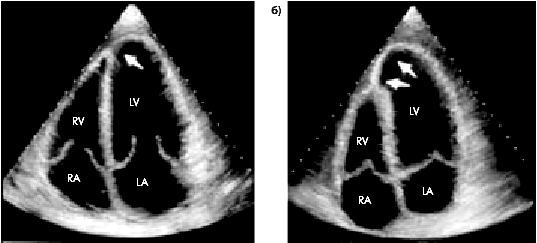
3. Эхокардиографические признаки локального ограниченного выбухания (дискинезии) и истончения стенки ЛЖ. При двухмерной ЭхоКГ у больных с трансмуральным ИМ динамическая аневризма ЛЖ проявляется дискинезией миокарда в виде локальной деформации (выбухания) внутреннего контура ЛЖ только во время систолы желудочка (рис. 6.58). В отличие от этого истинная аневризма ЛЖ проявляется стойкой систолической и диастолической деформацией внутреннего контура и наличием резко выраженной демаркационной линии на границе с интактными сегментами (рис. 6.59).
|
| Рис. 6.58. Двухмерная эхокардиограмма, зарегистрированная из апикального доступа в позиции четырехкамерного сердца у больного с трансмуральным ИМ и дискинезией верхушечного сегмента («динамическая аневризма» ЛЖ): а — диастола; б — систола. Дискинезия определяется только во время систолы желудочка |
| Рис. 6.59. Двухмерная эхокардиограмма, зарегистрированная в позиции четырехкамерного сердца у больного с истинной аневризмой МЖП и верхушки. В области аневризмы определяется истончение миокарда и стойкая систолическая и диастолическая деформация внутреннего контура | 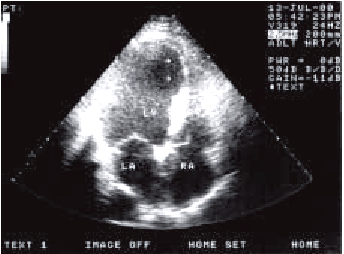
|
4. Рентгенологически можно обнаружить лишь обширные аневризмы, захватывающие верхушку и переднебоковую стенку ЛЖ.
В зависимости от периода ИМ, в котором обнаруживаются перечисленные признаки, различают острую и хроническую аневризму ЛЖ.
Лечение
Радикальное лечение аневризмы ЛЖ — хирургическое иссечение аневризматического мешка — показано в следующих случаях:
- при быстром прогрессировании сердечной недостаточности;
- при возникновении тяжелых повторных желудочковых нарушений ритма, рефрактерных к консервативной терапии;
- при повторных тромбоэмболиях, если доказано, что источником их является пристеночный тромб, располагающийся в области аневризмы.
| 6.5.4. Разрывы сердца |

|
Разрывы сердца относятся к ранним и чрезвычайно тяжелым осложнениям трансмурального ИМ. В большинстве случаев они происходят в течение первых 7 дней от начала заболевания. После 2-х недель инфаркта разрывы встречаются очень редко, поскольку к этому времени в области инфаркта начинает формироваться плотный рубец, препятствующий возникновению разрывов.
Различают внешние и внутренние разрывы сердца. При внешних разрывах кровь из полости ЛЖ быстро проникает в полость перикарда и развивается тампонада сердца, ведущая к его остановке. К внутренним разрывам относят разрывы МЖП и сосочковых мышц, что также приводит к тяжелым гемодинамическим нарушениям, резко ухудшающим прогноз ИМ.
Разрывы сердца осложняют течение ИМ с зубцом Q в 3–6% случаев и наблюдаются преимущественно у больных старше 50–60 лет, особенно при наличии сопутствующей АГ. Преобладают внешние разрывы ЛЖ. Разрывы ПЖ встречаются крайне редко.
Внешние разрывы
Разрыв свободной стенки ЛЖ клинически чаще всего протекает молниеносно. Кровь из полости ЛЖ изливается в полость перикарда и возникает гемотампонада, приводящая к остановке сердца и мгновенной смерти.
В других случаях быстро нарастающие клинические проявления разрыва сердца можно наблюдать в течение нескольких минут. У больного внезапно появляются интенсивные боли за грудиной, в области сердца, он теряет сознание. АД резко снижается или вовсе не определяется. Артериальный пульс становится нитевидным и исчезает совсем. С трудом прослушиваются тоны сердца. Появляется выраженный цианоз, быстро набухают шейные вены.
На ЭКГ-мониторе в течение короткого времени продолжает определяться синусовый или эктопический ритм. Сердце сокращается, но кровь в аорту практически не поступает, а попадает в полость перикарда. Такое несоответствие между продолжающейся электрической активностью сердца и отсутствием механической (насосной) функции получило название “электромеханическая диссоциация”. При развитии тампонады сердца она очень быстро переходит в асистолию желудочков.
В еще более редких случаях наблюдается подострый разрыв свободной стенки ЛЖ. Размеры такого надрыва стенки не столь велики, и он может даже частично тромбироваться. Поэтому кровь сравнительно медленно заполняет полость перикарда, и клиническая картина гемотампонады нарастает постепенно. Часто при таком варианте развития тампонады на первый план выступает болевой синдром, возникающий за несколько часов до развития тампонады и связанный с постепенно распространяющимся в толще миокарда надрывом стенки сердца и пропитыванием ее кровью (рис. 6.60).
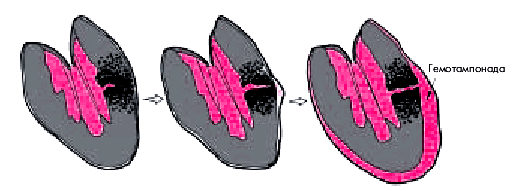
|
| Рис. 6.60. Подострый внешний разрыв миокарда и возникновение гемотампонады у больного с трансмуральным ИМ |
Интенсивная боль за грудиной, быстрое падение АД, вновь выявляемый подъем сегмента RS–Т в нескольких отведениях ЭКГ очень напоминают клинику рецидивирующего ИМ, осложненного кардиогенным шоком. В этих условиях по понятным причинам очень опасно применение антикоагулянтов, тромболитической терапии или инотропных средств. Поэтому столь важна своевременная диагностика развивающейся гемотампонады. Она может быть основана на данных экстренной ЭхоКГ (выявление жидкости в полости перикарда) и результатах гемодинамического мониторинга (быстрое повышение ЦВД при сниженных величинах ДЗЛА). В этих случаях иногда (к сожалению, крайне редко) удается направить больного на экстренную хирургиргическую операцию.
 Запомните
1. Внешние разрывы свободной стенки ЛЖ чаще возникают у больных с обширным ИМ, в возрасте старше 50–60 лет, страдающих АГ. 2. Внешние разрывы ЛЖ сопровождаются гемотампонадой, которая приводит к развитию электромеханической диссоциации, асистолии сердца и в большинстве случаев — к мгновенной смерти. 3. В очень редких случаях надрыв сердечной мышцы происходит постепенно, сопровождаясь интенсивной болью в сердце, падением АД и изменениями ЭКГ (подъем сегмента RS–Т). Запомните
1. Внешние разрывы свободной стенки ЛЖ чаще возникают у больных с обширным ИМ, в возрасте старше 50–60 лет, страдающих АГ. 2. Внешние разрывы ЛЖ сопровождаются гемотампонадой, которая приводит к развитию электромеханической диссоциации, асистолии сердца и в большинстве случаев — к мгновенной смерти. 3. В очень редких случаях надрыв сердечной мышцы происходит постепенно, сопровождаясь интенсивной болью в сердце, падением АД и изменениями ЭКГ (подъем сегмента RS–Т).
|
Разрыв межжелудочковой перегородки
Разрыв МЖП также возникает в течение первых 7 дней, редко — на протяжении 2-х недель от начала ИМ. При перфорации МЖП часть ударного объема ЛЖ выбрасывается в ПЖ, что приводит к значительным гемодинамическим нарушениям. Объемная перегрузка ПЖ может сопровождаться признаками быстро нарастающей правожелудочковой недостаточности. Кроме того, увеличение нагрузки на ЛЖ и снижение эффективного сердечного выброса в аорту сопровождаются усугублением признаков левожелудочковой недостаточности — отека легких и кардиогенного шока. Если не проводится хирургическая коррекция дефекта, более половины больных с разрывом МЖП умирают в течение ближайшей недели.
Клиническая картина разрыва МЖП складывается из нескольких признаков.
1.Внезапное ухудшение состояния больных:
- появление и быстрое нарастание признаков правожелудочковой недостаточности (цианоз, отеки, увеличение печени, набухание шейных вен, рост ЦВД и т.п.);
- усугубление признаков острой левожелудочковой недостаточности и отека легких (одышка и удушье, влажные хрипы в легких, рост ДЗЛА и т.п.);
- появление признаков кардиогенного шока (СИ < 1,8–2,0 л/мин/м2, систолическое АД < 90 мм рт. ст., признаки периферической гипоперфузии, олигурия и т.п.).
2. Внезапное появление над всей прекардиальной областью грубого пансистолического шума с максимумом в III–IV межреберье по левому краю грудины. Шум может проводиться в межлопаточное пространство и часто сопровождается признаками дилатации ПЖ (по данным перкуссии сердца, рентгенологического исследования и ЭхоКГ).
Внезапное появление прекардиального систолического дрожания, выявляемого при пальпации области сердца
Для подтверждения диагноза разрыва МЖП чаще всего используют два инструментальных метода исследования:
1. Катетеризация правых отделов сердца и легочной артерии с определением концентрации кислорода в правых камерах сердца (рис. 6.61). В норме содержание кислорода в ПП и ПЖ примерно одинаковое, тогда как при перфорации МЖП часть артериальной крови с богатым содержанием кислорода попадает в ПЖ. Поэтому РО2 в ПЖ оказывается существенно выше, чем в ПП, что подтверждает диагноз разрыва МЖП.
2. Метод допплер-ЭхоКГ, который позволяет обнаружить систолический поток крови из ЛЖ в ПЖ через дефект МЖП.
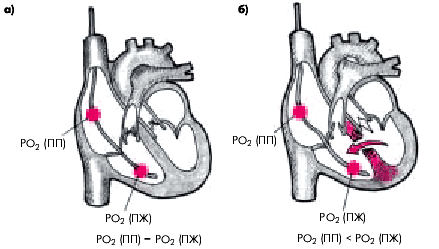
|
| Рис. 6.61. Парциальное давление кислорода в правом предсердии (РО 2 ПП) и правом желудочке (РО 2 ПЖ)в норме (а) и при разрыве МЖП (б) у больного с трансмуральным ИМ. Объяснение в тексте |
Лечение. При подтверждении диагноза разрыва МЖП больной должен быть направлен на экстренное хирургическое лечение, которое, несмотря на высокий риск летального исхода, является единственным радикальным способом лечения таких больных. Целесообразна предварительная стабилизация нарушенной гемодинамики с использованием внутриаортальной баллонной контрпульсации и внутривенного капельного введения растворов нитроглицерина и натрия нитропруссида (см. выше).
Разрыв сосочковых мышц
Разрыв сосочковых мышц осложняет течение трансмурального ИМ в 1% случаев. Чаще поражается задняя сосочковая мышца в связи с тем, что она кровоснабжается хуже, чем переднебоковая. В результате нарушается функция митрального клапана: во время систолы желудочка одна из створок провисает в полость ЛП (рис. 6.62). Несмыкание створок митрального клапана приводит к тяжелой относительной митральной недостаточности, острое возникновение которой способствует резкой объемной перегрузке ЛЖ и ЛП. В результате быстро развивается тяжелая левожелудочковая недостаточность и отек легких.
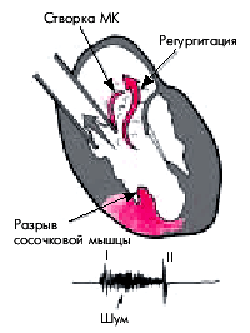
|
| Рис. 6.62. Разрыв сосочковой мышцы и образование пролапса створки митрального клапана (МК) с регургитацией крови в левое предсердие во время систолы желудочка |
Клиническими признаками разрыва сосочковой мышцы являются:
1. Внезапное развитие острой левожелудочковой недостаточности (отека легких).
2. Систолический шум на верхушке, проводящийся в левую подмышечную область. Шум нередко сопровождается дилатацией ЛП и ЛЖ (по данным перкуссии сердца и ЭхоКГ-исследования), а также ослаблением I тона на верхушке.
3. Главным признаком разрыва сосочковой мышцы является “молотящая” створка митрального клапана (по данным двухмерной ЭхоКГ), которая провисает во время систолы желудочков в полость ЛП (рис. 6.63).
|
| Рис. 6.63. Двухмерная эхокардиограмма, зарегистрированная у больного с инфарктом миокарда заднебазальных отделов ЛЖ и заднемедиальной сосочковой мышцы, разрывом папиллярной мышцы с формированием острой недостаточности митрального клапана |
4. При допплеровском режиме исследования обнаруживается эксцентрически расположенная струя регургитации, распространяющаяся в левое предсердие в сторону от пораженной створки. При разрыве передней папиллярной мышцы струя направлена в сторону заднебоковой стенки ЛП, а при разрыве задней сосочковой мышцы — в сторону МЖП.
Лечение разрывов сосочковой мышцы только хирургическое. Перед операцией необходима стабилизация гемодинамики и состояния больного, в связи с чем используют внутривенные инфузии нитроглицерина и натрия нитропруссида, а также внутриаортальную баллонную контрпульсацию. Если эти предварительные лечебные мероприятия имеют успех, целесообразно отложить проведение радикальной операции на 4–6 недель после инфаркта. Если же состояние больного не улучшается, следует настаивать на экстренном оперативном вмешательстве.
Следует помнить, что относительная недостаточность митрального клапана у больных ИМ может развиться не только в результате разрыва сосочковой мышцы, но и при их выраженной дисфункции, которая наблюдается у большинства больных ИМ с зубцом Q в течение 1-й недели заболевания. Дисфункция сосочковых мышц в этих случаях обусловлена их ишемией или вовлечением в некротический процесс. Определенное значение может иметь изменение размеров и формы ЛЖ, обусловленное его ремоделированием и снижением сократимости.
Клинически при этом также определяется систолический шум на верхушке, проводящийся в левую подмышечную область, и признаки систолической регургитации крови в ЛП при допплер-ЭхоКГ-исследовании. Однако в этих случаях отсутствует основной признак разрыва сосочковой мышцы — “молотящая” створка митрального клапана и выявляется лишь небольшое пролабирование одной из створок клапана. Дисфункция сосочковой мышцы, как правило, не требует специального лечения: в большинстве случаев на фоне интенсивной терапии ИМ признаки дисфункции уменьшаются.
| 6.5.5. Перикардит |

|
У большинства больных трансмуральным ИМ на 2–4-е сутки болезни может развиться реактивный асептический перикардит (pericarditis epistenocardica). Как правило, он носит характер фибринозного или серозно-фибринозного с небольшим объемом выпота в полость перикарда. В то же время клинически перикардит обнаруживают только у 5–10% больных ИМ, что связано со сложностью его диагностики.
Клиническая картина. Перикардит у больного ИМ с зубцом Q можно заподозрить по следующим клинико-инструментальным признакам.
1. Необъяснимое на первый взгляд возобновление болей в области сердца примерно на 2–4-й день болезни, которое нередко трактуют как рецидив ИМ, расширение зоны некроза и т.п. Однако боль в области сердца при перикардите отличается от типичного ангинозного приступа, характерного для ИМ, по нескольким характеристикам:
- она носит постоянный, тупой характер;
- интенсивность боли усиливается при глубоком дыхании, кашле, глотании;
- интенсивность боли меняется в зависимости от положения тела больного, чаще усиливаясь в положении лежа на спине и уменьшаясь — в положении сидя.
2. Шум трения перикарда выслушивается при сухом перикардите, но только при поражении передней стенки ЛЖ и верхушки сердца. Шум трения выслушивается на ограниченном участке, обычно в области верхушки или абсолютной тупости сердца, лучше — в положении сидя. Как правило, шум сохраняется очень непродолжительное время (от нескольких часов до 2–3 суток). При появлении выпота в полости перикарда шум трения исчезает.
3. Развитие перикардита может сопровождаться повышением температуры тела до субфебрильных цифр.
4. Инструментальная диагностика перикардита нередко затруднена. Типичные ЭКГ-признаки перикардита (снижение вольтажа желудочкового комплекса, однонаправленный конкордантный подъем сегмента RS–Т в нескольких отведениях) часто нивелируются на фоне выраженных инфарктных изменений комплекса QRSТ.
5. Эхокардиография может оказать существенную помощь в диагностике только при выпотных перикардитах. В этих случаях на ЭхоКГ выявляется сепарация париетального и висцерального листков перикарда.
Более подробно диагностика перикардитов описана в главе 12.
Лечение. В большинстве случаев специального лечения эпистенокардического перикардита не требуется. При появлении отчетливых признаков острого перикардита (упорные боли в области сердца, шум трения перикарда) назначают ацетилсалициловую кислоту (150–350 мг 4 раза в сутки) или другие НПВС (ортофен, ибупрофен, диклофенак, мовалис и др.) в обычных терапевтических дозах. В отдельных случаях возможно назначение глюкокортикоидов (преднизолон, метипред и др.), лучше парентерально.
 Запомните
При развитии эпистенокардического перикардита у больных ИМ: Запомните
При развитии эпистенокардического перикардита у больных ИМ:
|
При появлении значительного выпота в полости перикарда, подтвержденного эхокардиографически, боли в сердце и шум трения перикарда исчезают, но нарастают признаки сердечной недостаточности: появляется или усиливается одышка, тахикардия, заметно набухание шейных вен, снижается АД, становятся глухими I и II тоны сердца. В этих случаях следует решить вопрос о проведении однократной или повторных пункций полости перикарда с целью удаления экссудата (подробнее — см. главу 12).
| 6.5.6. Тромбоэмболические осложнения |

|
Тромбоэмболические осложнения существенно ухудшают прогноз ИМ. В связи с широким внедрением в последние годы для лечения ИМ тромболитических препаратов, антикоагулянтов и дезагрегантов частота тромбоэмболических осложнений ИМ снизилась в целом до 5–10%.
Источником тромбоэмболий артерий большого круга кровообращения являются 1) пристеночные тромбы в полости ЛЖ, особенно часто располагающиеся в области аневризмы, и 2) тромбы в левом предсердии, нередко формирующиеся при возникновении фибрилляции предсердий. Особенно большую опасность представляют подвижные тромбы — тромбы на “ножках”. Отрываясь от места их образования, тромбы или их частицы окклюзируют артериальное сосудистое русло, вызывая ишемию и некроз тех или иных органов.
Тромбоэмболия сосудов головного мозга сопровождается разнообразной, внезапно возникающей неврологической симптоматикой, чаще всего — признаками нарушения мозгового кровообращения (гемипарез, гемиплегия, дизартрия, потеря сознания, расстройства функции тазовых органов и т.д.).
Тромбоэмболия мезентериальных артерий является причиной некроза кишечника и развития перитонита. Внезапно у больных появляются очень интенсивные и быстро нарастающие жгучие и нестерпимые боли в животе, которые не купируются ни спазмолитиками, ни наркотическими анальгетиками. Быстро развивается парез кишечника и появляются симптомы острого перитонита и нарастающей интоксикации. В крови определяется выраженный лейкоцитоз и значительный сдвиг лейкоцитарной формулы влево.
Тромбоэмболия артерий конечностей проявляется несколькими внезапно наступающими симптомами:
- резкой нестерпимой болью в конечности;
- побледнением и похолоданием конечности (рис. 6.64, см. цветную вклейку);
- отсутствием артериального пульса ниже места окклюзии.
Быстро развиваются трофические изменения и гангрена конечности.
Тромбоэмболия почечной артерии приводит к развитию инфаркта почек. Внезапно появляются боли в поясничной области и в левом или в правом подреберье, гематурия, олигурия. Обычно отмечается подъем АД, обусловленный ишемией почки.
Тромбоэмболия легочной артерии (ТЭЛА) развивается гораздо чаще, чем эмболии артерий большого круга кровообращения, Источником ТЭЛА в большинстве случаев являются тромбы в глубоких венах нижних конечностей. Последние нередко существуют бессимптомно. Клиническая картина, методы диагностики и лечения ТЭЛА подробно изложены в главе 14.
Профилактика тромбоэмболических осложнений включает:
1. Своевременную диагностику внутрисердечных тромбов и тромбов в глубоких венах нижних конечностей у всех больных трансмуральным ИМ. Наилучшим способом неинвазивной диагностики служит эхокардиография и дуплексное ультразвуковое исследование вен нижних конечностей.
2. При обнаружении подвижных тромбов в полости ЛЖ целесообразно назначение антикоагулянтов: нефракционированного или низкомолекулярных гепаринов с последующим переводом больных на прием непрямых антикоагулянтов (варфарин, фенилин и др.) в течение длительного времени (до 3–6 месяцев).
3. Для профилактики тромбоза глубоких вен нижних конечностей рекомендуется по возможности ранняя активизация больных, занятия лечебной физкультурой.
Более подробно способы профилактики ТЭЛА изложены в главе 14.
| 6.5.7. Постинфарктный синдром Дресслера |

|
Постинфарктный синдром, впервые описанный в 1955 г. Дресслером, — это аутоиммунное поражение перикарда, плевры и легких, возникающее обычно на 2–6-й неделе от начала ИМ. Типичная триада, характерная для постинфарктного синдрома (перикардит, плеврит, пневмонит), иногда сочетается с аутоиммунным поражением синовиальных оболочек суставов. Постинфарктный синдром связывают с обнаружением в организме больных ИМ аутоантител к миокардиальным и перикардиальным антигенам.
Клиническая картина постинфарктного синдрома различается у разных больных в зависимости от преимущественного поражения перечисленных серозных оболочек и легких. Однако обязательным является асептический аутоиммунный процесс в перикарде — перикардит.
Перикардит при синдроме Дресслера обычно протекает нетяжело. На 2–6-й неделе заболевания появляются боли в области сердца, которые носят постоянный, неострый характер и не купируются нитроглицерином. Их продолжительность достигает 30–40 мин и больше. Одновременно повышается температура тела до субфебрильных цифр, появляется слабость. Болевой синдром и лихорадка, как правило, исчезают через несколько дней.
Количество экссудата, накапливающегося в полости перикарда, невелико и не приводит к нарушениям гемодинамики. Изменения ЭКГ обычно мало выражены. При двухмерной ЭхоКГ можно обнаружить уплотнение листков перикарда и их небольшую сепарацию.
Дата добавления: 2016-01-20; просмотров: 799;
